处方工艺对阿普唑仑片混合均匀度及含量均匀度的影响*
郭金秀,曾令高,高梓真,许向阳△,陈 醒,王家辉
(1.江苏恩华药业股份有限公司·江苏省中枢神经药物研究重点实验室,江苏 徐州 221100; 2.重庆市食品药品检验检测研究院·国家药品监督管理局麻醉精神药品质量监测重点实验室,重庆 401121)
1 仪器与试药
1.1 仪器
SHK - 4B 微型湿法混合快速制粒机(西安润天制药机械有限公司);HS-200型三维运动混合机(江苏星星干燥设备有限公司);10A型旋转式压片机(北京新龙立科技有限公司);Phenom 型台式扫描电镜(复纳科学仪器<上海>有限公司);MX-50型气流粉碎机(江苏宜兴聚能超细粉碎设备有限公司);MS2000型马尔文激光粒度仪(英国马尔文仪器有限公司);LC-20AD 型高效液相色谱仪(日本Shimadzu 公司);S30A-1200 型单点粉末取样器(昆山莱曼机械科技有限公司);Branson 8510型超声波(美国Branson公司,频率为40 kHz)。
1.2 试药
阿普唑仑原料药(天方药业有限公司,批号为201108002,含量为100.5%);阿普唑仑对照品(中国食品药品检定研究院,批号为171218 - 201305,含量为99.5%);乳糖(DFE Pharma GmbH & Co.KG,11SD、批号 为109FB0V,30GR、批 号 为1086R4L;MEGGLE GmbH & Co.KG,F100、批号为101502322,T80、批号为63271);微晶纤维素(山东聊城阿华制药股份有限公司,PH102,批号为20200401;安徽山河药用辅料股份有限公司,PH200,批号为B201201;东辰制药有限公司,TLF935,批号为ZC20211001);玉米淀粉(曲阜市药用辅料有限公司,批号为20191201);胶态二氧化硅(Evonik Operations GmbH,批号为150102314);硬脂酸镁(山东聊城阿华制药股份有限公司,批号为20180801)。
2 方法与结果
2.1 处方与工艺
5 000 片处方用量:阿普唑仑2 g,乳糖490 g,微晶纤维素120 g,玉米淀粉30 g,胶态二氧化硅5.0 g,硬脂酸镁2.5 g。
工艺:按处方用量称取原辅料约650 g,将阿普唑仑与乳糖混合,过60目筛,置湿法混合制粒机内,搅拌(转速为600 r/min),混合10 min;转移至三维运动混合桶中,加入过筛后的微晶纤维素、玉米淀粉、胶态二氧化硅进行初混,混合(频率为12 Hz)20 min,加入过筛后的硬脂酸镁进行总混,最终得到生产所需混合均匀的中间体混粉。
2.2 含量测定
2.2.1 色谱条件
色谱柱:上海月旭(Welch)Ultimate AQ - C18柱(250 mm × 4.6 mm,5 μm);流动相:醋酸盐缓冲液(称取醋酸铵0.77 g,加水溶解并定容至1 000 mL,用冰乙酸调pH 至4.7)-甲醇(30∶70,V/V);柱温:35 ℃;检测波长:254 nm;流速:1.0 mL/min;进样量:20 μL。
2.2.2 溶液制备
对照品溶液:取阿普唑仑对照品适量,精密称定,加甲醇溶解并定容,制成质量浓度为100 μg/ mL 的对照品贮备液;取适量,用乙腈-水(9∶1,V/V)稀释,制成质量浓度为20 μg/mL的对照品溶液。
供试品溶液1:取样品130~390 mg(约相当于阿普唑仑0.4~1.2 mg),全量转移至50 mL 容量瓶中,加乙腈-水(9∶1,V/V)适量,超声(频率为40 kHz)20 min使溶解,放冷,用乙腈-水(9∶1,V/V)稀释并定容,摇匀,滤过,取续滤液,作为混合均匀度测定供试品溶液。
供试品溶液2:取样品1 片,置20 mL 容量瓶中,加水2 mL,超声(频率为40 kHz)20 min 使崩解,加乙腈适量,超声处理使溶解,放冷,用乙腈定容,摇匀,滤过,取续滤液,作为含量均匀度测定供试品溶液。
2.2.3 方法学考察
取阿普唑仑对照品10 mg,精密称定,置25 mL容量瓶中,加乙腈-水(9∶1,V/V)溶解并定容,作为线性对照品贮备液。精密量取上述贮备液适量,用流动相稀释成含阿普唑仑8,16,20,24,30 μg/mL 的系列线性测定溶液,按2.2.1项下色谱条件进样测定,以阿普唑仑质量浓度(C,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程Y= 42 513C- 4 765.2(r= 0.999 9,n=5)。结果表明,阿普唑仑质量浓度在8~30 μg/mL范围内与峰面积线性关系良好。精密度、重复性、稳定性、加样回收试验的结果均符合定量分析要求。
2.3 混合均匀度与含量均匀度评价标准
混合均匀度[10]:总混后,使用S30A - 1200 型单点粉末取样器分别从三维混合机内分3 层(编号A -C)、10 个取样点(编号1 - 10)取样,计算每个点的含量及RSD。取样示意图见图1。

图1 取样示意图Fig.1 Schematic diagram of sampling
含量均匀度[11]:压片过程中,每隔5 min 取样,共取10 个时间点,每个时间点取3 片,并对每个时间点中的1片进行含量测定,计算10个样品含量的A+2.2S。
2.4 处方对混合均匀度与含量均匀度的影响
乳糖型号:选择乳糖作为主要填充剂,处方占比超过75%。乳糖与原料药的结合度对中间体混合均匀度影响可能较大[12]。以2.1 项下处方为基础,通过调整乳糖型号,建立处方1(乳糖11SD)、处方2(乳糖F100)、处方3(乳糖T80)和处方4(乳糖30GR);采用相同的混合工艺,确定微晶纤维素PH102,依法制备样品,并考察对混合均匀度、含量均匀度的影响,结果见图2。可见,按处方1,2,3,4 制备的中间体混粉片的混合均匀度及含量均匀度存在差异,喷雾干燥乳糖11SD 和乳糖F100混合均匀度的RSD远低于5%,含量均匀度(A+2.2S)均远低于15.0;其他颗粒乳糖混合均匀度的RSD接近5%或超过5%,含量均匀度(A+2.2S)均大于10,接近15。表明喷雾干燥乳糖对物料混合不均匀及压片不均匀的风险较小。对不同型号的乳糖进行电镜扫描,11SD乳糖和F100乳糖均为球形,粗糙,表面疏松多孔;乳糖T80和乳糖30GR均为相对密集的块状,较光滑(图3)。可见,喷雾干燥乳糖11SD、乳糖F100 的多孔结构更有利于小粒径药物的吸附,形成有序单元有利于混合均匀[12]。故乳糖11SD 和乳糖F100 的处方混合均匀度及含量均匀度更优。
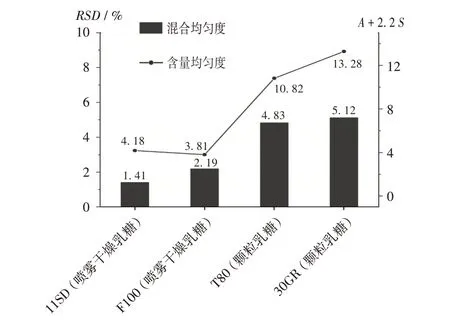
图2 乳糖型号对混合均匀度与含量均匀度的影响Fig.2 Effect of lactose types on blend uniformity and content uniformity

A.乳糖11SD B.乳糖F100 C.乳糖T80 D.乳糖30GR图3 不同型号乳糖电镜扫描的表观形态(×800)A.Lactose 11SD B.Lactose F100 C.Lactose T80 D.Lactose 30GRFig.3 Scanning electron microscopy picture of different types of lactose(×800)
微晶纤维素型号:选择微晶纤维素作为填充剂,处方占比为18%。不同厂家、不同型号的微晶纤维素因微观结构、粒度、含水量等不同,对制剂的质量有一定影响[13-14]。以2.1项下处方为基础,通过调整微晶纤维素型号,建立处方1(PH102)、处方5(PH200)、处方6(TLF935),确定乳糖11SD,依法制备样品,并考察对流动性、混合均匀度和含量均匀度的影响,结果见表1。可见,按处方1,5,6 制备的中间体混粉片的流动性相近,混合均匀度的RSD均远低于5.0%,表明其对物料混合不均匀的风险较小;含量均匀度(A+ 2.2S)均远低于15,表明含量均匀度良好,压片过程分层造成含量不均匀的风险较小。表明微晶纤维素PH102,PH200,TLF935 对阿普唑仑片混合均匀度及含量均匀度的影响均无明显差异。
玉米淀粉用量:选择玉米淀粉作为填充剂,处方占比为5%,流动性较差,可能影响混合均匀度与含量均匀度。以2.1 项下处方为基础,通过调整玉米淀粉的用量,建立处方7(3%,18 g)、处方1(5%,30 g)、处方8(8%,48 g);确定乳糖为11SD、微晶纤维素为PH102,各处方制剂质量一致。通过改变处方中微晶纤维素的用量调整玉米淀粉用量,依法制备样品,并考察对流动性、混合均匀度和含量均匀度的影响,结果见表2。可见,按处方7,1,8 制备的中间体混粉片的流动性相近,休止角无明显差异,表明其用量在该范围内对物料的流动性无明显影响;混合均匀度均≤3.0%,含量均匀度(A+ 2.2S)均远低于15,表明不同玉米淀粉的用量(3%,5%,7%)对阿普唑仑片混合均匀度及含量均匀度的影响均无显著差异。

表2 不同用量玉米淀粉考察结果Tab.2 Investigation results of different amounts of corn starch
胶态二氧化硅用量:选择胶态二氧化硅作为助流剂,对药物颗粒有良好的分散性,可降低颗粒间的摩擦力,改善粉末流动性[15],不同用量可能会影响物料的流动性、混合均匀度和含量均匀度。以2.1 项下处方为基础,通过调整胶态二氧化硅的用量,建立处方1(0.3%,2 g),处方9(0.8%,5 g),处方10(1.2%,8 g);确定乳糖为11SD、微晶纤维素为PH102,各处方制剂质量一致。通过改变处方中二氧化硅用量调整乳糖用量,依法制备样品,并考察对流动性、混合均匀度和含量均匀度的影响,结果见表3。可见,按处方1,9,10制备的中间体混粉片的流动性略有差异,随着二氧化硅用量的增加,流动性更优;二氧化硅用量为0.3%的处方混合均匀度的RSD与含量均匀度(A+ 2.2S)结果偏大,混合效果略差;二氧化硅用量为0.8%和1.2%处方的混合均匀度与含量均匀度结果相近,混合效果均能达到要求。因此,胶态二氧化硅用量在0.8%~1.2%范围内,对提升阿普唑仑片的混合均匀度与含量均匀度有积极作用。
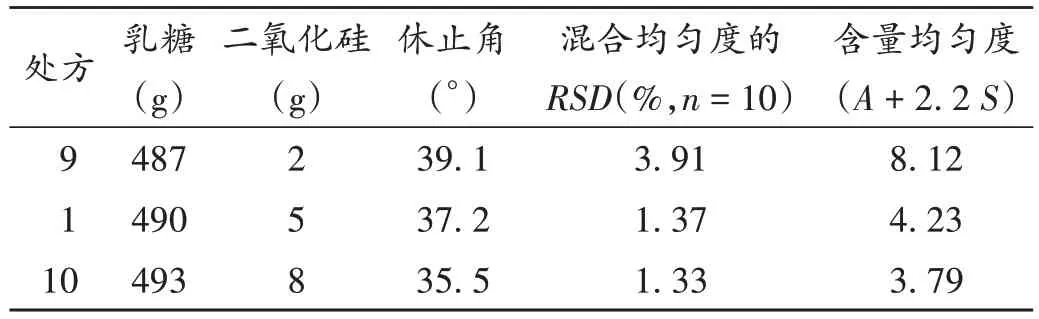
表3 不同用量胶态二氧化硅的考察结果Tab.3 Investigation results of different amounts of colloidal silica
2.5 工艺对混合均匀度与含量均匀度的影响
阿普唑仑粒度:不同物料颗粒的粒径差异大是造成混合不均匀的重要因素,混合过程中应尽量使待混合物料粒径相近[16-17]。合适的粒子群有利于药物混合均匀,微粉化原料药可提高原辅料的接触面积,有利于低剂量药物的均匀分散[9];另外,药物粒径越小,则凝聚力越强,越易团聚或黏附在赋形剂颗粒的表面,使混合均匀度合格[18]。采用不同粒度原料药制备样品,考察原料药的粒度对中间体混合均匀度、成品含量均匀度的影响。采用气流粉碎机对阿普唑仑进行微粉化处理,通过调节粉碎气压获得不同粒径的原料药,并采用激光粒度仪测定各样品的D10,D50,D90。取不同粒径的原料药,按2.1 项下处方与工艺进行混合,混合结束取样,测定混合均匀度,并对混合后的中间体进行压片,测定含量均匀度。不同粒径对混合均匀度及含量均匀度的考察结果见表4。可见,原料药粒径越大,混合均匀度及含量均匀度越差;随着粒径的减小,混合效果越好。当阿普唑仑的D90≤35 μm时,混合均匀度均低于3.0%,含量均匀度(A+2.2S)均在15以下,混合不均匀的风险较小。

表4 阿普唑仑的粒度对混合均匀度与含量均匀度的影响Tab.4 Effect of alprazolam particle size on blend uniformity and content uniformity
混合方式:影响混合效果的因素包括物料性质、混合工艺和混合设备[19]。不同的粉体在不同的混合器中和不同的旋转速度下,粉体的混合运动形态不同,混合效果不同[20]。因此,考察混合工艺和混合设备对混合效果的影响十分必要。按2.1项下处方工艺称取各原辅料进行不同混合方式的考察(表5),制备3批样品,考察混合方式对混合均匀度和含量均匀度的影响(表6)。原料药与乳糖预混阶段,采用三维运动混合机进行混合,不同混合方式的混合均匀度与含量均匀度差异显著,3 批样品的混合均匀度RSD均超过5.0%,含量均匀度(A+2.2S)均超过15.0,表明混合不均匀;预混阶段采用湿法制粒锅混合,3 批样品的混合均匀度及含量均匀度均良好。因此,需根据物料特性、产品规格等选择合适的混合方式,以降低混合不均匀的风险。

表5 2种混合方式混合过程描述Tab.5 Description of the mixing process of two mixing methods

表6 不同混合方式考察结果Tab.6 Investigation results of different mixing methods
混合时间:按2.1 项下处方工艺,考察原料药与乳糖在湿法制粒机中以600 r/ min 转速混合5,8,10 min的混合均匀度RSD及中间体含量;转移到三维运动混合机中加入微晶纤维素、玉米淀粉、二氧化硅后,以频率12 Hz 混合15,20,25 min 的混合均匀度RSD及平均含量,结果见图4。结果显示,第一步,混合5 min 的混合均匀度RSD大于5.0%,混合不均匀,8 min 的混合均匀度RSD接近5.0%,质量风险较高,10 min的混合均匀度RSD远低于5.0%,混合效果较好;第二步,15~25 min的混合均匀度RSD均低于5.0%。表明第一步的混合时间对混合均匀度的影响较显著,第一步混合均匀后,第二步以12 Hz混合15~25 min,物料能混合均匀。

A.第一步混合 B.第二步混合图4 混合时间对混合均匀度的影响(n=10)A.Step 1 B.Step 2Fig.4 Effect of mixing time on blend uniformity(n = 10)
压片机转速:压片过程中存在机械振动,会使混合均匀的物料产生分层,导致片剂的含量均匀度变差[21]。分别设定压片机转速为10,20,30 r/min,取样,测定含量均匀度(A+2.2S)及平均含量,结果见图5。可见,随着压片转速的增加,含量均匀度(A+2.2S)逐渐增大,表明含量不均匀的风险越高;转速为10~20 r/min 时,含量均匀度(A+ 2.2S)较低,不均匀的风险较小;当转速达30 r/ min 时,含量均匀度A+ 2.2S较高,接近15,质量风险较高。因此,为降低压片分层风险,转速不能过高,避免物料分层而导致含量均匀度不合格。

图5 压片机转速对含量均匀度的影响(n=10)Fig.5 Effect of press machine's speed on content uniformity(n = 10)
2.6 处方工艺验证
基于上述处方工艺的优化结果,分别制备3 批样品,按2.1 项下处方配比称取原辅料,确定乳糖11SD、微晶纤维素PH102,并按2.1项下工艺进行混合,3批总混后混合均匀度的RSD分别为1.92%,1.78%,2.10%(n=10)。压片阶段,按压片转速为10 r/min 进行压制,分别对每批压片前、中、后随机取样10片测定含量及其均匀度,结果见表7。可见,3批样品压片前、中、后的相对含量均在95%~105%之间,含量均匀度(A+2.2S)均低于15.0,质量均符合要求,表明所筛选的辅料及工艺可行。

表7 压片过程中不同取样点的片剂含量及含量均匀度Tab.7 Tablet content and content uniformity of different sampling points in the process of tableting process
3 讨论
物料的混合均匀度及含量均匀度是低剂量药物制剂采用直接压片工艺开发过程中的难点,目前尚无关于阿普唑仑片混合均匀度及含量均匀度的研究报道。本研究中通过单因素试验分析混合均匀度及含量均匀度对处方工艺的影响因素,筛选辅料型号与用量、原料药粒径范围、混合方式与混合时间、压片机转速。通过验证连续3批样品的混合均匀度及含量均匀度,确认阿普唑仑片处方工艺的可行性。
本研究中,通过不同型号的乳糖与阿普唑仑混合,发现圆形表面粗糙的喷雾干燥乳糖11SD、乳糖F100 的多孔结构,更有利于提高混合均匀度;微晶纤维素的型号及玉米淀粉的用量对混合均匀度及含量均匀度影响较小;二胶态氧化硅用量在0.8%~1.2%范围内的处方混合均匀度及含量均匀度均良好。低剂量的制剂原料药经微粉化后,有助于提高混合均匀性[22]。本研究中原料药经气流粉碎机粉碎,当粒径D90≤35 μm 时,能保证混合均匀度符合要求;预混阶段采用湿法制粒机对混合物直接进行强制混合,当混合时间达到10 min 时,混合效果能满足需求;另外,压片过程中由于机械振动等原因引起的混合物料分层也是间接影响片剂含量均匀度的原因,采用较低转速(10~20 r/min)进行压片,可避免物料因振动引起的分层。所优选的处方工艺适用于阿普唑仑片的含量均匀度和质量控制,可用于工业化生产。

