铜合金在海水中的腐蚀与防护研究进展
孙宇海漩,贺春林,杨 杰,凌云鹤,池坪礁
(沈阳大学 辽宁省先进材料制备技术重点实验室,辽宁 沈阳 110044)
1 前 言
2015年中国工程院重大咨询项目“我国腐蚀状况及控制战略研究”结果显示[1],我国2014年腐蚀损失约为2.1278万亿元人民币(约合3100亿美元),约占国内生产总值(GDP)的3.34%。据估计,海洋腐蚀损失约占其中的1/3左右,约为7093亿元。可见,海洋腐蚀造成的损失相当严重。
铜及铜合金具有优良的导热、导电、耐蚀性和抗海生物污损性能,以及良好的力学性能和加工成形性,广泛应用于舰船、滨海电厂、海水淡化厂等海洋工程中[2-4]。海水是一种成分很复杂的天然电解质,除了含有大量盐类以外,还含有溶解氧、二氧化碳、海生物和腐败的有机物。海洋工程中的铜及铜合金长期处于海水冲刷、干湿交替的富氧盐雾以及强紫外线辐照等恶劣环境中[5],易发生点蚀、选择性腐蚀、电偶腐蚀、缝隙腐蚀、晶间腐蚀、应力腐蚀、腐蚀疲劳、空泡腐蚀和海生物污损等形式的破坏[6-8],不仅会导致铜及铜合金零部件的使用性能和使用寿命下降,还会造成环境的污染和资源的浪费,严重的还会引发安全事故。长期以来,国内外学者对铜及其合金在海洋环境下的腐蚀行为和腐蚀机理开展了广泛研究,研发了一系列铜合金海水腐蚀防护技术,有效保障了海洋工程中铜和铜合金构件的使用性能及使用寿命。本文将综述铜及铜合金的海水腐蚀机理、海水腐蚀的影响因素以及铜合金海水腐蚀防护技术等方面的研究进展。
2 铜合金在海水中的腐蚀机理
Constantinides等[9]研究了5种铜合金在含Cl-溶液中的腐蚀产物层,发现腐蚀产物的形貌和成分取决于铜合金的化学成分。例如,锡青铜的腐蚀产物由多孔的外层、致密的中间层和内层组成,对应的成分分别为Cu2CO3(OH)2、Cu2O和CuCl;然而,黄铜的腐蚀产物由致密的和海绵状的结构组成,产物膜从外至内为氯化亚铜(CuCl、CuCl2-或CuCl3-)和Cu2O。将Cu-Ni-Al合金浸泡于NaCl溶液中,在合金表面逐渐形成含有Al2O3、NiO和Cu2O的复合氧化层,这也是铜合金钝化的第一阶段。所得氧化物具有良好的致密性、高的膜电阻和强的保护性能[10]。铜在含Cl-溶液中的腐蚀产物可能有CuCl、CuCl2、Cu2(OH)3Cl和Cu2O等[11,12]。
铜镍合金在海水中的阴极反应过程主要是氧去极化的还原反应:
O2+2H2O+4e-→4OH-
(1)
当腐蚀电位区间为活化区时,铜镍合金(如B10)以Cu+形式溶解并与Cl-络合,其中Cu+具有抗菌性能,铜镍合金在海水中发生的阳极反应为:
Cu→Cu++e-
(2)
Cu++Cl-→CuClads
(3)
(4)
当腐蚀电位区间为钝化区时,CuCl2-会发生溶解并产生沉积反应,形成Cu2O膜,该膜会阻碍Cl-向电极表面扩散从而对金属表面起保护作用,铜镍合金在海水中发生的阳极反应为:
(5)
当腐蚀电位区间为过钝化区时,Cu2O膜被氧化,表面生成疏松多孔的Cu2(OH)3Cl膜,该膜不具备抗菌性且对金属的保护性很差,而阳极的极化电流密度迅速增加,铜镍合金在海水中发生的阳极反应为:
(6)
铜镍合金中的Ni在海水中发生的阳极反应为:
Ni→Ni2++2e-
(7)
Ni2++2OH-→NiO+H2O
(8)
铜镍合金在海水中的腐蚀产物膜为双层结构,内层为具有保护性的致密Cu2O和NiO复合膜,外层为非保护性的多孔Cu2(OH)3Cl膜层[10]。
3 铜合金在海水中腐蚀的影响因素
3.1 铜合金类型的影响
不同种类铜合金的耐蚀性能差距较大。白铜中的镍和青铜中的锡﹑铝有利于改善耐蚀性;紫铜中的杂质较少,耐蚀性能也较好;黄铜中杂质较多,耐蚀性较差。
在海洋环境中,不同种类及牌号的铜合金耐腐蚀的能力及腐蚀形式也不同。表1为紫铜(TUP)、硅青铜(QSi3-1)、锡青铜(QSn6.5-0.1)和锰黄铜(HMn58-2)在三亚榆林站实验点全浸1 a的腐蚀失厚率[13,14]。硅青铜的腐蚀速率最快,存在较为严重的点蚀和缝隙腐蚀;锰黄铜和紫铜的腐蚀速率也较高,锰黄铜腐蚀形式为严重的脱锌腐蚀,紫铜腐蚀形式为局部腐蚀。锡青铜腐蚀速率较低,主要发生均匀腐蚀。
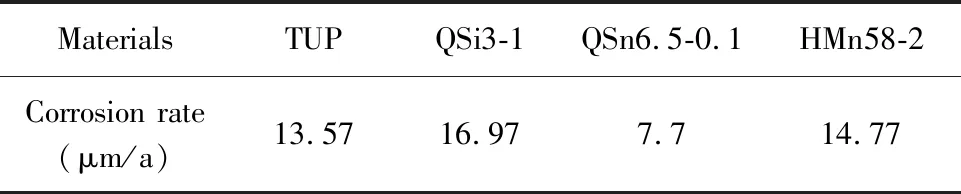
表1 4种铜合金在三亚榆林站的腐蚀失厚率[13, 14]
孙飞龙等[15]在中国南海海域深度1200 m的深海环境中,进行了H62黄铜、QAl9-2铝青铜和QSn6.5-0.1锡青铜时间为3 a的实海暴露实验。结果表明,H62黄铜的腐蚀速率最高,可达0.042 mm/a;QAl9-2铝青铜的腐蚀速率最低,仅有0.003 mm/a;锡青铜腐蚀速率居中,为0.004~0.007 mm/a。在深海环境下,H62黄铜发生了严重的脱锌腐蚀,结合X射线衍射(XRD)和X射线能谱仪(EDS)分析发现,腐蚀产物中含有Cu,符合溶解-再沉积机制;铝青铜和锡青铜为脱成分(Al,Sn)腐蚀。
Ding等[16]通过海洋自然环境试验,研究了T2和B30合金在南海海水中的腐蚀行为,结果表明,T2合金的腐蚀速率随海水深度的增加而减小,而B30合金的腐蚀速率则相反。T2合金在不同海水深度的腐蚀速率受海水温度和溶解氧浓度变化的影响,静水压力对T2合金腐蚀速率的影响不明显,但较高的静水压力可以促进Cl-穿透腐蚀产物膜。B30合金的腐蚀产物膜同时受溶解氧浓度和静水压力的影响,且产物膜中富含的Ni和Fe元素会进一步加重合金的点蚀、缝隙腐蚀和晶间腐蚀。
3.2 不同海域的影响
由于不同海域所处的环境不同,如温度、盐浓度、pH值、海水流速等,因此铜合金在不同海域的腐蚀情况会存在差异。表2为不同海域环境因素的年平均值[17]。
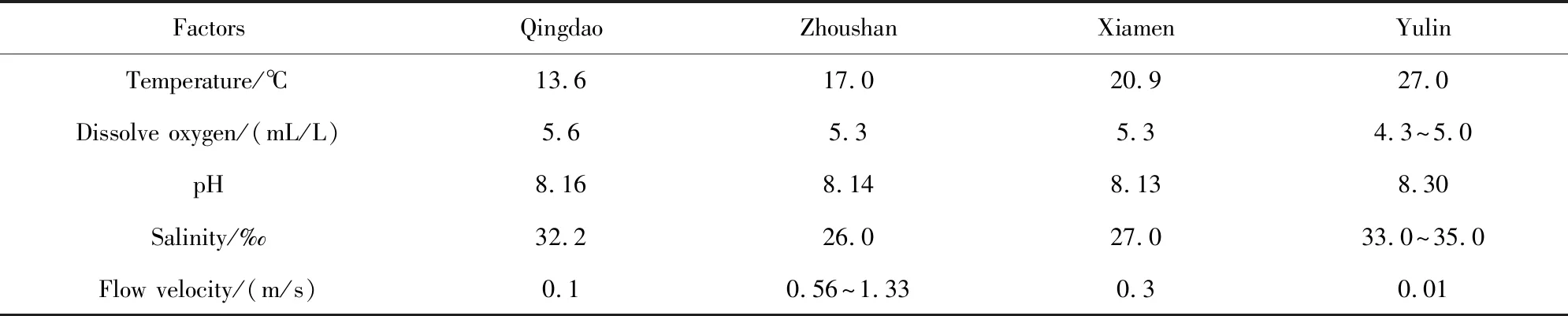
表2 试验站海水环境因素(年平均值)[17]
彭文山等[18]通过在青岛港口进行海水全浸实验,研究了铜镍合金B10的腐蚀性能,发现试样表面出现大量点蚀坑,半年后的最大点蚀深度达到21.69 μm,腐蚀速率达到0.015 mm/a左右。陈翔峰等[19]研究发现,铜及铜镍合金在厦门海域的海洋环境中以均匀腐蚀为主,B10合金的腐蚀速率为0.009 mm/a。虽然青岛海域的海水温度较低,可以减缓腐蚀速率,但是盐浓度高于厦门海域,会加重腐蚀速率,综合影响下,实验研究表明铜合金在青岛海域腐蚀速率略高于厦门海域。
刘大扬等[20]研究了铜镍合金B30在榆林海域暴露4 a的腐蚀行为,实验发现,随着时间的增加,B30合金在全浸区的腐蚀速率不断下降。进一步比较了B30合金在榆林海域和青岛海域海水中的腐蚀速率,结果表明,B30合金在榆林海域暴露2 a的腐蚀速率大约是青岛海域的1.3倍,这是由于榆林站为热带海洋环境,海水温度相对较高,铜合金的腐蚀速率较快。
赵月红等[17]研究了纯铜、青铜、黄铜和白铜等19种铜及铜合金在青岛、舟山、厦门和榆林4个海域浸泡16 a的腐蚀性能,结果表明,在全浸区,各种铜合金平均腐蚀速率按青岛、厦门、榆林和舟山依次递增,平均点蚀深度按厦门、青岛、舟山和榆林依次递增。由于舟山海域的海水是典型的含泥沙海水,海水流速也远大于其他海域,因此铜合金在舟山海域的腐蚀速率最大,而榆林站海域因温度较高,导致铜合金点蚀深度最大。
3.3 海水流速的影响
海水流速对铜合金的耐蚀性能有明显的影响,一般情况下,海水的流速越高,铜合金的腐蚀越快。目前有关海水流速对铜及铜合金腐蚀速率影响的研究大都是在实验室内模拟进行的,而在实海中的试验数据则很少,主要是因为实海中的不可控因素较多,无法精确单一控制海水流速。
李晓孟等[21]采用冲刷试验和电化学技术研究了人工海水流速(1.5~3.0 m/s)对铜镍合金B10腐蚀速率和表面膜的影响。结果表明,随海水流速的增加,B10合金的腐蚀速率不断增加,当海水流速达到3.0 m/s后,腐蚀速率明显增加,表面出现大量冲蚀坑。冲蚀形貌和电化学测试结果显示,海水流速对产物膜形貌和性能有影响。海水流速为1.5 m/s时,96 h后在B10合金表面开始形成保护性的产物膜,腐蚀速率减小。当模拟海水的流速为3.0 m/s时,192 h后在B10合金表面才形成产物膜,且膜层容易被破坏。
杜鹃等[22]在研究静态海水与流动海水对铜镍合金B10的腐蚀速率的影响时发现,相对于静态海水中的铜镍合金腐蚀速率,流动的海水中铜镍合金的腐蚀速率明显较高,随着海水流速的增加,B10合金腐蚀速率增加,冲刷腐蚀时间延长,腐蚀速率逐渐变小并趋于稳定,如图1所示。海水流速对B10合金的自腐蚀电位也有影响,如图2所示。静态海水条件下,合金表面会形成不均匀的氧化膜,造成前期腐蚀电位不稳定;流动海水条件下,腐蚀电位相对比较稳定。这是因为流动条件下,合金表面接触的Cl-和OH-较多,加快表面腐蚀产物膜的形成,所以电位相对稳定。相对于静态条件,合金在流动海水条件下的腐蚀电位负移,腐蚀速率较快。
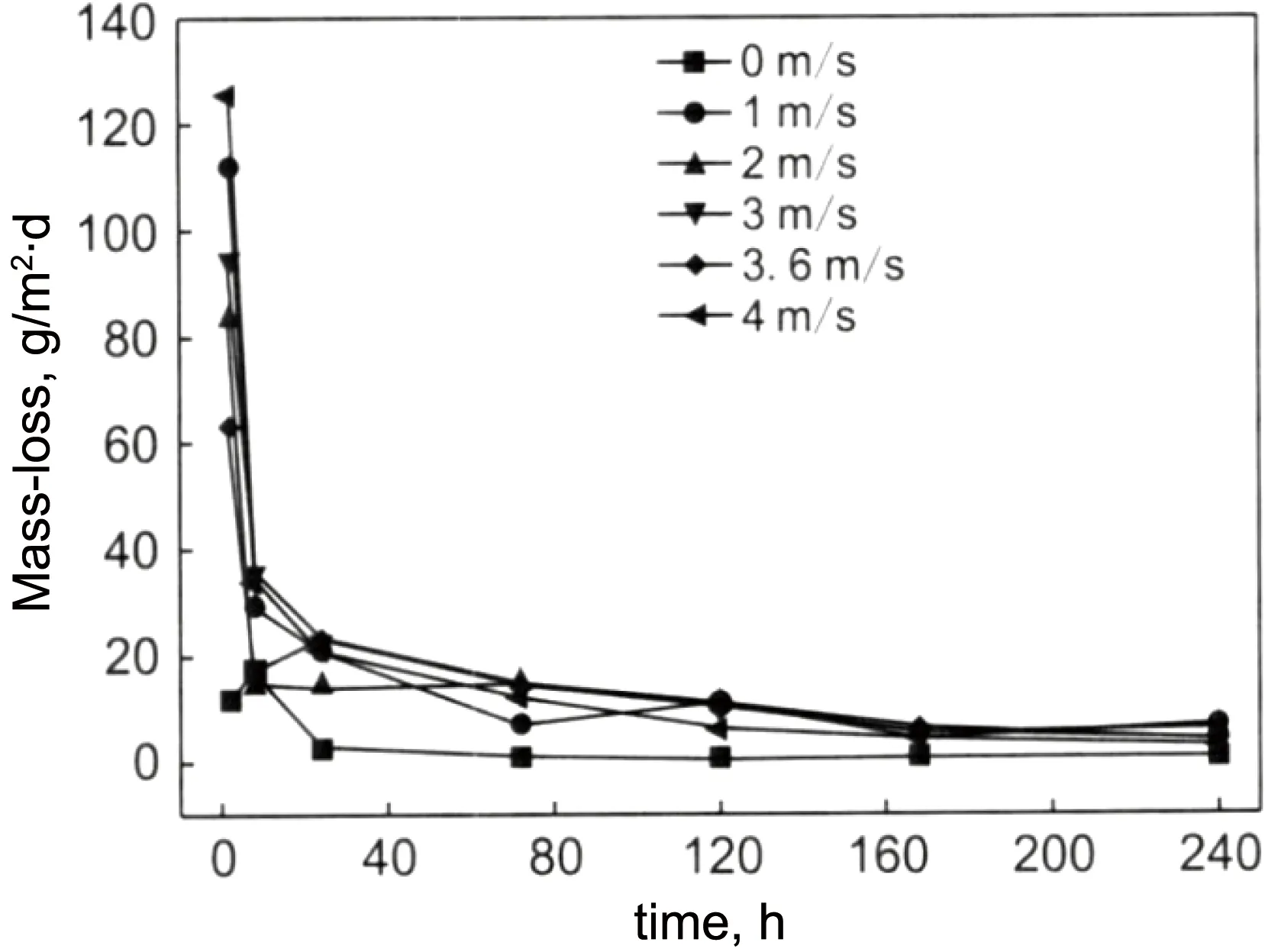
图1 B10合金在不同流速的海水中被冲刷腐蚀后的质量损失随时间的变化[22]
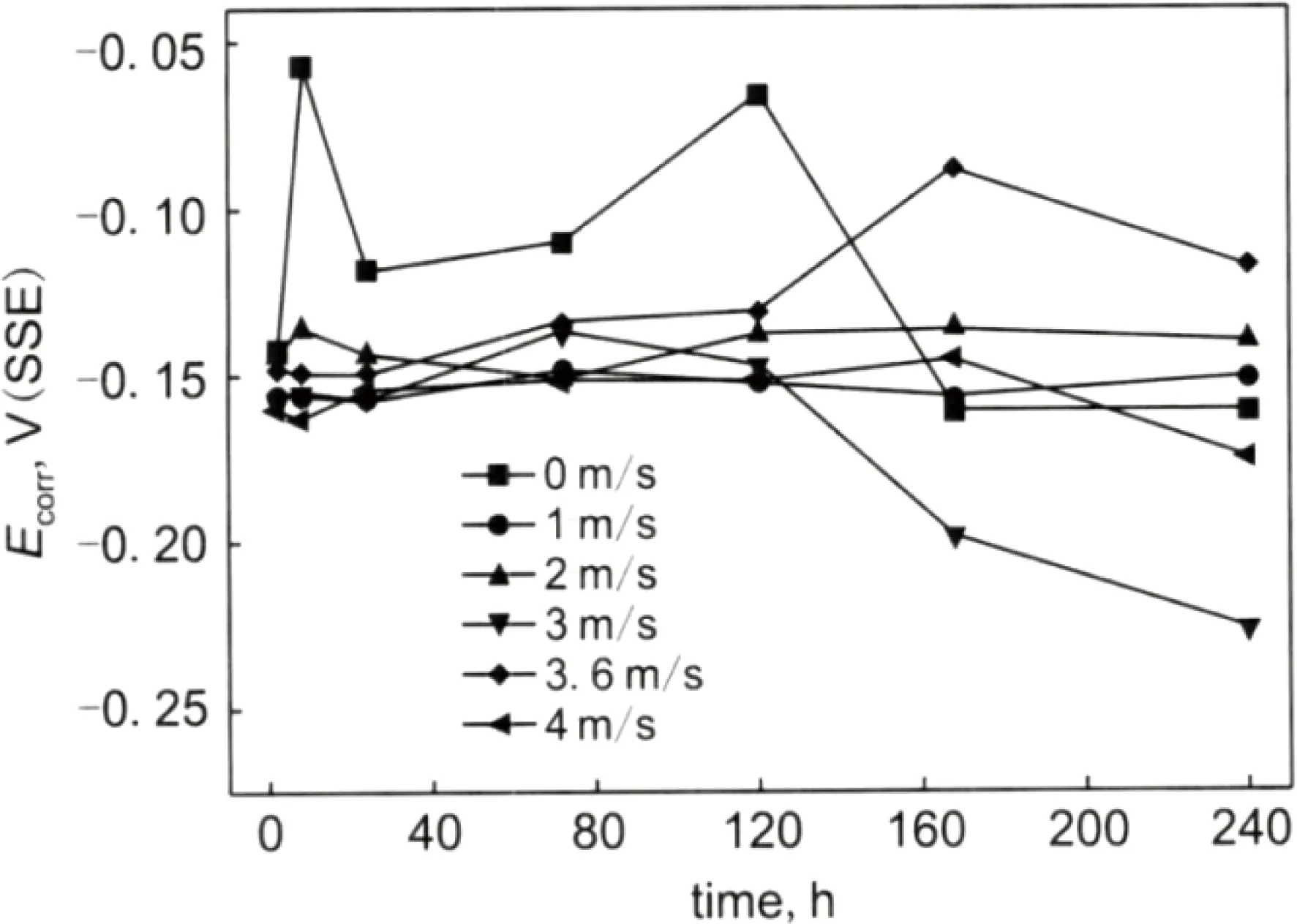
图2 B10合金在不同流速的海水中经过冲刷腐蚀后自腐蚀电位随时间的变化[22]
戴明城等[23]采用电化学技术进一步研究了海水流速(0,3和6 m/s)对B10合金表面膜耐蚀性的影响,实验结果表明,随着海水流速的增加,膜层电阻和电荷转移电阻都逐渐减小,原因是随着海水流速的增加,对B10表面冲刷变得严重,结果使铜合金表面不能形成稳定的钝化膜,而氧化膜厚度减少会使膜层的电阻降低;同时,增加流速还会促进电荷转移,从而使电荷转移电阻降低。
Besghaier等[24]采用电化学技术系统研究了B10合金在静止(0 L/s)和流动(0.01 L/s,0.026 L/s)海水中的腐蚀行为,实验结果显示,在流动条件下,腐蚀电位提高,而极化电阻值则下降,合金的腐蚀速率变快。在静止海水中,海水对金属的溶解腐蚀没有产生很大的影响,但会有钙和镁盐等物质沉积在样品表面,造成合金表面的腐蚀损失。二者相比之下,流动条件会造成合金表面的冲刷腐蚀,并加速B10合金的溶解,对合金的腐蚀破坏更严重。
3.4 pH值的影响
罗宗强等[25]研究了在不同pH值的3.5% NaCl(质量分数,下同)溶液中Cu-17Ni-3Al-X铜合金的耐腐蚀性能,如图3所示。在pH值较低时(pH=3),合金腐蚀速率较高;增加溶液pH值至6~10,合金腐蚀速率会明显变慢;在pH值超过10后,腐蚀速率又有所下降(pH=10~12)。这是因为在pH值为3的酸性溶液中,合金表面难以形成致密的腐蚀产物膜;但在近中性和弱碱性溶液中(pH=6~10),合金表面会产生富Ni和Al的Cu2(OH)3Cl和Cu2O的产物膜;而在较强碱性溶液中(pH=12),合金表面会形成致密的Cu2O膜,Cu2O产物膜具有保护性,可以减缓基体合金的腐蚀反应。
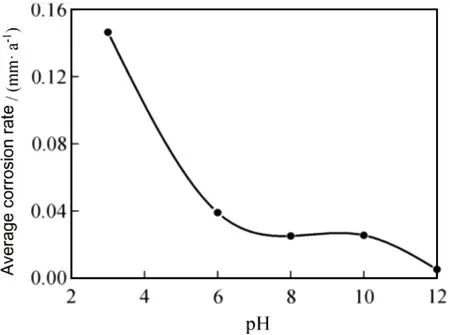
图3 Cu-17Ni-3Al-X耐磨铸造铜合金在不同pH值的3.5% NaCl溶液中的平均腐蚀速率[25]
陈海燕等[26]研究了铜镍合金BFe30-1-1在酸性和碱性溶液中(pH=3,8.5,14)的腐蚀行为,发现该合金在pH=14的溶液中的耐腐蚀性优于在酸性(pH=3)和弱碱性(pH=8.5)溶液。BFe30-1-1在酸性和弱碱性溶液中发生脱镍腐蚀,而在强碱性溶液中,在低电位下发生脱铜腐蚀,在高电位下则发生脱镍腐蚀。
Guo等[27]通过电化学测试和浸泡试验研究了W-Cu合金在不同pH值条件下的腐蚀行为,得出以下结论:在低pH值条件下,W-Cu合金中的W相被WO3膜保护,而Cu粘结剂被溶解,且W相和Cu粘结剂的微电偶效应可以忽略不计。在中等pH值条件下,Cu粘结剂受到保护,而W相由于微电偶效应被溶解。这是由于W含量较高,W-Cu合金经长时间浸泡后,表面生成的钨氧化物有一定的缓蚀作用。在高pH值条件下,Cu粘结剂与W相之间的微电偶效应增强,导致W-Cu合金的耐蚀性因W相的溶解而降低。W-Cu合金中W相与Cu粘结剂之间的微电偶效应会受到pH值的影响。在低pH值条件下,这种影响不明显,但随着pH值的升高,这种影响会增强。
Khan等[28]研究了NaCl浓度(0.5%,1.5%,2.5%,3.5%,4.5%)和pH值(6和8)对铜镍合金B10耐蚀性能的影响,如图4所示。结果表明,在pH=8时,腐蚀电流密度随着NaCl浓度的增加而升高;而在pH=6时,腐蚀电流密度随着NaCl浓度的增加先升高后降低,在NaCl浓度为2.5%时,腐蚀电流密度达到最高。在NaCl浓度在1.5%~4.5%之间、pH=8时的合金腐蚀电流密度较低,这是因为在pH=8时,随着NaCl浓度的增加,腐蚀电流密度升高,且产生的Cu2O膜比pH=6时形成的Cu2O膜厚,膜层越厚,则阴极反应的速率越慢,金属的腐蚀速率也越慢。而在pH=6时,溶液本身为弱酸性,更容易发生催化溶解反应,加快阴极反应速率,不利于合金的保护。
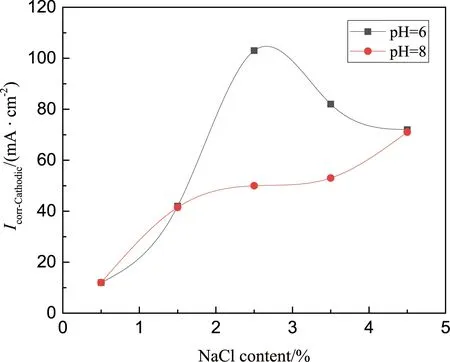
图4 NaCl溶液浓度和pH值对B10合金Icorr-cathodic的影响[28]
3.5 微生物的影响
海洋中微生物种类、粘附程度和表面膜性质等对铜及铜合金的耐腐蚀性能有很大影响[29,30]。
Carvalho等[31]采用在线监测和离线微生物分析方法,研究了B30铜镍合金和铝黄铜合金在海水中的腐蚀行为。监测数据显示,海洋杆菌、交替单胞菌和假单胞菌对铜合金均产生了腐蚀作用,金属表面形成的生物膜会产生污垢,从而使金属受到腐蚀。微生物分析结果显示,3种微生物均可在铜表面菌落化,其中,假单胞菌属是已知的细胞外聚合物的生产者,它有助于生物膜的机械稳定性,使生物膜与金属表面保持稳定的粘附[32],并加速铜及铜合金的腐蚀。
Li等[33]采用开路电位、阳极极化曲线和电化学阻抗谱技术研究了T2铜在海水微生物中的腐蚀行为。扫描电子显微镜观察发现,浸泡在含微生物的海水中30 h的T2铜表面有少量半透明的杆状细菌菌落。对浸泡60 h时间内的开路电位监测结果显示,T2铜的自腐蚀电位随着浸泡时间延长而下降。而在含有微生物的海水条件下,T2铜的自腐蚀电位更负,这会导致T2铜表面钝化膜破裂,加速腐蚀。浸泡30 h后的极化曲线测试结果显示,铜在含微生物溶液中的钝化区电流密度大于不含微生物溶液,证明了微生物能够促进铜的腐蚀。阻抗谱分析表明,微生物能降低铜的交流阻抗值、极化电阻和表面电阻,从而加速腐蚀。微生物在铜表面的粘附加速了表面层的溶解,使钝化膜被松散的生物膜层取代。在含有微生物的海水中,铜的极化电阻值低于不含微生物的海水,表明微生物对腐蚀有促进作用。而微生物的频繁活动也会导致铜膜表面的部分溶解和开裂,易使表面形成缺陷并增加表面孔隙率。
硫酸盐还原菌(sulfate-reducing bacteria,SRB)作为海洋中最常见的菌种,对铜合金的破坏能力很强。Chen等[34]通过表面分析和电化学测试,研究了SRB对纯铜在海水中腐蚀行为的影响。结果显示,厌氧条件下,SRB能在溶液中附着于铜表面形成生物膜,且Cu2S是铜在SRB介质中的主要腐蚀产物。在铜表面形成的Cu2S和EPS膜可以降低铜对SRB的毒性,并促进SRB在铜表面的粘附。电化学测试结果表明,铜在含有SRB溶液中的腐蚀速率呈指数增长。与无菌溶液中的样品相比,SRB通过代谢过程形成了硫化物,加速了铜的腐蚀。
4 铜合金海水腐蚀的防护措施
为防止或减缓铜和铜合金因海水腐蚀和海生物污损产生的严重破坏,提高铜基零部件的服役性能和使用寿命,减少因腐蚀引起的设施失效和经济损失,国内外材料工作者研发了多种铜合金防腐蚀技术。目前,电化学保护、涂料、表面镀层、缓蚀剂等技术已广泛应用于铜合金海水腐蚀的防护,产生了明显的经济效益。
4.1 电化学保护
电化学保护分为外加电流法和牺牲阳极的阴极保护法,是目前防止金属腐蚀的有效方法,广泛用于船体外壳和水舱,以及各种海洋设施的防护。
王成铭等[35]采用外加电流的阴极保护法抑制核电站中凝汽器铜合金管板的腐蚀,结果显示,将阴极保护的电位设置在-0.75~-0.50 V之间,可以有效降低凝汽器中铜合金管板腐蚀速率,延长凝汽器在核电站海水中的使用寿命。
目前,牺牲阳极的阴极保护法使用更广泛,但使用该方法阳极材料会有一定的损耗,需及时更换阳极材料。在众多阳极材料中,铁阳极的资源丰富、价格低,可以考虑将铁阳极广泛应用于海底管道中。
为了提高船用铜合金海水冷却设备的耐腐蚀性及安全性,雷冰等[36]采用极化曲线等方法研究了铁合金和锌合金牺牲阳极对铜合金的保护性。结果表明,在海水中,铁合金作为牺牲阳极时,因与铜合金的开路电位差值较小,在提供有效的阴极保护驱动电位的同时,可使阳极材料的溶解速率大大降低。若采用锌合金作为牺牲阳极,由于锌与铜的电位差较大,则锌会加速损耗,使用寿命变短,且阴极表面会产生钙质膜层,该膜层会导致铜合金产生局部斑点腐蚀,而铁作为阳极时,没有此现象发生。由此可见,铁作为牺牲阳极材料,能在海水中对铜合金起到有效的保护作用。
王伟[37]进一步研究了铁基牺牲阳极对海水环境下铜合金管道的腐蚀保护作用,也认为铁合金比锌合金更适合作为铜合金管道的阴极保护材料。铜合金在海水中的最佳保护电位为-450 mV左右,而铁合金作为阳极材料的开路电位约为(-700±25)mV左右,两者电位差比锌合金更适合。铁合金相比于锌合金的另一优点是,它在海水中溶解的铁离子可以在铜合金表面形成一层含铁的保护膜,从而减少阳极消耗,延长阳极的使用寿命。
余存烨等[38]研究了纯铁、Fe-9Ni和Fe-6Cr-4Ni这3种不同合金作为牺牲阳极时对铜阴极的保护作用,实验结果如表3所示。从表中可见,Fe-9Ni阳极为最佳牺牲阳极,不仅电位稳定、铁锈较少,且作为牺牲阳极时,其本身的腐蚀速率相对纯铁较低,也使铜基体的腐蚀速率降低。
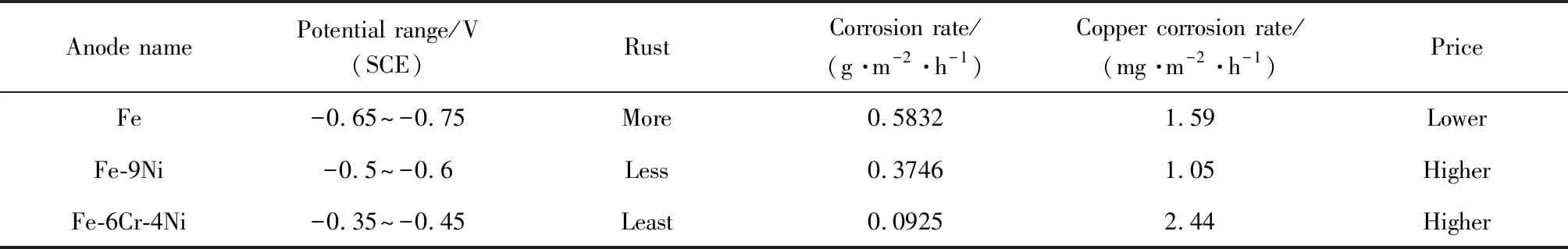
表3 铜使用不同阳极的综合比较[38]
4.2 涂料
海洋环境是十分严酷的腐蚀环境,防护涂料因具有简便、经济和适用性强等特点,广泛应用于舰船和海洋工程中的铜及铜合金零部件的防腐和防污。
Románszki等[39]研究聚苯乙烯薄膜作为铜及铜合金防腐的阻隔层时发现,浸涂聚苯乙烯薄膜的铜合金(铝黄铜和铜镍B30)对海水中微生物的腐蚀和粘附具有有效的阻挡作用。聚苯乙烯薄膜涂层不仅降低了铜合金的腐蚀速率,还明显减少了附着在涂层表面的细菌数量,提高了铜合金的耐蚀性。
Liu等[40]利用丝束电极(wire beam electrode,WBE)和电化学阻抗谱技术,研究了涂覆环氧涂层的铜镍合金在3.5% NaCl溶液中的腐蚀行为。WBE实验结果表明,未涂覆环氧涂层的电极试样作为阳极,加速了金属的溶解;而涂覆环氧涂层的电极试样作为阴极,基材得到了一定程度的保护。电化学阻抗谱结果显示,涂覆环氧涂层的试样在电偶腐蚀过程中存在电化学不均匀性,阴极电流先增大后保持平稳。可以解释为:氧化还原反应产生的OH-使基体发生钝化,形成的钝化膜对基体表面起到保护作用。而未涂覆的基体没有涂层保护,大量侵蚀性的Cl-渗透到金属内部,导致试样基体被腐蚀,则电流先增大后减小。这说明环氧涂层具有良好的阻隔性能,可使铜镍合金在NaCl溶液中得到很好的保护,并减少合金表面的损耗。
Bahari等[41]通过在铜表面涂覆巯基羧酸,并加入纳米二氧化硅颗粒,使羧酸和胺基通过自组装作用并在铜表面形成壳聚糖涂层。电化学阻抗谱结果显示,当2-巯基苯并噻唑(MBT)和纳米二氧化硅引入到聚合物基体中时,二氧化硅粒子在降低壳聚糖涂层溶胀度的同时可提高其热稳定性,形成的交联壳聚糖保护膜使基体表面得到保护,并提高了铜基体的耐蚀性能。
Adhami等[42]在Cu表面涂覆正硅酸乙酯(TEOS)、3-三甲氧基硅基-1-丙硫醇(TPS)和混合TEOS+TPS这3种涂料,利用原子力显微镜(atomic force microscope,AFM)、动电位极化曲线和电化学阻抗谱分析其在3.5% NaCl溶液中的腐蚀行为。结果表明,混合的TEOS+TPS涂层相比于TEOS和TPS单一涂层,表现出更好的耐腐蚀性能。AFM表面形貌研究表明,在3.5% NaCl中浸泡120 h后,TEOS单一涂层发生严重的降解,TPS单一涂层只是覆盖在Cu涂层表面,并没有起到很好的保护作用,但混合的TEOS+TPS涂层在Cu表面形成了均匀、附着力强的保护性纳米结构涂层。动电位极化曲线分析表明,Cu表面涂覆单一TEOS涂层后试样的腐蚀电位向负移动,证明该涂层不能阻碍阳极反应的发生。相比之下,单一TPS涂层使腐蚀电流密度降低,说明TPS涂层的耐腐蚀性比TEOS的好。电化学阻抗谱测试结果显示,与TEOS和TPS单一涂层相比,TEOS+TPS混合涂层电荷转移电阻较大,证明混合涂层具有最好的防腐性能,且混合涂层的阻隔性能好,显示出优异的耐腐蚀性能。
4.3 表面镀层
金属表面镀层不仅能避免金属和腐蚀介质直接接触,还能提高基体表面的耐蚀能力。电沉积、热喷涂、化学气相沉积和激光表面合金化等防护措施均在金属防护技术中获得了广泛应用。
电沉积技术设备便宜,工艺相对简单、易于控制,是一种经济有效的表面改性技术。Sarangi等[43]采用电沉积技术,在纯铜基材表面分别制备了Ni-W-Cu镀层,通过电化学阻抗谱和X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)研究其耐蚀性能。结果表明,在3.5% NaCl溶液中,相比于纯铜基材,Ni-W-Cu镀层合金腐蚀电位向正电位方向移动,腐蚀电流密度减小,说明镀层使铜基体的耐腐蚀能力增加。XPS分析显示,在Ni-W-Cu镀层表面形成了富含Cu2O的膜,阻挡了涂层与溶液的相互作用,提高了材料的耐蚀性。
热喷涂技术的喷涂材料范围广泛、涂层厚度可控且工艺灵活,在金属表面处理中得到广泛应用。马壮等[44]采用火焰喷涂技术在纯铜表面分别制备了渗铝层、陶瓷涂层和陶瓷/渗铝复合涂层。结果显示,在渗铝层表面,铝被优先腐蚀,即涂层中的铝对Cu基体起阳极保护作用;在陶瓷涂层中,陶瓷相和新生的复合陶瓷相可以阻碍基体与腐蚀液间的接触,从而提高涂层耐蚀性能;而陶瓷/渗铝复合涂层除具有阳极保护作用外,铝液相还能有效填充陶瓷涂层孔隙,相比于纯铜渗铝层和陶瓷涂层,复合涂层的耐腐蚀性能有显著提高,如表4所示。
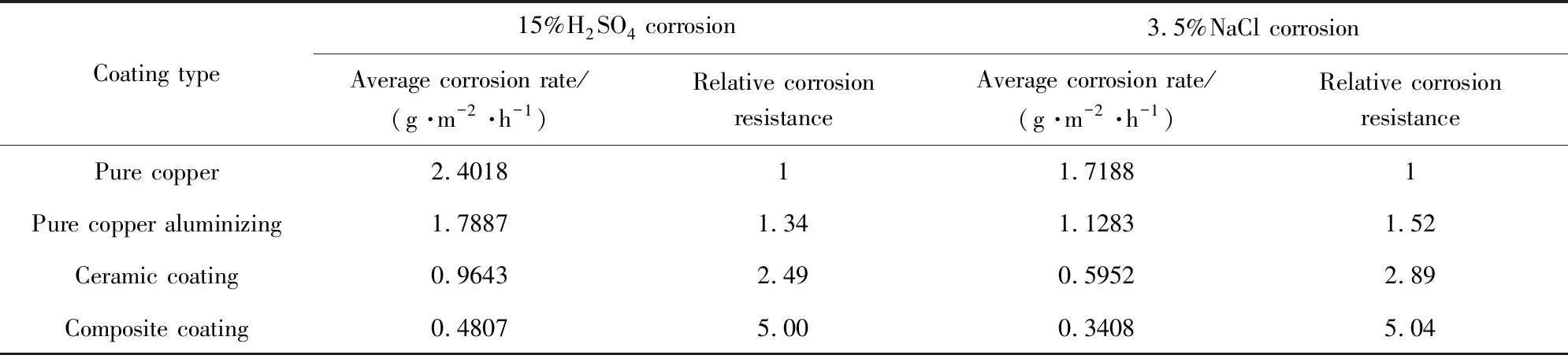
表4 镀覆不同镀层的Cu试样的平均腐蚀速率[44]
化学气相沉积技术不仅可以在较低温度下进行,膜层成分易控,且形成的膜层覆盖性优良,在金属表面镀层中也得到了应用。Al-Saadi等[45]采用化学气相沉积技术在镍铜合金(Monel 400)表面制备了石墨烯涂层,利用扫描电子显微镜、电化学阻抗谱和动电位极化技术研究了Monel 400在含SRB海水环境中的耐蚀性能。扫描电子显微镜观察发现,石墨烯薄膜均匀覆盖在Monel 400合金表面,且薄膜几乎没有缺陷。电化学阻抗谱和动电位极化测试结果均表明,在含SRB海水环境中,与Monel 400合金基体相比,具有石墨烯涂层的Monel 400合金的耐腐蚀性能得到提高,涂层对腐蚀物质也起到有效的阻挡作用。
Man等[46-48]分别利用钛粉末和钨粉末在纯铜表面制备了激光合金化涂层,研究了涂层的组织结构、耐磨性和耐蚀性。结果表明,激光合金化涂层的耐蚀性和耐磨性均高于纯铜。在3.5% NaCl溶液中,含Ti和W的激光合金化涂层的腐蚀速率分别比纯铜降低约15倍和215倍,耐蚀性的提高归因于Ti或W的存在形成了更具保护性的氧化层。另外,由于硬质金属间化合物相和W相的存在,合金化涂层的耐磨性比纯铜提高了3个数量级。贺春林等[49]利用激光熔覆技术在高锰铝青铜表面制备了Cu-Ni熔覆层以提高耐蚀性能,制备出的熔覆层组织致密且细小,孔隙率低,无裂纹。在模拟海水中的电化学实验结果显示,相比于基体,熔覆层的腐蚀电位升高,腐蚀电流密度比基体小;阻抗值明显高于基体,这表明熔覆层的耐海水腐蚀能力更强。
4.4 缓蚀剂
缓蚀剂具有使用范围广、少量高效、操作简单、成本低等优点。因此,在腐蚀环境中,添加适宜的缓蚀剂是减缓材料腐蚀的最有效措施之一[50]。
Younes等[51]用电位极化技术研究了4-苯基缩氨基硫脲(PTSC)、水杨醛缩氨基硫脲(STSC)、5-巯基-1-甲基四唑(MMT)、5-(3-吡啶基)-1H-四唑(PYTA)、5-苯基-1-四唑(PTA)和5-氨基四唑(ATA)这6种缓蚀剂对纯铜的缓蚀性能。结果表明,四唑衍生物类的缓蚀效率(>90%)高于氨基硫脲类衍生物(<80%)。四唑衍生物类缓蚀剂在铜表面的化学吸附性较好,形成了Cu(I)四唑络合物保护膜,具有较高的缓蚀效率,改善了铜合金的耐蚀性。而氨基硫脲类缓蚀剂衍生物中含有硫化物,与铜反应后在溶液中难以溶解,且不易与铜形成具有缓蚀性的复合物,因而缓蚀效率较差。
Huang等[52]研究了苯并咪唑(BI)、2-巯基苯并咪唑(MBI)和苯并三氮唑(BTA)在3.5% NaCl溶液中对铜偶联银电偶腐蚀的缓蚀性能,阐述了缓蚀剂分子结构与缓蚀性能之间的关系。结果表明,苯并咪唑分子中N原子和巯基的引入增强了缓蚀剂在铜表面的物理吸附和化学吸附,提高了缓蚀效率,从而对铜偶联银电偶起到保护作用。在MBI作用下,S原子和Ag+更容易形成稳定的化学键,导致MBI比BI具有更高的缓蚀效率。而BTA的N原子易质子化,且电子云密度集中,因此BTA比MBI的缓蚀效率更高。
缓蚀剂种类较多,目前常用的缓蚀剂如铬酸盐、亚硝酸盐和芳香族杂环化合物都对环境有害。因此,国内外极为重视开发无毒或低毒、水溶性好的绿色缓蚀剂来替代传统缓蚀剂。El-Hafez等[53]报道,半胱氨酸、n-乙酰半胱氨酸和蛋氨酸可作为Cu-10Al-5Ni合金在3.5% NaCl溶液中的高效、环保型缓蚀剂。氨基酸的存在,尤其是半胱氨酸的存在,使合金的稳态电位负移,降低了合金腐蚀的阴极电流密度。这种缓蚀作用是由于氨基酸分子通过硫原子和/或氮原子吸附在合金表面的活性腐蚀中心,形成了合金腐蚀的阻断屏障。Ma等[54]以低价、无毒和水溶性好的葡萄糖为原料,经胺化和亲核加成反应合成了一种新的环保型缓蚀剂,二硫代氨基甲酸酯改性葡萄糖(DTCG)。在3% NaCl溶液中,DTCG能牢固吸附在铜表面,同时抑制铜电极的阳极氧化和阴极还原过程,最大缓蚀效率可达96%以上。
Elsaoud等[55]通过化学和电化学方法,研究过期的Megavit锌药(MZ)在2 mol/L硝酸中对铜合金(C10100)的缓蚀作用。结果显示,MZ分子可以吸附在铜合金表面,且随着MZ浓度(1×10-4~4×10-4)增加,对铜合金的保护效率也增加。极化曲线显示,加入该药物,阴极和阳极的反应变慢,且腐蚀电流密度明显降低,表明该药物的加入延缓了铜合金的腐蚀。交流阻抗谱研究表明,该药物通过吸附在金属/电解质界面上提高了铜合金的极化电阻。该研究表明,含锌过期药物可用作铜合金的缓蚀剂,同时还可以避免普通方法处理过期药物时引起的环境污染问题。
5 结 语
铜及铜合金具有优异的导热、导电、耐蚀和防海生物污损性能,良好的力学和加工性能,广泛应用于船舶、海洋工程等领域。随着海洋工程和科技的高速发展,铜及其合金的腐蚀及防护技术研究一直备受国内外材料研发人员的关注。采用实海暴露、实验室模拟实验等方法对铜合金的海水腐蚀性能开展了广泛研究,发现铜材类型、海域、海水流速、pH值以及海生物等多种因素均可对铜合金的海水腐蚀行为和腐蚀机制产生影响。为防止铜及铜合金材料的海水腐蚀,电化学保护、涂料、表面镀层、缓蚀剂等防腐技术已在实际中得到应用,有效改善了铜合金零部件的使用性能和使用寿命。作者认为,未来应加强如下几个方向的研究:
(1)通过实验室模拟试验,开展海洋环境因素如盐度、温度、溶解氧、流速、含沙量、海生物等对铜合金的腐蚀动力学的影响规律研究,理清铜合金的海洋腐蚀机制;
(2)采用原位监测和离线分析技术,研究铜合金与实海腐蚀产物层和污损生物膜的动态、复合界面结构,阐明合金成分-防腐-防污间的相关性;
(3)针对海洋服役环境,研发铜合金新型防护涂层技术,尤其是研发激光表面改性涂层、可见光响应的耐蚀防污涂层和仿生防护涂层等高性能、环境友好型涂层技术。