生长激素干预对非酒精性脂肪肝患儿心血管功能及代谢相关指标的影响研究
王舒悦 葛霞英 祁正红
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是临床常见的肝脏损伤疾病,其病理改变与酒精性脂肪肝相似,但病因并非饮酒,主要与遗传易感性、胰岛素抵抗、肥胖等因素有关[1]。研究发现我国儿童群体中NAFLD 患病率约为3.4%,在儿童NAFLD中,约50%~80%为肥胖患儿[2]。若未能及时对NAFLD患儿进行干预,随着病情进展,可引起肝硬化、肝癌等并发症,增加死亡风险[3]。此外,该病还可引起心血管病变,NAFLD 与肥胖、氧化应激、胰岛素抵抗、代谢综合征等存在关联,而代谢综合征以及氧化应激是导致心血管病变的重要因素[4-5]。尽早治疗是改善NAFLD预后的关键,目前,临床对该病尚无特效药物,主要进行对症处理,饮食运动疗法是首选干预方法,虽有一定作用,但疗效非常有限。近年来,研究发现生长激素(growth hormone,GH)缺乏与NAFLD 发病有关,GH 减少可下调血浆游离脂肪酸水平,并引起肝脏脂肪变性,促进NAFLD 发生[6]。而现阶段关于GH 治疗NAFLD 的报道较少见,需要对其治疗价值进一步论证。本研究主要探讨GH 干预对NAFLD 患儿心血管功能及代谢相关指标的影响,为今后临床应用提供依据。
1 对象和方法
1.1 对象 纳入2021 年10 月至2022 年10 月杭州市儿童医院儿科收治的NAFLD 患儿96 例。纳入标准:(1)符合《儿童非酒精性脂肪肝病诊断与治疗专家共识》[7]中关于儿童NAFLD 的诊断标准,经影像学检查或肝组织活检证实;(2)年龄6~14 岁;(3)精神状态、智力发育正常。排除标准:(1)已发展成肝纤维化、肝硬化、肝癌患儿;(2)入组前3 个月内有糖脂代谢调控用药史;(3)患自身免疫性疾病;(4)因其他原因(如胆道感染或近期使用过对肝酶水平有影响的药物)导致血清肝酶增高;(5)患病毒性肝炎、药物性肝病、肝豆状核变性等病因明确的肝病。根据随机数字表法将患者分为GH 组与常规组各48 例。两组患儿性别、年龄、BMI、腰围等一般资料比较差异均无统计学意义(均P>0.05),见表1。本研究经本院医学伦理委员会审查通过[批准文号:(2021)年伦审(临研)第(55)号],所有患儿家属均签署知情同意书。
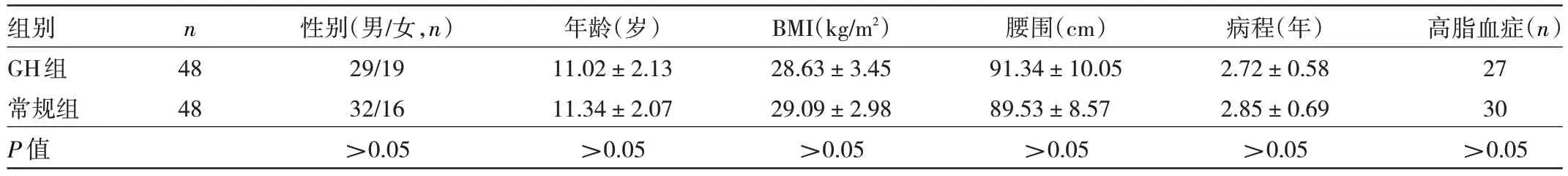
表1 两组患儿一般资料比较
1.2 方法
1.2.1 常规组 采用饮食运动疗法,由营养师根据患儿病情制定饮食与运动计划。(1)饮食方面:采取低能量富营养干预策略,每日脂类摄入5%~15%,蛋白质25%~35%,碳水化合物50%~60%,食物包括肉、水果、蔬菜、谷物,确保营养摄入均衡。(2)运动方面:包括慢跑、爬楼梯、快走、游泳等,饭后30 min 开始运动,每次运动时间30~60 min,根据耐受情况调整,以运动后稍微出汗为宜。疗程为6 个月。
1.2.2 GH 组 在常规组的基础上使用重组人生长激素(recombinant human growth hormone,rhGH)(长春金赛药业股份有限公司,国药准字:S10980101,规格:4.5 万U/1.7 mg/1.0 mL/瓶),日剂量0.1 U/kg(0.033 mg/kg),皮下注射,1 次/d,疗程为6 个月。
1.3 观察指标 分别记录患儿治疗前及治疗3、6 个月的各项指标,均在8:00~10:00 检测。(1)心血管功能指标:利用西门子ACUSON X600 超声诊断系统进行检查,探头频率范围4~11 MHz,首先沿颈总动脉长轴进行纵向探查,测定双侧颈动脉分叉前1~1.5 cm 部位的后壁、前壁厚度,测3 次计算均值,以双侧后壁、前壁厚度的均值为最终颈动脉内中膜厚度(carotid intima media thickness,cIMT)结果。然后采用超声诊断仪检测患儿内皮依赖性血流介导的血管舒张功能(flow mediated vasodilation,FMD),选取仰卧位,利用超声探头纵向探查右侧肘关节上2~10 cm 处肱动脉舒张末期基础内径(记作D1),利用血压计袖带束缚于患儿肘关节下,加压到250 mmHg(1 mmHg=0.133 kPa),维持3 min 左右,放气减压,测定1 min内反应性充血后内径(记作D2)。FMD=(D2-D1)/D1×100%。(2)血液学指标检测:采集患儿空腹肘静脉血4 mL,离心半径8 cm、3 500 r/min 条件下离心,分离血清,存至-80 ℃冰箱中。利用盛世东唐江苏生物科技有限公司DT-280 型全自动生化分析仪测定TG、TC、LDL-C、HDL-C、AST、ALT、γ-谷氨酰转移酶(gamma glutamyltransferase,GGT)水平。使用胰岛素放射免疫试剂(上海信帆生物科技有限公司)检测空腹胰岛素(fasting insulin,FINS),用ELISA 试剂(武汉天正源生物科技有限公司)测定血清胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)水平。另取患儿空腹指尖血2 mL,经德国BST 3000 型酶电极法血糖仪测定FBG。胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)=FBG(mmol/L)×FINS(mU/L)/22.5。(3)记录患儿治疗期间不良反应发生率,本次主要为关节疼痛、肌肉酸痛。
1.4 统计学处理 采用SPSS 25.0 统计软件。计量资料以表示,组间比较采用两独立样本t检验,不同时点的比较采用重复测量数据的方差分析,两两比较采用Bonferroni 法。计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿cIMT、FMD比较 两组患儿治疗前cIMT、FMD比较差异均无统计学意义(均P>0.05)。两组患儿治疗3、6 个月的cIMT 均低于治疗前,且GH 组均低于常规组,差异均有统计学意义(均P<0.05)。两组患儿治疗6个月的FMD均高于治疗前及治疗3个月,且GH组高于常规组,差异均有统计学意义(均P<0.05),见表2。

表2 两组患儿cIMT、FMD 比较
2.2 两组患儿脂代谢指标比较 两组患儿治疗前TG、TC、LDL-C、HDL-C 比较差异均无统计学意义(均P>0.05)。两组患儿治疗6 个月的TG、TC 均低于治疗前(均P<0.05),但组间比较差异均无统计学意义(均P>0.05)。GH 组治疗3、6 个月的LDL-C 均低于治疗前,HDL-C 均高于治疗前,常规组治疗6 个月的LDLC 低于治疗前及治疗3 个月,HDL-C 高于治疗前及治疗3 个月,差异均有统计学意义(均P<0.05)。GH 组治疗3、6 个月的LDL-C 均低于常规组,HDL-C 均高于常规组,差异均有统计学意义(均P<0.05),见表3。
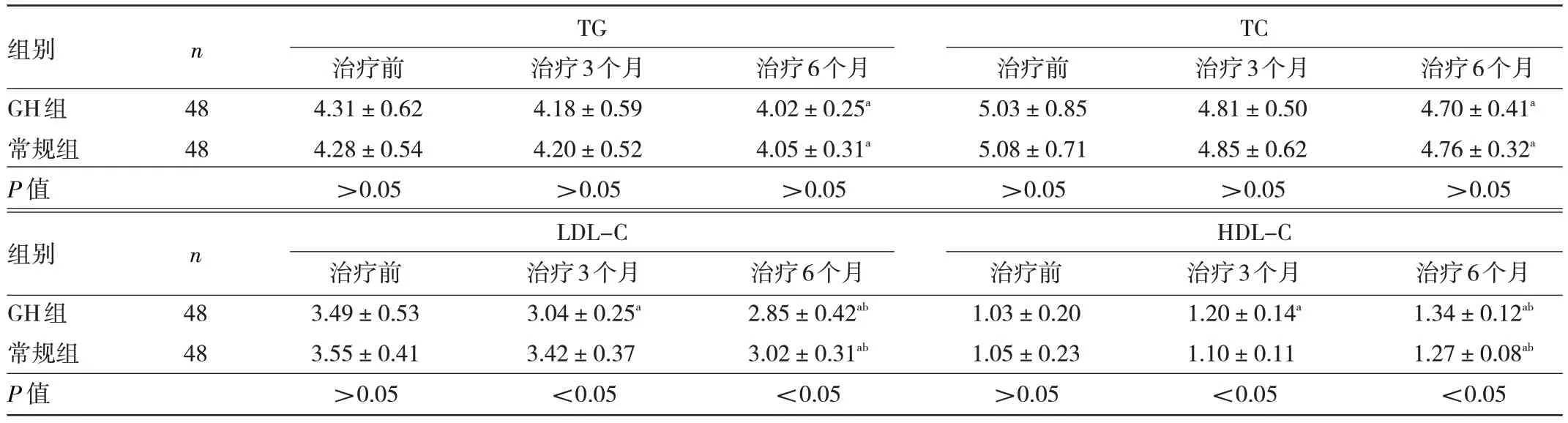
表3 两组患儿脂代谢指标比较(mmol/L)
2.3 两组患儿肝功能指标比较 两组患儿治疗前AST、ALT、GGT 比较差异均无统计学意义(均P>0.05)。两组患儿治疗6 个月的AST、ALT、GGT 均低于治疗前,且GH 组GGT 低于常规组,差异均有统计学意义(均P<0.05)。两组患儿治疗后AST、ALT 比较差异均无统计学意义(均P>0.05),见表4。
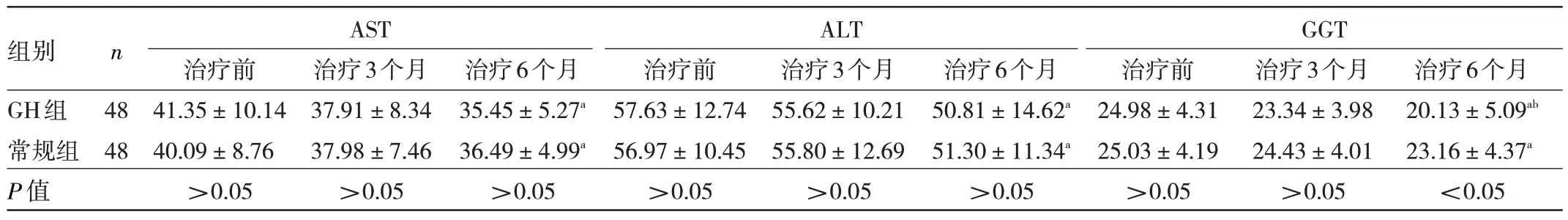
表4 两组患儿肝功能指标比较(IU/L)
2.4 两组患儿血清IGF-1 水平比较 两组患儿治疗前血清IGF-1 水平比较差异无统计学意义(P>0.05)。两组患儿治疗6 个月的IGF-1 水平高于治疗前,且GH 组高于常规组,差异均有统计学意义(均P<0.05),见表5。
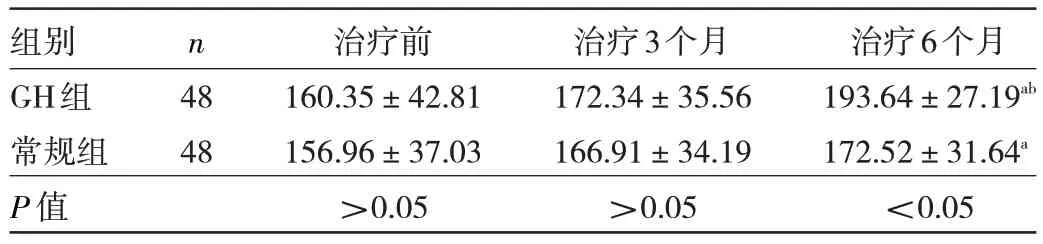
表5 两组患儿血清IGF-1 水平比较(ng/mL)
2.5 两组患儿FINS、FBG、HOMA-IR 比较 两组患儿治疗前FINS、FBG、HOMA-IR 比较差异均无统计学意义(均P>0.05)。两组患儿治疗6 个月的FINS、FBG、HOMA-IR 均低于治疗前,且GH 组FINS、HOMA-IR 均低于常规组,差异均有统计学意义(均P<0.05),但两组FBG 比较差异无统计学意义(P>0.05),见表6。

表6 两组患儿FINS、FBG、HOMA-IR 比较
2.6 两组患儿不良反应发生率比较 常规组无一例发生不良反应。GH 组有7 例(14.58%)出现不良反应,其中关节疼痛3 例(6.25%),肌肉酸痛4 例(8.33%),症状均可耐受,未影响治疗进程。GH 组不良反应发生率高于常规组,差异有统计学意义(χ2=5.547,P<0.05)。
3 讨论
NAFLD 在儿童、成年人中均可发病。近年来,随着儿童肥胖率增高,NAFLD 在儿童中的患病率相应增高,发展成终末期肝病的风险与成人接近,30%~40%的NAFLD 患儿因发展成肝硬化,在患病后10 年内死亡[8-9]。尽早治疗是控制NAFLD 患儿死亡风险的关键,但现阶段尚缺乏特效药物进行干预,关于NAFLD 的治疗方案有待进一步探讨。研究表明肝脏特异性GH 受体缺失会引起血脂紊乱、胰岛素抵抗、新生脂肪生成量增加、肝脏脂肪变性等病变,提示GH 与脂肪肝发生有关,GH 能介导脂肪组织脂解,通过Janus 蛋白酪氨酸激酶2 信号通路,促进肝脏脂肪变性[10]。GH 干预可能成为治疗NAFLD 的重要方法,但现阶段缺乏足够研究支撑该推测。
NAFLD 是心血管疾病的潜在危险因素之一,其引起心血管疾病的机制较复杂,这类患者机体伴有过量活性氧(reactive oxygen species,ROS),ROS 生成能促进脂质过氧化,通过活化肝星状细胞诱发肝脏炎症与纤维化,致肝脏脂肪大量累积,此外,ROS 大量生成可引起LDL 氧化,致巨噬细胞转化成泡沫细胞,促进动脉粥样硬化,增加心血管疾病发生风险[11-12]。cIMT、FMD均为反映心血管功能的指标,其中cIMT 能反映早期动脉粥样硬化形成风险,对心血管疾病有一定预测价值;FMD 可反映血管内皮舒张功能状态,一旦出现舒张功能障碍,则会促进动脉粥样硬化发生[13-14]。本研究结果提示,与常规的饮食运动疗法相比,在此基础上加用GH,能更有效降低cIMT,提高FMD,对改善心血管功能有益。部分NAFLD 患儿因GH 缺乏症,体内纤维蛋白酶原以及纤溶酶原激活抑制物水平较高,更易发生心肌梗死,通过补充GH 则可下调相关多肽水平,抑制内膜增厚,预防斑块形成,从而调控cIMT、FMD,改善心血管功能。本研究显示,与常规组比较,GH 组治疗6 个月后LDL-C、HDL-C、FINS、HOMA-IR显著改善,表明GH 对糖脂代谢有调控作用。喻琴等[15]对特发性矮小症患儿进行研究,发现rhGH 能调节糖脂代谢,亦证实该药的作用价值。究其原因,GH 存在类胰岛素作用,短期使用能够下调血糖,抑制脂肪降解,长期应用能促进糖脂代谢改善,减少脂肪量,并改善胰岛素敏感性。
IGF-1 是抵抗NAFLD 的一种保护性因子,对NAFLD 有预防作用[16]。本研究发现,GH 干预能进一步上调NAFLD患儿的血清IGF-1水平。康永平等[17]发现,rhGH能促进矮小症患儿的IGF-1分泌,上调血清IGF-1水平。分析原因,rhGH 可能与肝脏上的GH 受体相结合,合成IGF-1,从而上调IGF-1 水平。本次结果提示,GH能更有效改善NAFLD患儿的GGT水平,提示其具有改善肝功能的作用。GH 干预改善NAFLD 患儿肝功能的机制可能如下:(1)它通过上调血清IGF-1 水平改善NAFLD,保护肝脏功能;(2)它通过调控糖脂代谢,改善肝脏脂肪变性;(3)它通过碳水化合物反应元件结合蛋白以及脂肪酸合酶,对新生脂肪生成进行抑制[18],改善肝脏脂肪变性。既往有研究探讨了GH 缺乏症与NAFLD的关系,但并未针对这类患者采用GH干预,本研究则对NAFLD患儿采用GH干预,发现其能改善NAFLD患儿病情,具有临床推广价值。此外,Xue等[19]发现,rhGH 治疗6个月能改善肥胖与NAFLD患儿的肝酶,且对改善心血管相关代谢并发症有益,亦表明GH对NAFLD患儿的代谢功能有调节作用,与本次结论吻合。但本研究增设了治疗3 个月作为观察时点,能进一步明确治疗期间各指标的动态变化,且观察指标中增设了cIMT、FMD,便于更深入明确GH治疗对NAFLD患儿心血管功能的影响,为临床干预提供依据。本研究还提示,GH 的应用可能引起肌肉酸痛、关节疼痛症状,这属于正常现象,通常在停止用药后,症状消失,但临床仍需密切观察不良反应,必要情况下采取干预措施。
综上所述,GH 干预可通过改善儿童NAFLD 的心血管功能、糖脂代谢、肝功能,进一步改善患儿病情。但本研究也有不足,如采用单中心研究,之后考虑采用多中心研究,更深入探讨GH 干预的作用价值。

