MSR1对矽肺小鼠脂质蓄积和炎性因子分泌的影响研究
刘 艺,李金城,周昱慧,何海兰,郭灵丽, 2,郝小惠, 2,王宏丽, 2,刘和亮,2
矽肺是由于接尘工人长期吸入大量游离二氧化硅粉尘引起的,以矽结节的形成和弥漫性纤维化为主要病变的世界范围内严重的职业病[1],该疾病致死率高且尚无有效的治愈手段。因此,开展矽肺的分子机制研究,对完善矽肺治疗和提供干预措施有着重要的理论和现实意义[2]。课题组前期研究[3]表明,矽肺患者巨噬细胞内发生脂滴沉积形成泡沫细胞。该研究表明巨噬细胞摄取脂质会增加转化生长因子的分泌,从而促进肺纤维化进程。因此,阻止巨噬细胞脂质摄取可能会减轻矽肺纤维化反应,但其具体的调控机制还有待进一步探索。A类清道夫受体1(macrophage scavenger receptor 1,MSR1)在矽肺患者的巨噬细胞中,MSR1的表达水平随着矽肺期别的增高而有增加趋势,巨噬细胞对SiO2纳米颗粒的摄取和炎症因子的分泌因沉默MSR1而受到强烈抑制[4],但MSR1在矽肺脂质代谢和炎症反应中是否发挥了关键调控作用还不清楚。因此,该研究拟在小鼠矽肺模型中探究MSR1发挥的具体作用,并在巨噬细胞系小鼠单核巨噬细胞(mouse mononuclear macrophages cells,RAW264.7)中加以验证,以期为寻找矽肺干预和治疗的靶点提供理论依据。
1 材料与方法
1.1 主要材料SPF级C57BL/6雄性小鼠(北京华阜康生物科技股份有限公司);RAW264.7细胞(美国ScienCell生物技术公司);DMEM高糖培养基、胎牛血清(FBS)(美国Gibco公司);二氧化硅(silicon dioxide,SiO2)(粒径0.5~10.0 μm)(美国Sigma公司);兔多克隆抗体巨噬细胞MSR1(美国ABclonal公司);兔多克隆抗体肿瘤坏死因子(tumor necrosis factor,TNF)-α(上海Arigo公司);兔多克隆抗体白介素(interleukin,IL)-1β(美国ABclonal公司);兔多克隆抗体IL-6(杭州华安公司);HRP标记羊抗小鼠IgG二抗、HRP标记羊抗兔IgG二抗、β-肌动蛋白(β-actin)抗体(英国Abcam公司);ECL显色液(北京普利莱公司);PV6000通用型两步法免疫组化试剂(北京中杉公司);油红O染料(美国Sigma公司);化学发光成像系统(XRS+,美国Bio-Rad公司)。
1.2 实验动物及分组SPF级C57BL/6雄性小鼠24只,6~8周龄,20~25 g/只(北京华阜康生物科技股份有限公司)均在华北理工大学SPF级实验动物中心饲养,温度23 ℃,相对湿度45%~50%,昼夜交替12 h,自主饮水及进食,适应性喂养1周后进行试验。该研究经华北理工大学实验动物伦理委员会审查批准(SQ2022128)。随机分组为生理盐水对照组和SiO2染毒组小鼠,每组各6只,采用一次性气管滴注法在小鼠气管内灌注50 μl粒径为0.5~10.0 μm(100 mg/ml)SiO2悬浊液制备矽肺小鼠模型,生理盐水对照组给予同样体积的生理盐水,在灌注后7、14、28 d取小鼠肺组织。
1.3 细胞培养和处理小鼠巨噬细胞RAW264.7在37 ℃含5%CO2的培养箱中用DMEM高糖培养基培养,细胞培养贴壁后,实验分组为:① 对照组:10%FBS-DMEM高糖培养基培养;② SiO2组:2%FBS-DMEM高糖+50 μg/ml的SiO2混悬液培养;③ siRNA-MSR1组:取对数生长期的RAW264.7细胞接种于6孔板,转染MSR1的小干扰RNA,用转染培养基进行培养;④ siRNA-MSR1+SiO2刺激组:转染24 h后加入SiO2混悬液培养。
1.4 免疫组织化学染色石蜡切片常规脱蜡至水,用枸橼酸钠缓冲液进行抗原修复,3%H2O2内源性过氧化物酶阻断剂常温孵育15 min,血清封闭后滴加兔抗MSR1(1 ∶100),4 ℃暗盒过夜后滴加二抗37 ℃孵育30 min,DAB显色,苏木精染色30 s,脱水透明,中性树胶封片,显微镜下观察MSR1的表达。
1.5 免疫印迹法提取肺组织和细胞蛋白,BCA试剂盒测定蛋白浓度,取15 μg蛋白进行电泳和转膜,一抗4 ℃过夜,二抗摇床孵育2 h。使用ECL发光试剂应用凝胶成像系统检测信号,计算目的蛋白的相对表达量。
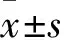
2 结果
2.1 矽肺小鼠模型的成功建立HE染色结果显示,对照组小鼠肺组织结构正常,肺泡结构完整;染毒7 d组小鼠肺组织结构轻微破坏;染毒14 d组小鼠肺泡结构有破坏,出现炎细胞聚集;染毒28 d组小鼠肺组织内有大量炎细胞浸润,肺泡壁增厚,形成以巨噬细胞和成纤维细胞为主的细胞结节。VG染色结果显示,对照组小鼠肺泡结构完整,间质未见胶原沉积;随着染毒时间的延长,胶原分布明显增多,形成细胞性结节,肺组织发生纤维化病变,与HE结果保持一致,矽肺小鼠模型建立成功。见图1。
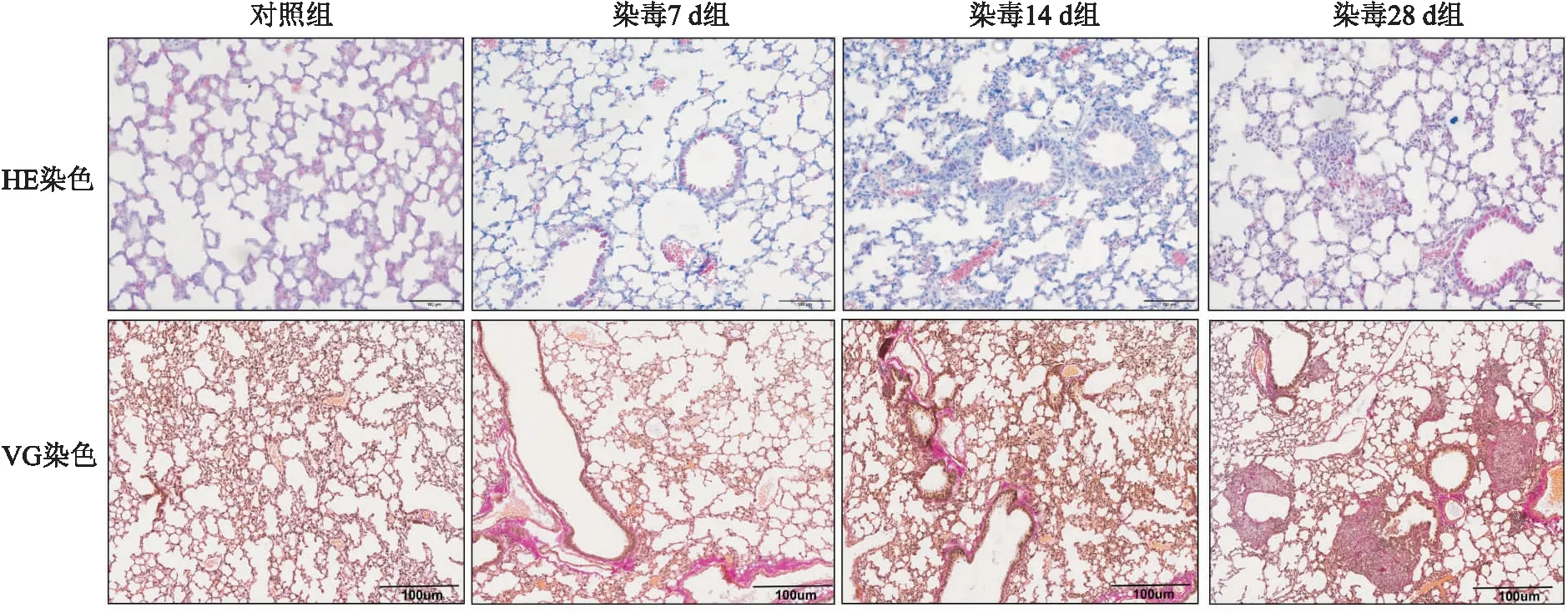
图1 小鼠肺组织病理学染色 ×200
2.2 小鼠模型肺组织脂质蓄积油红O染色结果如图2所示,染毒组小鼠肺组织出现橙红色脂滴,随着染毒时间的延长,肺组织脂滴蓄积情况逐渐加重。与对照组比较,染毒28 d组小鼠肺组织橙红色脂滴颗粒蓄积更明显。
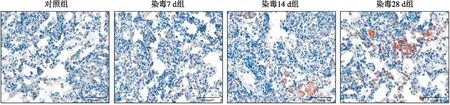
图2 小鼠肺组织油红O染色结果 ×400
2.3 小鼠模型肺组织炎症反应Western blot结果如图3所示,与对照组比较,染毒7 d组和染毒14 d组的TNF-α的表达升高(P<0.05),而染毒28 d组显著升高(P<0.01);IL-6的表达变化与TNF-α相似,随着染毒时间的延长,IL-6的表达持续升高;IL-1β在染毒组小鼠肺组织中表达上调,与对照组比较,染毒28 d组IL-1β的表达差异有统计学意义(P<0.01)。
图3 Western blot检测小鼠肺组织炎性因子的表达
2.4 MSR1在模型肺组织的表达变化Western blot结果如图4所示,与对照组比较,染毒14 d组的MSR1表达升高(P<0.05),染毒28 d组的MSR1的表达显著升高(P<0.01)。此外,对矽肺小鼠模型肺组织进行免疫组织化学染色,结果如图5所示,MSR1棕黄色染色颗粒主要表达于细胞质,以巨噬细胞着色为主,肺间质居多。与对照组比较,MSR1在染毒组小鼠肺组织中表达上调。
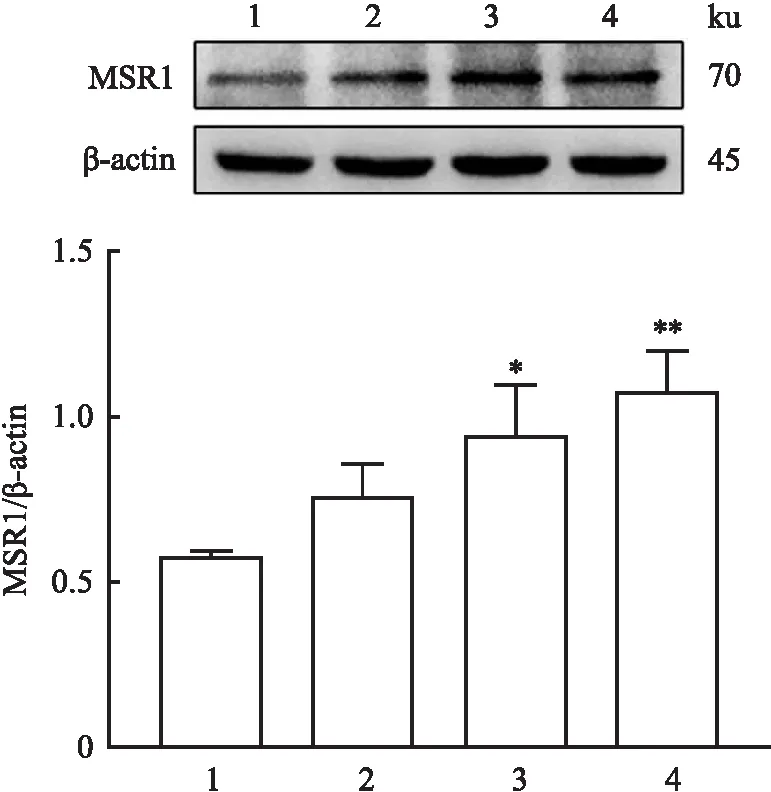
图4 Western blot检测MSR1在小鼠肺组织的表达情况
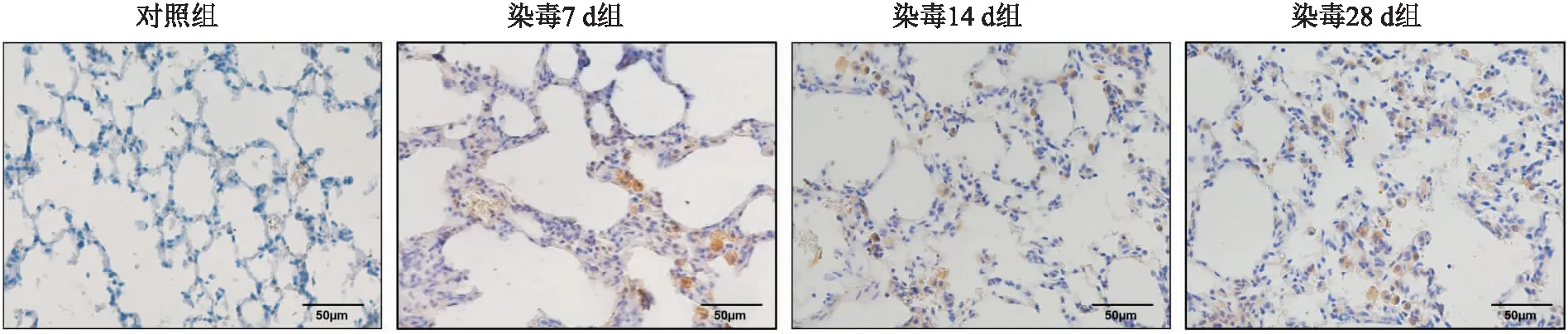
图5 免疫组织化学染色结果 ×400
2.5 敲低MSR1抑制巨噬细胞对SiO2的刺激反应Western blot结果如图6A所示,与对照组比较,SiO2组巨噬细胞RAW264.7中MSR1的表达升高(P<0.05), siRNA-MSR1组中MSR1的表达下降(P<0.05);与siRNA-MSR1组比较,siRNA-MSR1+SiO2刺激组巨噬细胞的MSR1的表达升高(P<0.05)。油红O染色结果如图6B所示,SiO2组巨噬细胞RAW264.7细胞形态变圆,细胞核增大呈蓝色,位于胞质一侧,胞质内出现橙红色脂滴。与SiO2组比较,siRNA-MSR1+SiO2刺激组细胞胞质中橙红色脂滴减少,差异有统计学意义(P<0.01)。同时,siRNA-MSR1组细胞内红色脂滴与对照组比较差异无统计学意义(P>0.05)。见图6。ELISA结果如表1所示,与对照组比较,SiO2组细胞上清液中TNF-α、IL-6、IL-1β的含量升高(P<0.05), siRNA-MSR1组TNF-α、IL-6、IL-1β的含量降低(P<0.05)。其中siRNA-MSR1+SiO2刺激组的炎性因子的含量低于SiO2组,TNF-α、IL-6和IL-1β的表达差异有统计学意义(P<0.05)。
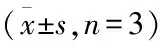
表1 细胞培养基上清液中炎症因子的含量
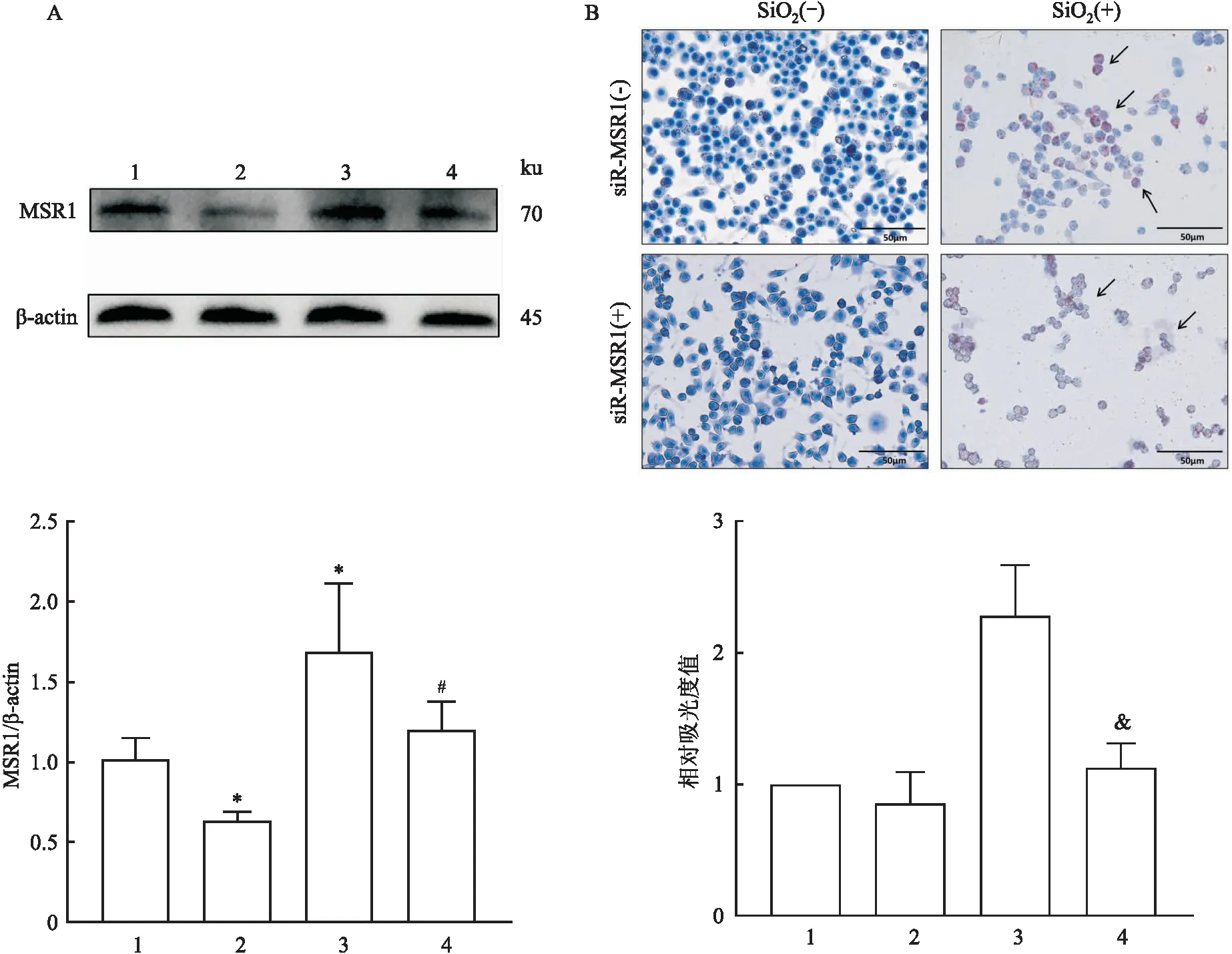
图6 小鼠单核巨噬细胞对SiO2的刺激反应
3 讨论
矽肺是全球最严重的职业性肺纤维化疾病之一,是由于长期接触SiO2粉尘引起的,有明显的肺部炎症和纤维化的慢性间质性肺疾病,该疾病具有进行性、不可逆性等特点[5]。目前尽管工人在作业时采取了预防措施,但矽肺的发病率仍然居高不下,在发展中国家尤其严重。在矽肺发病进程中肺内巨噬细胞对SiO2颗粒的摄取可能导致其崩解坏死,释放的SiO2颗粒被更多的巨噬细胞吞噬,周而复始导致持续的炎症和纤维化[2]。在结晶SiO2引起的纤维性肺泡炎模型中,肺泡内巨噬细胞和中性粒细胞蓄积引起持续的毒性和炎症反应[6],巨噬细胞和促炎细胞因子如TNF-α以及这些细胞产生的IL-1β在暴露于SiO2后的早期炎症反应中发挥着重要的作用[7]。此外,已有研究[3]表明脂质代谢在矽肺的发病机制中具有重要作用,脂质代谢失衡导致大量泡沫细胞形成可能是矽肺病程发展的一个重要因素。代谢组学分析结果显示无论是矽肺早期炎症期还是进展期,发生改变的主要代谢产物是脂质和类脂化合物[8]。在特发性肺纤维化相关研究中表明介导特发性肺纤维化重塑的特定代谢途径包括鞘脂代谢途径[9],鞘脂代谢途径中相关酶的变化可能参与调控矽肺的发病进程。因此,脂质代谢在矽肺纤维化发展过程中可能起重要作用。为阐明脂质代谢和炎症反应在矽肺发病过程中发挥的作用,课题组前期通过在矽肺和纤维化相关数据库筛选高表达的细胞因子,结果显示MSR1在矽肺中高表达的同时也可介导脂质代谢。MSR1是一种以同源三聚体形式存在的Ⅰ型跨膜糖蛋白,属于受体超家族,参与调节和维持正常脂质代谢。已有研究[10]表明巨噬细胞表面的MSR1可以不受胆固醇的负反馈对ox-LDL进行摄取从而形成富含脂质的泡沫细胞。在小鼠体内高表达MSR1基因有助于清除体内载脂蛋白,降低胆固醇[11]。但目前MSR1在矽肺发病过程中对脂质代谢及分泌炎性因子的调控作用机制尚不明确。
炎症和纤维化是矽肺的典型病理特征[12]。在SiO2诱导的小鼠矽肺模型中矽肺小鼠肺组织中纤维化和炎症增强,这与之前报道[13]一致,提示造模成功。此外,研究表明,SiO2进入肺内后,肺内巨噬细胞首先做出应答,免疫组织化学染色和Western blot结果显示矽肺小鼠肺组织MSR1表达升高,且与染毒时间存在相关性。在SiO2刺激的巨噬细胞中也显示了相似的现象,提示MSR1在矽肺的进展中可能发挥着重要的调控作用。油红O染色显示在矽肺小鼠肺组织中脂质蓄积增加,Western blot结果显示矽肺小鼠肺组织中炎性因子表达上调,提示脂质代谢和炎症反应可能在矽肺的病程进展中发挥重要作用。而有研究[14]表明MSR1的表达与肝脏富含脂质的泡沫样巨噬细胞的发生相关,但在矽肺脂质代谢中的调控机制尚不清楚。为探究MSR1对SiO2刺激的巨噬细胞中脂质蓄积和炎症反应的影响,该研究在RAW264.7细胞中沉默MSR1的表达,结果显示SiO2刺激RAW264.7细胞后,MSR1的表达升高,转染MSR1的小干扰RNA后其表达受到抑制。而抑制MSR1减轻了SiO2诱导的脂质蓄积和炎症反应的增强,提示MSR1参与了SiO2对肺组织和细胞内脂质成分的调控以及介导的炎症反应。
综上所述,该研究表明MSR1可能在矽肺小鼠模型脂质异常蓄积和炎症反应中发挥了关键调控作用,MSR1可能是干预矽肺病程进展的潜在治疗靶点。具体分子调控机制及调控通路的研究值得今后进一步探索。

