基于MAMs探究RVD1对衰老大鼠心肌细胞自噬与凋亡的影响
郑 扬,黄玉冰,黄文霞,李海涛
衰老是一种常见且不可避免的自然现象。临床资料[1]显示,衰老过程中心脏病的易感性增加,心脏主要出现左心室肥厚、心肌纤维化增加、心功能不全等变化,并引起一系列心血管疾病[2-3]。线粒体-内质网偶联(mitochondria-associated endoplasmic reticulum membranes, MAMs)是内质网和线粒体外膜之间的物理连接位点,密切参与从内质网到线粒体的应激信号转导。研究[4]表明,在衰老过程中心脏和骨骼肌中MAMs结构发生变化,其完整性遭到破坏,MAMs相关蛋白表达减少。由此推测,MAMs可能是衰老相关心肌损伤的一个关键靶点。
消退素D1(ResolvinD1, RVD1)是一种源自omega-3多不饱和脂肪酸的脂质介质。研究[5]表明,RVD1能够减少血管紧张素Ⅱ引发的中性粒细胞和巨噬细胞浸润,抑制心脏肥大、间质和血管周围纤维化以及高血压的发生。然而,RVD1能否在衰老中对心肌组织起到保护作用目前尚不明确。因此,该研究通过观察RVD1对自然衰老大鼠心肌组织的影响,探讨衰老所致心肌受损的相关机制,以期为衰老相关心肌损伤的治疗提供新思路。
1 材料与方法
1.1 主要材料实验动物选用30只18月龄SD大鼠和10只6月龄SD大鼠,均为雄性,由海南药物研究所有限责任公司提供[生产合格证号:SCXK(琼)2020-0007]。实验期间将大鼠饲养于SPF级饲养室[使用合格证号:SYXK(琼)2022-0013],定期更换垫料,给予充足水源与饲料,温度为22~24 ℃,相对湿度为45%~55%,光照/黑暗各12 h交替模拟正常昼夜。RVD1(美国ChemeGen公司,批号:CY10936,纯度:98%),心肌组织β-半乳糖苷酶活性检测试剂盒(北京索莱宝生物公司),Masson试剂盒与TUNEL细胞凋亡检测试剂盒(北京百奥博莱生物公司),HE染色试剂盒、4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染料、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒、聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜及电化学发光分析(electrochemiluminescence,ECL)显影液(上海碧云天生物研究所),免疫组化S-P法试剂盒(武汉伊莱瑞特生物公司),环氧树脂812(eponate812,Epon812)(美国Ted Pella公司),醋酸双氧铀与枸橼酸铅(北京海德创业生物公司),放射免疫沉淀法(radio immunoprecipitation assay,RIPA)蛋白裂解液(上海贝博生物公司),兔抗大鼠微管相关蛋白3(microtubule associated protein 3,LC3)多克隆抗体、兔抗大鼠Beclin-1多克隆抗体、兔抗人p62多克隆抗体、兔抗人葡萄糖调节蛋白75(glucose-regulated proteins 75,GRP75)多克隆抗体、兔抗人电压依赖性阴离子通道1(volt-dependent anion channel 1,VDAC1)多克隆抗体、兔抗人线粒体融合蛋白2(mitochondrial fusion protein 2,Mfn2)多克隆抗体、兔抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体及辣根过氧化物酶标记的山羊抗兔IgG抗体(英国Abcam公司)。
1.2 方法
1.2.1动物分组、给药与处理 将30只18月龄SD大鼠按数字随机表法分为模型组、低剂量RVD1组、高剂量RVD1组,每组10只,另取10只6月龄SD大鼠作为对照组。参考文献[6]中的给药剂量,低剂量RVD1组和高剂量RVD1组大鼠分别尾静脉注射50、100 ng/ml RVD1,剂量为2 μl,每日1次,对照组和模型组同时注射等量PBS,持续干预21 d。末次给药12 h后,处死各组大鼠并快速取出心脏组织,预冷的生理盐水洗涤后,一部分置于4%多聚甲醛中固定,另一部分置于液氮中冷冻后存于-80 ℃冰箱备用。
1.2.2对-硝基苯酚法测定大鼠心肌组织β-半乳糖苷酶活性 取适量各组大鼠的心肌组织,按照组织质量(g) ∶提取液体积(ml)为1 ∶10的比例加入提取液,置于冰上裂解30 min,离心机4 ℃ 12 000 r/min离心10 min,吸取上清液,使用β-半乳糖苷酶活性检测试剂盒测定各组样本内β-半乳糖苷酶活性,建立标准曲线,按照样本蛋白浓度计算酶活性。
1.2.3HE染色检测大鼠心肌组织病理形态学变化 将置于4%多聚甲醛固定好的各组大鼠心肌组织取出,浸入梯度乙醇中脱水,二甲苯中透明,并包埋在融化的石蜡中。将包埋好的蜡块切成5 μm厚的组织切片,放于60 ℃烤箱烤干30 min,脱蜡水化,进行HE染色。染色结束后,滴加中性树胶封固,室温晾干,光学显微镜下观察心肌组织变化并拍照。
1.2.4Masson染色观察大鼠心肌组织内胶原沉积 取制备好的各组大鼠心肌组织切片,常规脱水透明,按照Masson染色试剂盒说明书步骤,加入Masson染色工作液室温染色,浸洗干净,滴加中性树胶封固,室温晾干,光学显微镜下观察心肌组织胶原纤维沉积情况并拍照,镜下蓝染为胶原纤维沉积区域。Image J 软件分析胶原纤维沉积情况,计算心肌组织胶原容积分数(collagen volume fraction,CVF),CVF=胶原蓝染面积/组织总面积×100%。
1.2.5TUNEL染色检测大鼠心肌细胞凋亡 取制备好的各组大鼠心肌组织切片,常规脱水透明,加入蛋白酶K修复,破膜处理,采用TUNEL试剂盒检测心肌细胞凋亡,加入TUNEL工作液染色,PBS清洗后,加入DAPI染细胞核,滴加抗荧光淬灭封片剂封固,室温晾干,置于荧光显微镜下观察心肌细胞凋亡情况并拍照,镜下绿色荧光标记的细胞为TUNEL阳性,代表细胞凋亡,蓝色荧光标记的为细胞核,随机选择6个视野计数,以TUNEL阳性细胞数目与总细胞数目之比记为TUNEL阳性细胞比例。
1.2.6免疫组化S-P法检测大鼠心肌组织自噬标志物LC3表达 各组大鼠心肌组织切片经脱水透明后,浸入修复液中微波炉加热原修复,3%过氧化氢阻断内源性过氧化物酶,破膜处理后,双蒸水清洗切片,以山羊血清室温封闭30 min,加入稀释后的兔抗大鼠LC3多克隆抗体(1 ∶200),4 ℃孵育过夜。弃一抗液,PBS清洗后甩干切片,加入稀释后的辣根过氧化物酶标记的山羊抗兔IgG抗体(1 ∶200),37 ℃孵育30 min,PBS清洗,使用即用型DAB 显色,苏木精复染,再次脱水透明,滴加中性树胶封固,室温晾干,光学显微镜下观察心肌组织染色情况并拍照,镜下棕色至棕褐色染色为LC3蛋白阳性表达,Image-Pro Plus软件分析蛋白阳性表达区域占总区域比例,记为LC3蛋白阳性率。
1.2.7透射电镜观察大鼠心肌组织内MAMs形成 收集的各组大鼠心肌组织用3%戊二醛固定,1%锇酸再固定,使用梯度酒精和丙酮对样品进行脱水,Epon812包埋,切成超薄切片,固定至铜网,进行醋酸双氧铀与枸橼酸铅染色,室温下干燥过夜,透射电镜下进行成像并拍照,Image-Pro Plus软件测量线粒体-内质网偶联与线粒体周长,分析线粒体-内质网偶联长度占线粒体周长比例。
1.2.8Western blot法测定大鼠心肌组织自噬相关蛋白与MAMs相关蛋白表达 从-80 ℃冰箱中取出各组大鼠心肌组织样品,加入RIPA蛋白裂解液,研磨匀浆后,冰上静置30 min,离心机4 ℃ 12 000 r/min离心15 min,取上清液即为样本总蛋白,BCA法蛋白定量,获得蛋白浓度。将蛋白煮沸变性,制备10%SDS-PAGE凝胶并待其凝固后,取等量30 μg蛋白加样,电泳分离后切下目的条带,电转至PVDF膜。浸入5%脱脂牛奶室温封闭1 h,以减少非特异性结合。加入稀释后的各一抗(1 ∶1 000),4 ℃孵育过夜。弃一抗液,TBST洗膜,加入稀释后的对应二抗(1 ∶5 000),室温孵育1 h。TBST再次洗膜,采用ECL显影,凝胶成像显影仪中成像并保存图像,Image-Pro Plus软件分析目的条带灰度值,以目的蛋白与内参蛋白GAPDH的灰度比值来表示目的蛋白相对表达量。
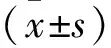
2 结果
2.1 各组大鼠心肌组织β-半乳糖苷酶活性比较各组大鼠心肌组织β-半乳糖苷酶活性之间差异有统计学意义(F=264.127,P<0.001)。与对照组比较,模型组大鼠心肌组织β-半乳糖苷酶活性升高(P<0.05);与模型组比较,低剂量RVD1组与高剂量RVD1组大鼠心肌组织β-半乳糖苷酶活性降低(P<0.05),且高剂量RVD1组大鼠心肌组织β-半乳糖苷酶活性低于低剂量RVD1组(P<0.05)。见图1。
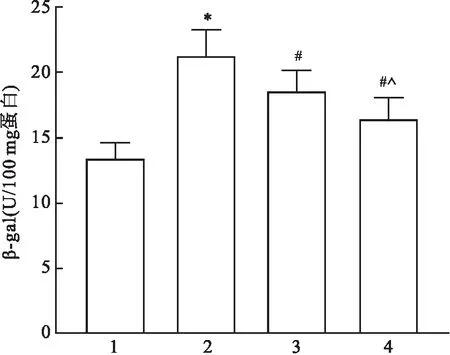
图1 各组大鼠心肌组织β-半乳糖苷酶活性检测结果
2.2 各组大鼠心肌组织病理形态学变化情况比较HE染色结果显示,对照组大鼠心肌组织结构清晰,心肌细胞整齐排列,染色均匀;模型组大鼠心肌组织发生明显损伤,心肌纤维排列紊乱且有断裂,心肌细胞出现坏死、水肿现象;与模型组比较,低剂量RVD1组与高剂量RVD1组大鼠心肌纤维与心肌细胞形态明显得到改善,此外,高剂量RVD1组大鼠心肌组织趋于对照组,未见明显损伤。见图2。
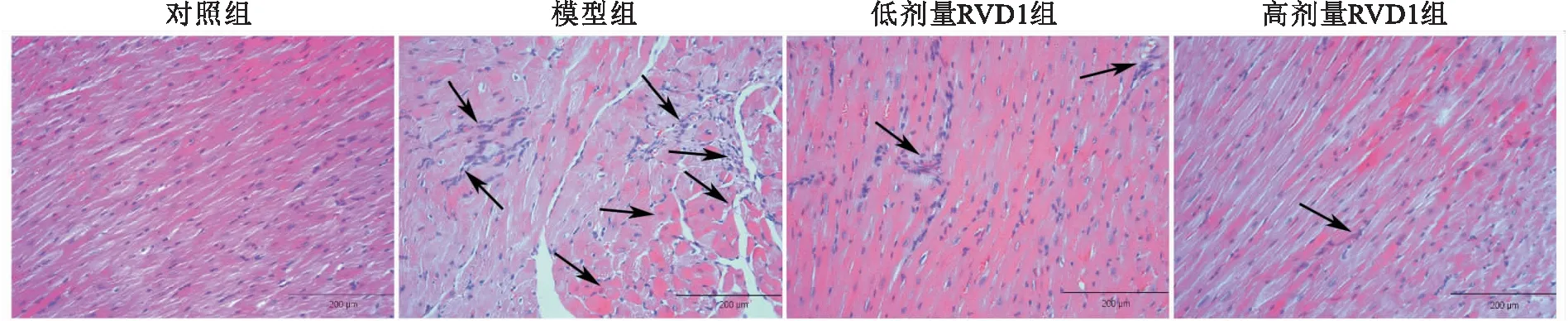
图2 各组大鼠心肌组织病理形态学变化 HE ×100
2.3 各组大鼠心肌组织胶原纤维沉积情况比较Masson染色结果显示,各组大鼠心肌组织CVF之间差异有统计学意义(F=314.259,P<0.001)。对照组大鼠心肌组织内未见明显蓝染的胶原纤维沉积,而模型组大鼠心肌组织内有大量蓝染的胶原纤维沉积,CVF升高(P<0.05);与模型组比较,低剂量RVD1组与高剂量RVD1组大鼠心肌组织内蓝染的胶原纤维沉积均明显减少,CVF降低(P<0.05),且高剂量RVD1组要CVF低于低剂量RVD1组(P<0.05)。见图3。
图3 各组大鼠心肌组织胶原沉积染色结果 Masson×100
2.4 各组大鼠心肌细胞凋亡比较TUNEL染色结果显示,各组大鼠心肌组织TUNEL阳性细胞比例之间差异有统计学意义(F=478.841,P<0.001)。模型组大鼠心肌组织内TUNEL阳性细胞比例(64.28±6.04)%多于对照组(2.16±0.22)%(P<0.05),心肌细胞凋亡明显;与模型组比较,低剂量RVD1组与高剂量RVD1组大鼠心肌组织内TUNEL阳性细胞比例(19.87±1.79)%、(12.30±1.16)%均减少(P<0.05),心肌细胞凋亡受到抑制;与低剂量RVD1组比较,高剂量RVD1组大鼠心肌组织内TUNEL阳性细胞比例进一步减少(P<0.05),心肌细胞凋亡更少。见图4。
2.5 各组大鼠心肌组织内自噬水平比较免疫组化S-P法结果显示,各组大鼠心肌组织内自噬标志物LC3蛋白阳性率之间差异有统计学意义(F=288.645,P<0.001)。与对照组比较,模型组大鼠心肌组织内LC3蛋白阳性率下降(P<0.05);与模型组比较,低剂量RVD1组与高剂量RVD1组大鼠心肌组织内LC3蛋白阳性率增加(P<0.05),且高剂量RVD1组大鼠心肌组织内LC3蛋白阳性率高于低剂量RVD1组(P<0.05)。见图5。
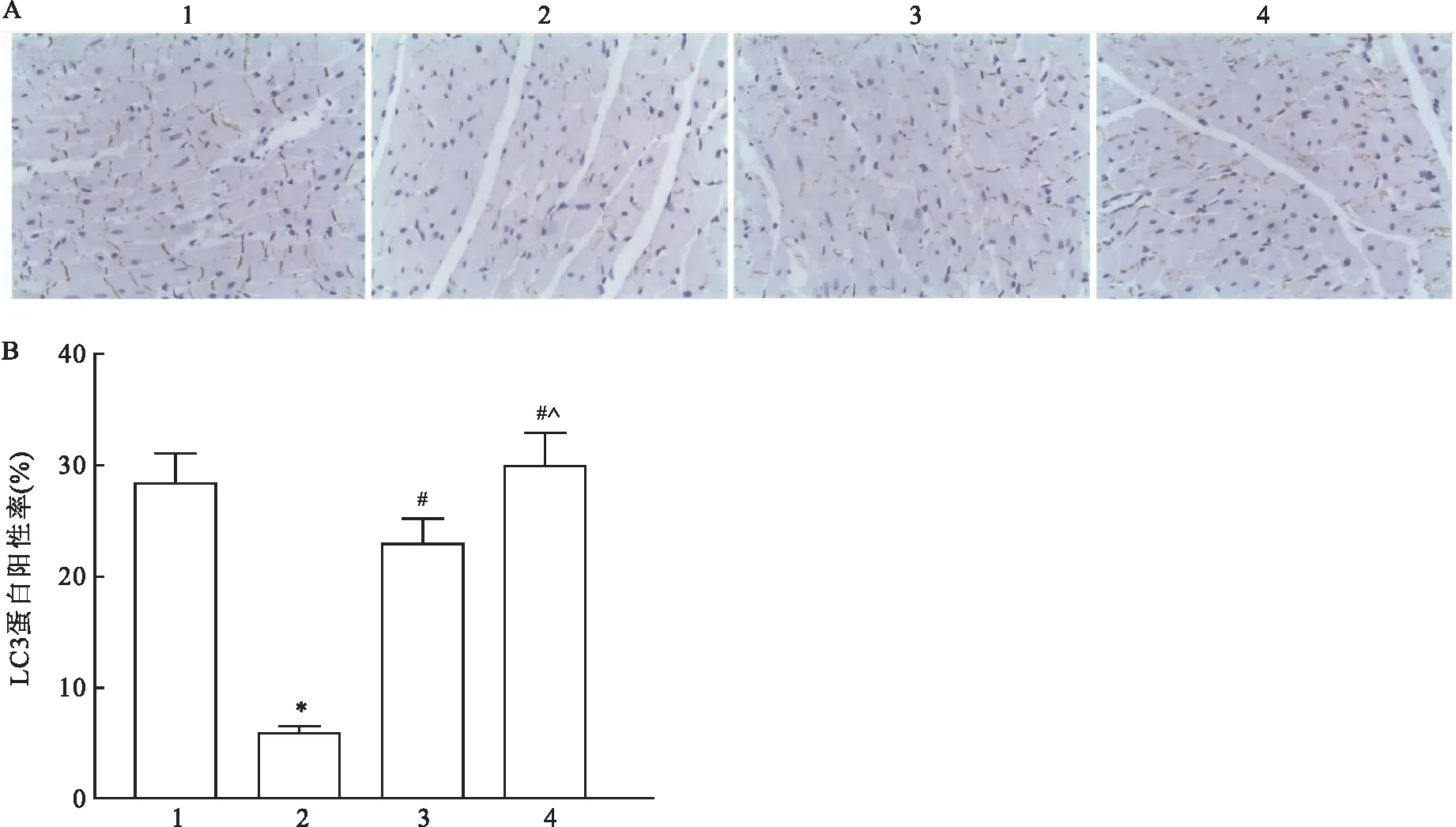
图5 各组大鼠心肌组织自噬标志物LC3表达检测结果 S-P×100
Western blot检测结果显示,各组大鼠心肌组织内LC3-Ⅱ/LC3-Ⅰ比值、Beclin-1和p62蛋白相对表达量之间差异有统计学意义(F=56.241、89.472、132.418,均P<0.001)。与对照组比较,模型组大鼠心肌组织内LC3-Ⅱ/LC3-Ⅰ比值下降,Beclin-1蛋白相对表达量下调而p62蛋白相对表达量上调(P<0.05);与模型组比较,低剂量RVD1组与高剂量RVD1组大鼠心肌组织内LC3-Ⅱ/LC3-Ⅰ比值升高,Beclin-1蛋白相对表达量上调而p62蛋白相对表达量下调(P<0.05);与低剂量RVD1组比较,高剂量RVD1组大鼠心肌组织内LC3-Ⅱ/LC3-Ⅰ比值进一步升高,且Beclin-1蛋白相对表达量上调、p62蛋白相对表达量下调(P<0.05)。见图6。
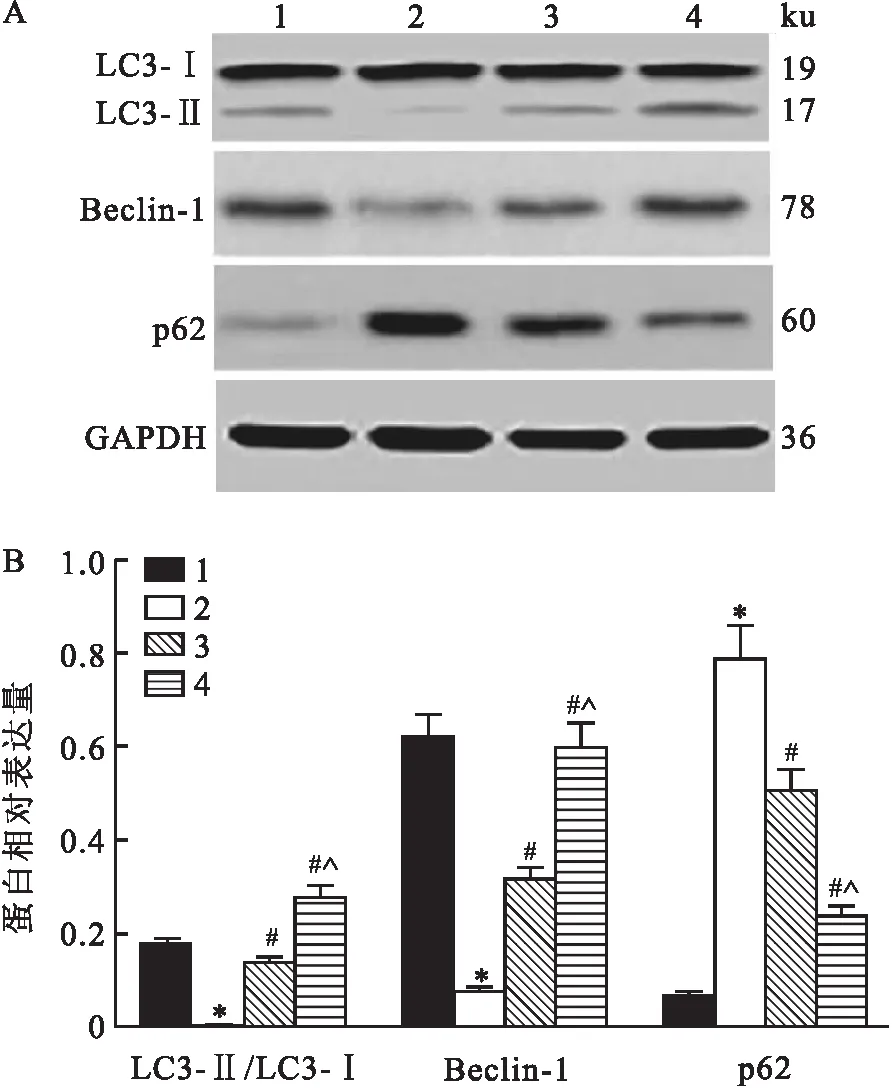
图6 各组大鼠心肌组织内自噬相关蛋白表达检测结果
2.6 各组大鼠心肌组织内MAMs变化情况比较透射电镜观察结果显示,与对照组比较,模型组大鼠心肌组织MAMs结构疏松,占线粒体周长百分比减少(P<0.05);与模型组比较,低剂量RVD1组与高剂量RVD1组MAMs结构较为紧密,占线粒体周长百分比增加(P<0.05);与低剂量RVD1组比较,高剂量RVD1组MAMs结构更加紧密,占线粒体周长百分比也增加(P<0.05)。见图7。
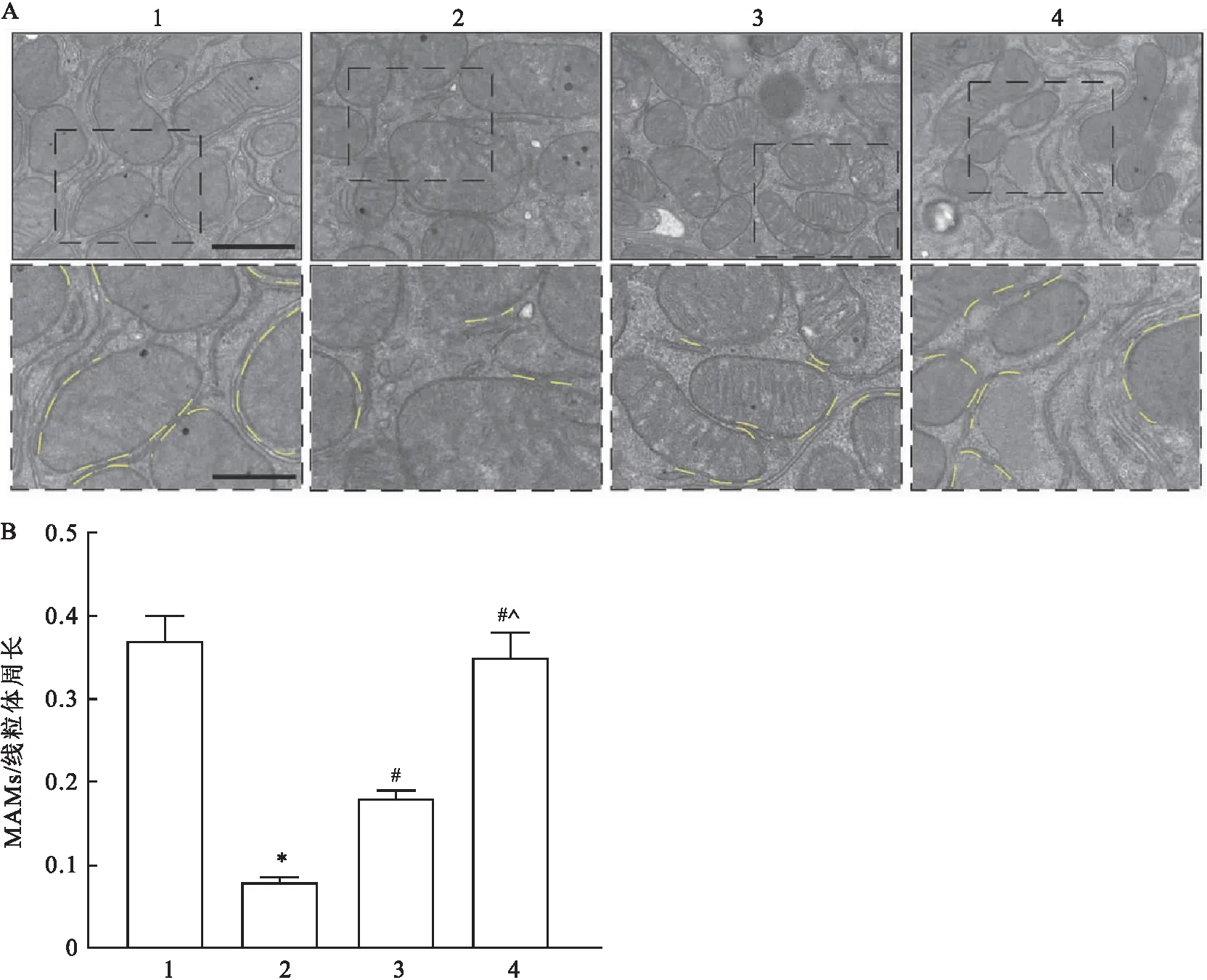
图7 各组大鼠心肌组织内MAMs结构变化观察结果
Western blot检测结果显示,各组大鼠心肌组织内GRP75、VDAC1、Mfn2蛋白相对表达量之间差异有统计学意义(F=112.457、64.193、45.208,均P<0.001)。与对照组比较,模型组大鼠心肌组织中GRP75、VDAC1及Mfn2蛋白相对表达量下调(P<0.05);与模型组比较,低剂量RVD1组与高剂量RVD1组大鼠心肌组织中GRP75、VDAC1及Mfn2蛋白相对表达量上调(P<0.05);高剂量RVD1组大鼠心肌组织中GRP75、VDAC1及Mfn2蛋白相对表达量均要高于低剂量RVD1组(P<0.05)。见图8。
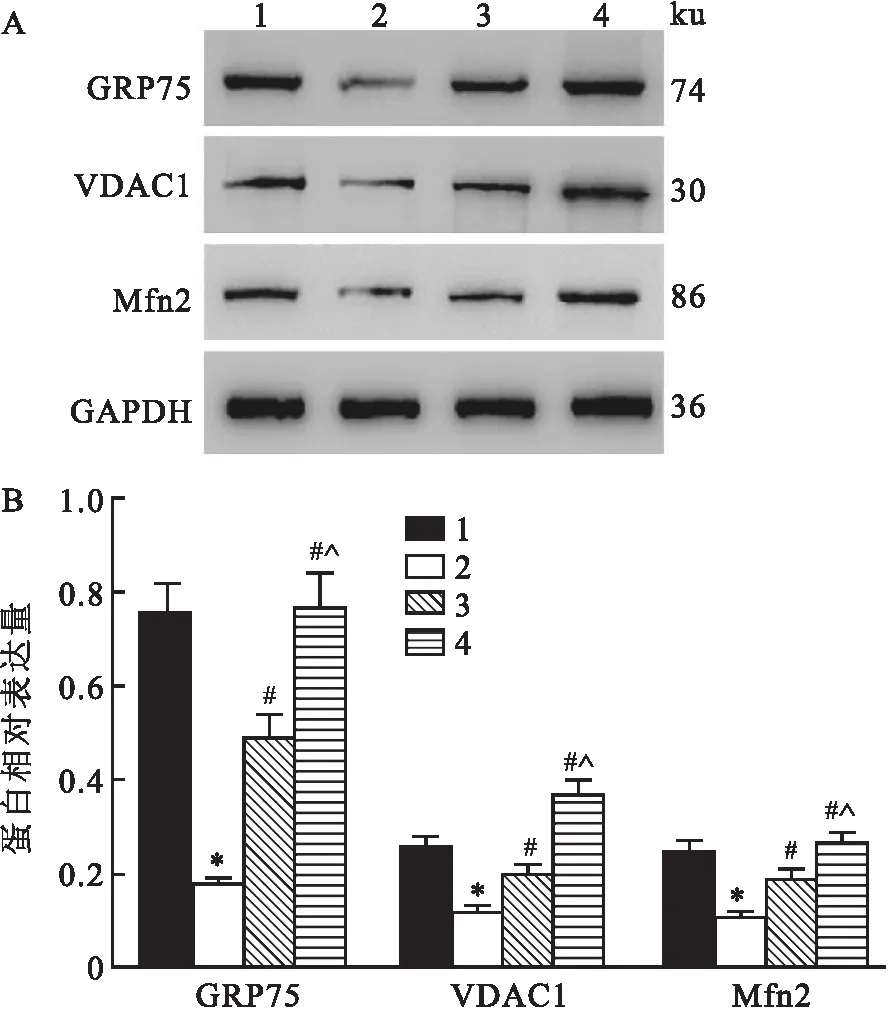
图8 各组大鼠心肌组织内MAMs相关蛋白表达检测结果
3 讨论
关于RVD1在心血管疾病中的保护作用已有报道,例如,Wang et al[7]研究表明RVD1改善了阿霉素诱导的小鼠心脏毒性,减少心肌细胞凋亡,其机制可能与抑制炎症、氧化应激和内质网应激有关;Salas-Hernández et al[8]指出RVD1能够抑制血管紧张素II诱导的心脏成纤维细胞分泌细胞炎症因子与细胞黏附蛋白,减轻心脏组织重塑,并有助于受损心脏组织的修复。该研究通过使用RVD1处理衰老大鼠后,检测结果显示,心肌组织内β-半乳糖苷酶活性降低,心肌纤维与心肌细胞受损得到改善,蓝染的胶原纤维沉积减少,由此说明,RVD1能够有效改善衰老大鼠心肌受损现象。
自噬是一种广泛存在于真核细胞中的代谢途径,通过溶酶体机制降解受损的细胞器和蛋白质。已知自噬在衰老的心肌组织中受到抑制,会导致心肌细胞稳态降低,促使心肌细胞凋亡,相反,增强自噬有助于减缓衰老相关心肌细胞凋亡、心脏肥大及纤维化,延缓心脏衰老[9]。一旦自噬被激活,可溶性LC3-Ⅰ蛋白通过磷脂酰乙醇胺的共价偶联形成LC3-Ⅱ,这对于自噬体的生成和伸长至关重要,因此,LC3-Ⅱ/LC3-Ⅰ比值降低则表明自噬受限[10]。该研究通过对衰老大鼠心肌组织进行检测显示,LC3蛋白阳性率下降,LC3-Ⅱ/LC3-Ⅰ比值下降,Beclin-1蛋白相对表达量下调,p62蛋白相对表达量上调,TUNEL标记的心肌细胞凋亡增加,以上结果说明衰老大鼠心肌组织内自噬功能障碍,增加了心肌细胞凋亡。而RVD1处理的衰老大鼠心肌组织中LC3蛋白阳性率增加,LC3-Ⅱ/LC3-Ⅰ比值升高,Beclin-1蛋白相对表达量上调而p62蛋白相对表达量下调,TUNEL标记的心肌细胞凋亡明显减少,该结果显示RVD1能够提高衰老大鼠心肌组织内自噬水平,抑制心肌细胞凋亡。
MAMs介导多种细胞功能,包括钙稳态调节、脂质代谢、未折叠蛋白反应、线粒体动力学、自噬等,这些都是心血管疾病的关键危险因素。此外,MAMs与衰老或衰老过程密切相关,已知衰老性肌萎缩的发生与MAMs处钙离子转移异常、内质网应激等有关,通过运动调节MAMs能够缓解衰老性肌萎缩[11]。有研究[12]表明,HIV-1病毒TAT蛋白诱导神经元细胞会破坏MAMs结构,引起活性氧(reactive oxygen species,ROS)积累及线粒体应激,并改变MAMs相关蛋白表达,从而导致大脑过早衰老。MAMs的形成依赖于内质网和线粒体上的互补膜蛋白将两个细胞器在特定位置连接在一起。因此,MAMs上某些蛋白质的缺失或某些蛋白之间相互作用的中断会导致MAMs结构和功能的破坏。VDAC1通过GRP75与内质网上的肌醇1,4,5-三磷酸1型受体相互作用,介导钙离子从内质网转移到线粒体上,这对于维持MAMs结构与功能至关重要[13]。Mfn2在MAMs有定位,通过形成同源或异源二聚体将2个相邻的线粒体与Mfn1连接起来来介导外线粒体膜融合,其功能丧失会降低线粒体融合效率并诱导线粒体碎裂,破坏MAMs[14]。该研究经检测显示,衰老大鼠心肌组织MAMs结构疏松,占线粒体周长百分比减少,GRP75、VDAC1及Mfn2蛋白相对表达量也下调,说明心肌组织内MAMs结构与功能受损。此外,经过RVD1处理的衰老大鼠心肌组织MAMs结构较为紧密,占线粒体周长百分比增加,同时,GRP75、VDAC1及Mfn2蛋白相对表达量也上调,由此推测,RVD1能够调节衰老大鼠心肌组织内MAMs,从而对心肌组织起到保护作用。

