miR-145-3p通过调控CaMkkβ/AMPK/CREB通路对MPP+诱导PD细胞模型线粒体自噬的影响
文晓东,罗 宁,周欣梅,卢建政,曾 振,张 艺,王春玲
帕金森病(Parkinson′s disease,PD)是一种复杂的神经退行性疾病。研究[1-2]表明,线粒体功能障碍、氧化应激、自噬受损和神经炎症等均与PD的发生密切相关。目前,PD的治疗主要以药物治疗为主,但长期服用会产生不良反应,因此,研究PD的发病机制对于PD的治疗具有重要意义。线粒体异常被认为是包括PD在内的多种神经退行性疾病的一个重要靶点,清除受损线粒体的唯一途径是线粒体自噬,这提示刺激线粒体自噬可作为延缓PD患者神经退行性过程的一种有效的方法[3]。
miR-145-3p是一种新发现的miRNA,研究[4]表明,miR-145-3p参与包括自噬在内的多种细胞生物学过程的调控,但关于miR-145-3p在PD中的作用还未有报道。自噬过程受到多种信号通路的调控,其中钙调蛋白依赖性蛋白激酶激酶β(calmodulin-dependent protein kinase kinaseβ,CaMkkβ)/腺苷酸活化蛋白激酶(adenylate activated protein kinase,AMPK)通路与自噬密切相关,并可激活下游环磷酸腺苷反应元件结合蛋白(cyclic adenosine monophosphate response element-binding protein,CREB),参与多种神经退行性疾病[5]。因此,该研究通过构建1-甲基-4苯基吡啶离子(1-methyl-4-phenylpyridiniumion,MPP+)诱导的PD细胞模型,研究miR-145-3p对PD细胞模型线粒体自噬的影响及其机制,为深入了解PD的发病机制及寻找新的治疗靶点提供参考依据。
1 材料与方法
1.1 主要材料人神经母细胞瘤细胞SH-SY5Y购自中科院细胞库,DMEM/F12购自美国Hyclone公司,CaMkkβ抑制剂STO-609购自美国Selleck公司,CERB抑制剂KG-501购自美国MCE公司,CCK-8购自北京索莱宝科技有限公司,qRT-PCR试剂盒购自日本TAKARA公司,AnnexinV-FITC/PI凋亡检测试剂盒购自美国BD公司,兔抗Bcl-2、Bax、Caspase-3、Beclin-1、LC3-Ⅰ、LC3-Ⅱ、CaMkkβ、AMPK、CREB和HRP标记的二抗均购自武汉Bioswamp公司,兔抗磷酸化钙调蛋白依赖性蛋白激酶激酶β(phosphorylated calmodulin-dependent protein kinase kinaseβ,p-CaMkkβ)购自美国Invitrogen公司,兔抗磷酸化腺苷酸活化蛋白激酶(phosphorylated cadenylate activated protein kinase,p-AMPK)购自美国Abcam公司,兔抗磷酸化环磷酸腺苷反应元件结合蛋白(phosphorylated cyclic adenosine monophosphate response element-binding protein,p-CREB)购自美国GeneTex公司,锇酸、枸橼酸铅购自北京中镜科仪技术有限公司,醋酸铀购自西安鼎天化工有限公司。
1.2 方法
1.2.1细胞培养及MPP+诱导PD细胞模型的构建 SH-SY5Y细胞用含15%胎牛血清和1%青-链霉素的高糖DMEM培养液置于37 ℃、5%CO2的培养箱中培养,细胞融合度达到80%时按照1 ∶2的比例进行传代,选取对数期生长的细胞进行实验。利用250 μmol/L的MPP+干预处理SH-SY5Y细胞24 h,构建PD细胞模型[6]。CCK-8检测细胞的增殖能力,结果显示MPP+处理后细胞增殖能力降低,表明PD细胞模型构建成功。
1.2.2细胞转染及转染效率鉴定 合成并构建miR-145-3p的mimics及对应的NC,转入 MPP+诱导PD细胞模型中,以未做处理的SH-SY5Y细胞和未转染的MPP+诱导损伤PD细胞模型为对照,分别提取各组细胞的总RNA,qRT-PCR法检测miR-145-3p的表达,验证转染效率。结果显示,与对照组相比,模型组细胞中miR-145-3p水平降低;与模型组相比,mimics组细胞中miR-145-3p水平升高,而mimics-NC组细胞中miR-145-3p水平无明显变化,表明转染成功。
1.2.3细胞分组及处理 将细胞分为8组:对照组、模型组、mimics组、STO-609组、mimics+STO-609组、KG-501组、mimics+KG-501组、STO-609+KG-501组。对照组细胞不做处理;其余组细胞均用250 μmol/L的MPP+诱导24 h,mimics组细胞转入miR-145-3p mimics;STO-609组加入20 μmol/L STO-609[7];mimics+STO-609组先加入20 μmol/L STO-609处理1 h,再转入miR-145-3p mimics;KG-501组加入5 nmol/L KG-501[8];mimics+KG-501组先加入5 nmol/L KG-501处理1 h,再转入miR-145-3p mimics;STO-609+KG-501组同时加入20 μmol/L STO-609和5 nmol/L KG-501。
1.2.4流式细胞术检测细胞凋亡 收集各组处理完成的细胞,取1×106个培养基重悬的细胞,弃上清液,加入1 ml预冷的PBS,混匀后弃上清液,200 μl PBS重悬细胞沉淀,加入10 μl Annexin V-FITC和10 μl PI,混匀,4 ℃避光孵育30 min,最后加入300 μl PBS,随即进行流式检测。
1.2.5透射电镜观察自噬泡和自噬体 收集各组细胞用2.5%戊二醛预固定30 min以上,0.1 mol/L PBS缓冲液清洗3次,1%锇酸后固定1 h,PBS缓冲液清洗3次后,50%~90%乙醇梯度脱水,90%丙酮脱水,100%丙酮2次脱水,包埋后超薄切片机切片,厚度约为60 nm,醋酸铀和枸橼酸铅双染,透射电镜观察并拍照。
1.2.6Western blot检测凋亡、自噬和CaMkkβ/AMPK/CREB通路相关蛋白的表达 细胞取出后,吸弃培养液,预冷的PBS洗涤2次后,加入裂解液,充分裂解后将细胞转移至1.5 ml EP管中,取上清液BCA法进行蛋白质定量。上样电泳,湿转至PVDF膜,5%脱脂奶粉室温封闭4 ℃过夜,加入一抗稀释液室温孵育1 h,洗膜后加入二抗稀释液,室温孵育1 h,洗膜后ECL显影,TANON GIS读取条带灰度值。
2 结果
2.1 miR-145-3p对MPP+诱导PD模型细胞凋亡率的影响与对照组相比,模型组细胞凋亡率升高;与模型组相比,mimics组细胞凋亡率降低,KG-501组和STO-609组细胞凋亡率升高;与mimics组相比,mimics+STO-609组和mimics+KG-501组细胞凋亡率均升高;与STO-609组相比,STO-609+KG-501组细胞凋亡率升高(F=1 085.53,P<0.01)。见表1和图1。
表1 各组细胞凋亡率
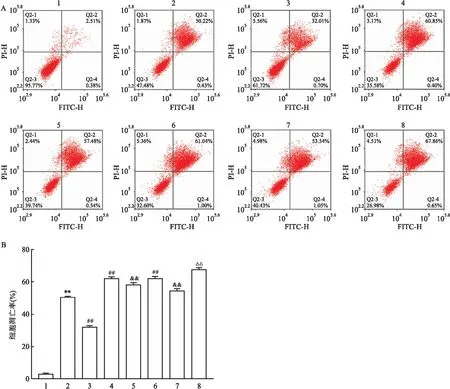
图1 各组细胞凋亡率的比较
2.2 miR-145-3p调控MPP+诱导PD模型细胞中凋亡相关蛋白的表达与对照组相比,模型组细胞中Bcl-2蛋白表达水平降低,Bax和Caspase-3蛋白表达水平升高;与模型组相比,mimics组细胞中Bcl-2蛋白表达水平升高,Bax和Caspase-3蛋白表达水平降低,STO-609组和KG-501组细胞中Bcl-2蛋白表达水平降低,Bax和Caspase-3蛋白表达水平升高;与mimics组相比,mimics+STO-609组和mimics+KG-501组细胞中Bcl-2蛋白表达水平降低,Bax和Caspase-3蛋白表达水平升高;与STO-609组相比,STO-609+KG-501组细胞中Bcl-2蛋白表达水平降低,Bax和Caspase-3蛋白表达水平升高。Bcl-2、Bax和Caspase-3蛋白表达差异均有统计学意义(F=243.15,P<0.01;F=657.83,P<0.01;F=344.55,P<0.01)。见表2和图2。
表2 各组细胞内Bcl-2、Bax和Caspase-3蛋白相对表达
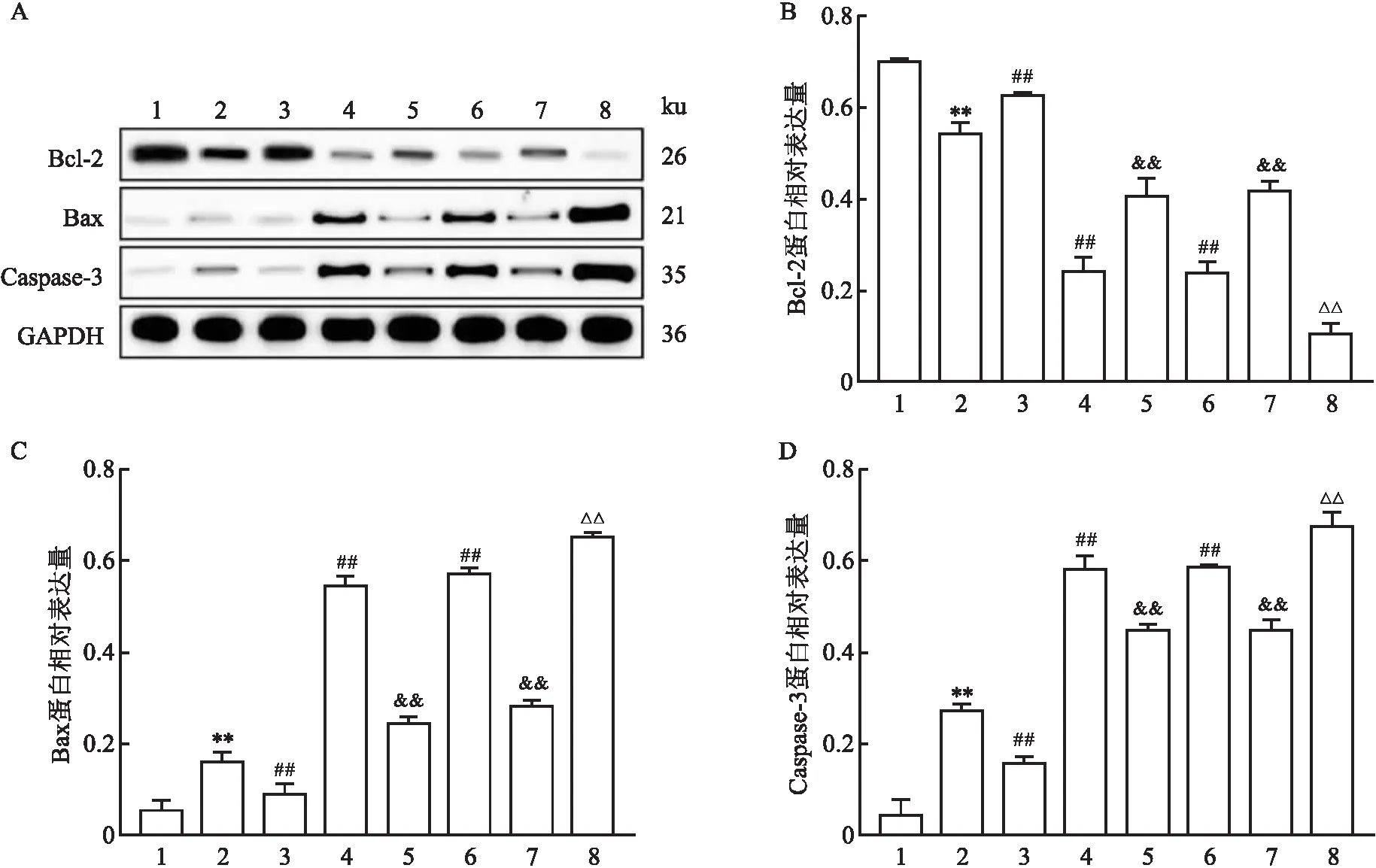
图2 各组细胞凋亡相关蛋白的表达
2.3 miR-145-3p对MPP+诱导PD模型细胞中自噬的影响对照组细胞内可见大量自噬体结构;模型组细胞内自噬体结构较对照组明显减少;mimics组细胞内自噬体结构较模型组增多,而STO-609组和KG-501组细胞内自噬体结构较模型组进一步减少;与mimics组相比,mimics+STO-609组和mimics+KG-501组细胞内自噬体结构均减少;STO-609+KG-501组较STO-609组和KG-501组自噬体结构进一步减少。见图3。
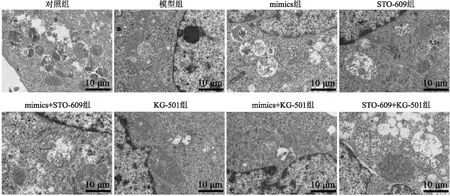
图3 各组细胞透射电镜观察结果 ×12 000
2.4 miR-145-3p调控MPP+诱导PD模型细胞中自噬相关蛋白的表达与对照组相比,模型组细胞中Beclin-1和LC3-Ⅱ蛋白表达水平降低(P<0.01),LC3-Ⅰ蛋白表达水平升高(P<0.01);与模型组相比,mimics组细胞中Beclin-1和LC3-Ⅱ蛋白表达水平升高(P<0.05),LC3-Ⅰ蛋白表达水平降低(P<0.05),STO-609组和KG-501组细胞中Beclin-1和LC3-Ⅱ蛋白表达水平降低(P<0.01),LC3-Ⅰ蛋白表达水平升高(P<0.01);与mimics组相比,mimics+STO-609组和mimics+KG-501组细胞中Beclin-1和LC3-Ⅱ蛋白表达水平降低(P<0.01),LC3-Ⅰ蛋白表达水平升高(P<0.01);与STO-609组相比,STO-609+KG-501组细胞中Beclin-1和LC3-Ⅱ蛋白表达水平降低(P<0.01),LC3-Ⅰ蛋白表达水平升高(P<0.01)。Beclin-1、LC3-Ⅰ和LC3-Ⅱ蛋白表达差异均有统计学意义(F=405.45,P<0.01;F=177.03,P<0.01;F=333.62,P<0.01)。见表3和图4。
表3 各组细胞内Beclin-1、LC3-Ⅰ和LC3-Ⅱ蛋白相对表达
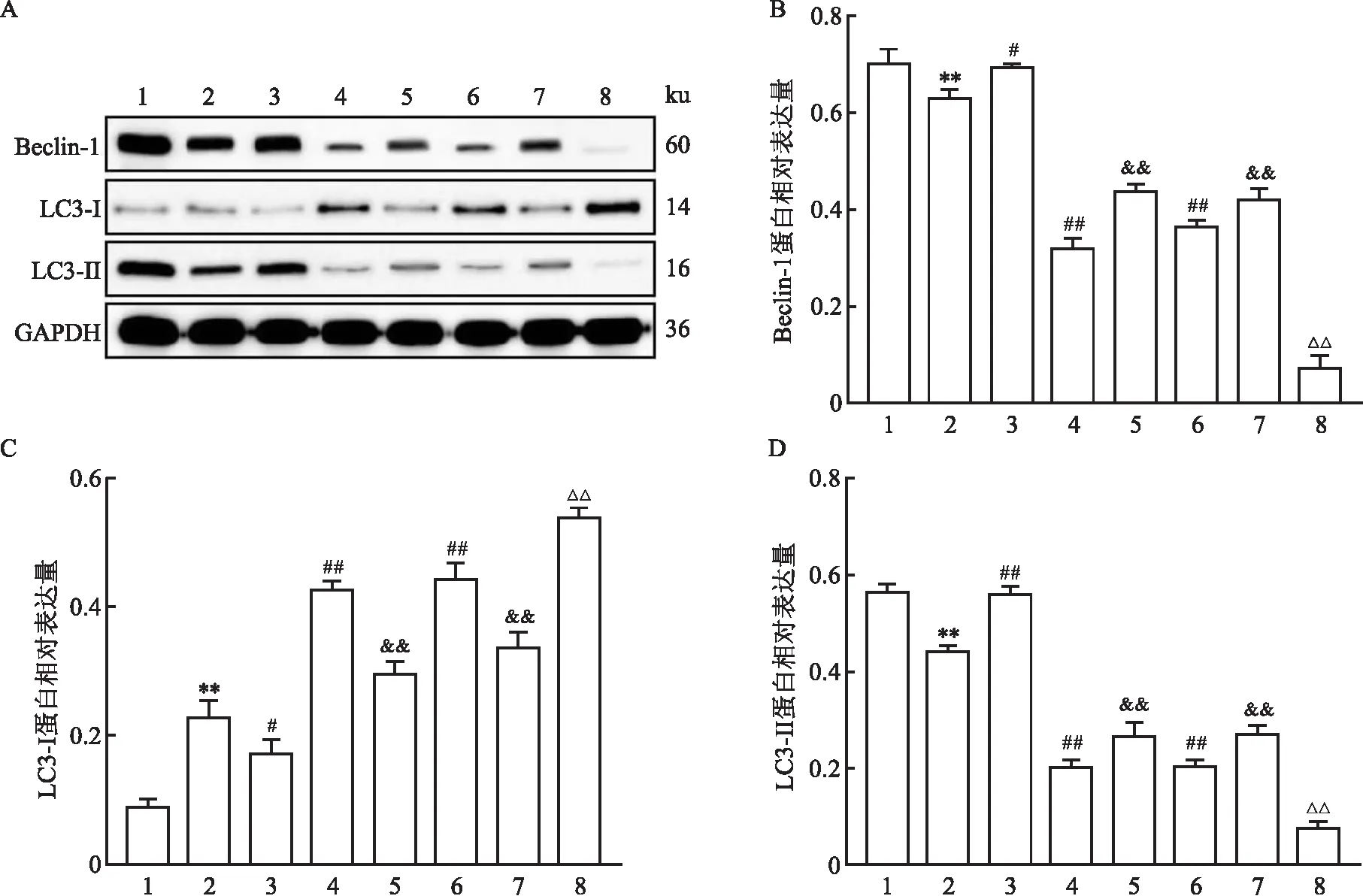
图4 各组细胞中自噬相关蛋白表达水平的比较
2.5 miR-145-3p促进MPP+诱导PD细胞模型CaMkkβ/AMPK/CREB通路的激活与对照组相比,模型组细胞中p-CaMkkβ、p-AMPK、p-CREB蛋白表达水平降低(P<0.01);与模型组相比,mimics组细胞中p-CaMkkβ、p-AMPK、p-CREB蛋白表达水平升高(P<0.01),STO-609组和KG-501组细胞中p-CaMkkβ、p-AMPK、p-CREB蛋白表达水平降低(P<0.01);与mimics组相比,mimics+STO-609组和mimics+KG-501组细胞中p-CaMkkβ、p-AMPK、p-CREB蛋白表达水平降低(P<0.01);与STO-609组相比,STO-609+KG-501组细胞中p-CaMkkβ、p-AMPK、p-CREB蛋白表达水平降低(P<0.05)。CaMkkβ、AMPK和CREB的磷酸化差异均有统计学意义(F=1 498.40,P<0.01;F=89.77,P<0.01;F=329.24,P<0.01)。见表4和图5。
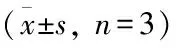
表4 各组细胞内p-CaMkkβ/CaMkkβ、p-AMPK/AMPK和p-CREB/CREB的蛋白相对表达
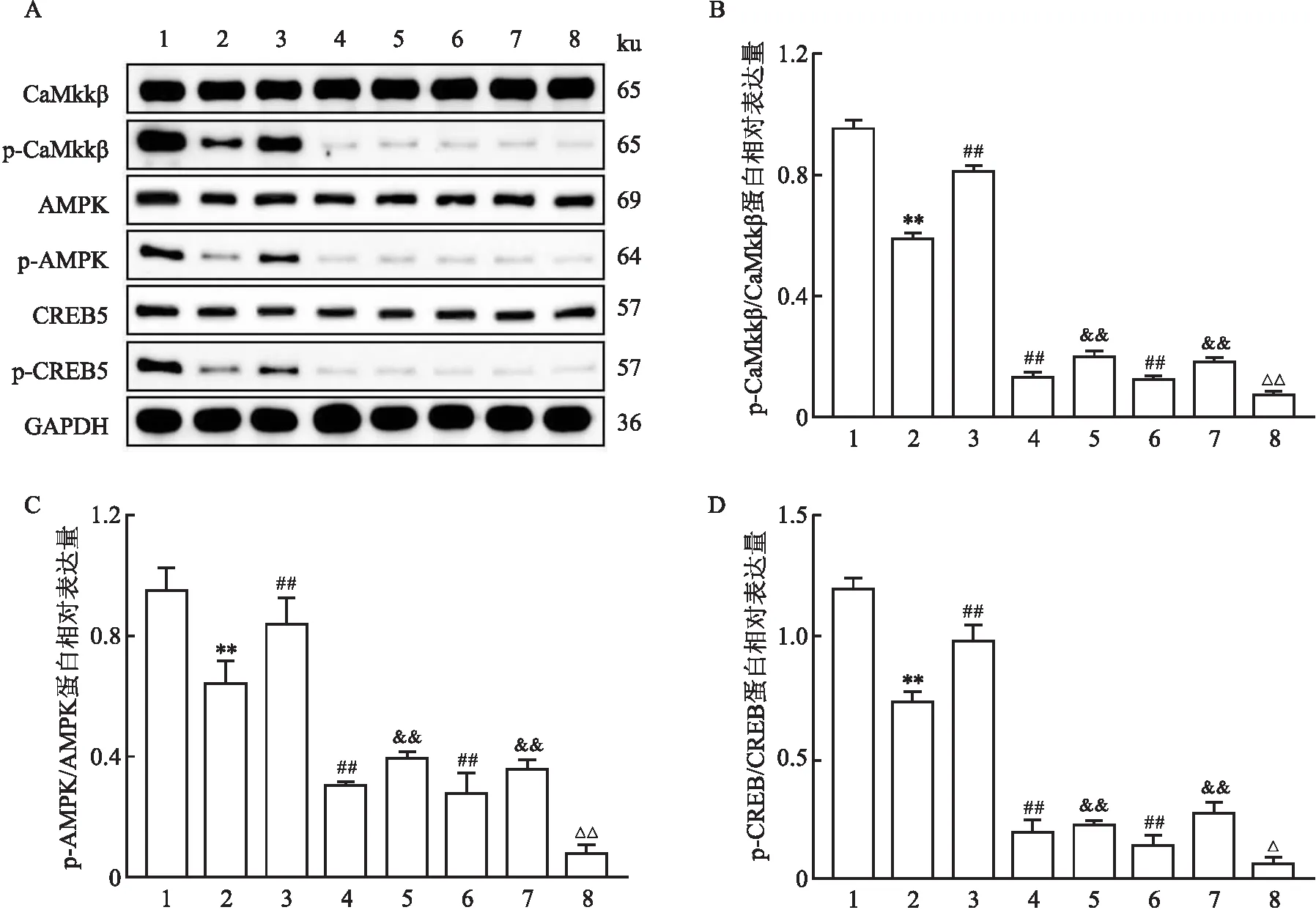
图5 各组细胞中CaMkkβ/AMPK/CREB通路相关蛋白表达水平的比较
3 讨论
线粒体自噬可选择性地清除细胞内受损或多余的线粒体,以维持细胞内线粒体数量和功能的正常,线粒体自噬功能紊乱在包括PD在内的神经退行性疾病中发挥关键作用。当神经细胞暴露于MPP+等神经毒素中时,会引起神经细胞的自噬和死亡的增加[9]。该实验的结果显示,MPP+处理的SH-SY5Y细胞的凋亡率升高,而转染miR-145-3p mimics后细胞凋亡率降低,这表明miR-145-3p能够抑制PD细胞模型的凋亡,具有保护PD细胞模型的作用。众所周知,细胞凋亡是一个受多基因控制的过程,Bcl-2家族成员的抗凋亡蛋白Bcl-2和促凋亡蛋白Bax共同调控细胞凋亡。当Bax的活性高于Bcl-2时,Bax的构象发生变化并易位到线粒体膜上,促进细胞色素C释放到细胞质中,并促进Caspase-3的活化,启动线粒体途径的细胞凋亡[10]。该实验检测了Bcl-2、Bax和Caspase-3蛋白的表达,结果显示,转染miR-145-3p mimics后细胞中Bax和Caspase-3蛋白表达水平较模型组降低,Bcl-2蛋白表达水平较模型组升高,提示miR-145-3p可能通过抑制线粒体途径凋亡而抑制PD细胞模型的凋亡。
为了探讨miR-145-3p对MPP+诱导的PD细胞模型线粒体自噬的影响,该实验利用透射电镜观察了细胞内的自噬体结构,结果显示,转染miR-145-3p mimics后细胞中自噬结构增多,表明miR-145-3p能够促进PD细胞模型中的线粒体自噬。Beclin-1是一种线粒体自噬调控蛋白,可作为自噬标志物用于自噬水平的检测[11]。Beclin-1上调能够增强线粒体自噬水平,从而发挥保护细胞的作用。Beclin-1可与LC3结合形成复合物参与自噬体的形成,当发生自噬时,LC3-Ⅰ发生泛素化与自噬膜表面的物质结合形成LC3-Ⅱ,因此,LC3-Ⅱ可作为检测自噬活性的标志物[12]。该结果显示,转染miR-145-3p mimics后PD细胞模型中Beclin-1和LC3-Ⅱ蛋白水平升高,LC3-Ⅰ蛋白水平降低,进一步表明miR-145-3p能够促进MPP+诱导的PD细胞模型的线粒体自噬,具有保护神经元的作用。
CaMkkβ/AMPK通路介导线粒体自噬,激活CaMkkβ/AMPK通路可以促进细胞的自噬[13]。有研究[14]表明CaMkkβ/AMPK通路与神经元中的线粒体自噬相关,CaMkkβ可激活AMPK,AMPK激活后可促进TSC2活化发生磷酸化,从而激活CREB,CREB是一种转录增强因子,能够促进神经元的成熟和神经递质的释放,与包括PD在内的多种神经退行性疾病密切相关[15]。为了明确miR-145-3p调控MPP+诱导的SH-SY5Y细胞线粒体自噬发挥神经元保护的作用机制,该实验检测了CaMkkβ/AMPK/CREB通路相关蛋白的磷酸化水平,结果显示,转染miR-145-3p mimics后,PD细胞模型中p-CaMkkβ、p-AMPK、p-CREB水平升高,表明miR-145-3p具有调控CaMkkβ/AMPK/CREB通路的作用。为了进一步明确其机制,该实验又利用CaMkkβ抑制剂STO-609和CERB抑制剂KG-501处理细胞,结果显示,STO-609和KG-501均能降低MPP+诱导的SH-SY5Y细胞中p-CaMkkβ、p-AMPK、p-CREB的水平,且转染miR-145-3p mimics后细胞中p-CaMkkβ、p-AMPK、p-CREB的水平均升高,这表明miR-145-3p可通过促进CaMkkβ/AMPK/CREB通路的激活来促进线粒体自噬,从而发挥神经元保护作用。

