改性多孔硅酸镁纳米材料对废水中Ni2+的吸附性能
鲍 静,冯拥军,潘 勇,蒋军成
(1. 南京工业大学 安全科学与工程学院,江苏 南京 211800;2. 江苏省危险化学品本质安全与控制技术重点实验室,江苏 南京 211800;3. 北京化工大学 化工资源有效利用国家重点实验室,北京 100029)
近年来,我国电镀行业快速发展,大部分电镀过程中均会产生含Ni2+废水,主要来源包括镍镀件生产过程中的清洗用水、过滤用水以及废镀液与退镀液处理过程中因操作不当而造成的含Ni2+排放和泄漏[1-2]。研究显示,进入人体后Ni2+可与蛋白质形成多种复合物,这些复合物会导致皮肤的过敏反应和鼻、肺细胞DNA损伤,同时可能损伤人体细胞中的遗传物质[3]。因含有Ni2+的废水排放量逐年增加,镍污染造成的水安全问题已引起人们的重视,所以开发高效去除废水中重金属Ni2+的方法刻不容缓。常用的方法有化学沉淀法、化学电解法、生物法、膜分离法以及吸附法等[4-6],其中吸附法具有操作简单、方便快捷而且二次污染小等优点,是目前常用去除水中重金属的方法[7-10]。
吸附法中吸附材料的效能除了与吸附材料的化学组成有关外,还与其比表面积、孔结构以及孔大小的分布有关。高比表面积提供更多的吸附场所,有利于提高吸附质的吸附量[11];优良的孔结构和多级孔径分布有利于吸附活性位点的暴露,提高吸附材料整体的利用率,大大提高吸附效率[12-14]。近年来,对较成熟的吸附材料进行改性以提高其吸附效能成为研究热点。Ranasinghe等[15]分别用乙二胺四乙酸(EDTA)、十二烷基硫酸钠(SLS)、NaOH和HNO34种改性剂对菠萝蜜皮进行表面改性,以增大菠萝蜜皮的比表面积,同时利用改性剂表面官能团的配位、离子交换和水解等特性以增强改性后菠萝蜜皮的吸附能力,研究表明,在最佳吸附剂用量、接触时间、改性剂浓度和溶液pH条件下,用EDTA、SLS、NaOH和HNO3改性后的菠萝蜜皮对Ni2+的最大吸附量分别为52.08、20.88、27.17和21.88 mg/g,改性后的菠萝蜜皮对Ni2+的吸附性能优于未改性菠萝蜜皮。Chen等[16]制备了SLS改性的钙铝层状双氢氧化物(LDH),经研究发现,当LDH用量为0.5 g/L时,Ni2+的最大去除量可达2.45 mol/g。Ali等[17]用HNO3、H3PO4和NaOH对实验室制备的硅酸镁进行改性,并研究改性材料对Cu2+、Cd2+、Ni2+和Fe3+过渡金属离子的吸附性能与pH的变化关系,结果发现,与未改性材料相比,改性后的材料具有良好的重金属去除潜力。
多孔硅酸镁具有资源丰富、价廉易得、热稳定性强及环境友好等特点,其比表面积高,介孔和大孔数量丰富,表面、层间和内壁含有大量的硅羟基(Si—OH),易于被改性[18-19],且具备两性吸附能力,在吸附水中重金属阳离子领域表现出良好的应用潜力[20]。Huang等[21]在不使用任何模板的前提下,采用乙醇/水混合溶剂热法,在自加热反应釜中,于170 ℃反应24 h,制备系列高效花状硅酸镁纳米吸附材料,研究了该材料对Pb2+、Cu2+和Zn2+3种重金属阳离子的吸附行为,结果发现花状硅酸镁吸附材料对重金属阳离子具有较好的吸附性能,其中对Pb2+最大吸附量为436.7 mg/L(Pb2+的初始质量浓度为100 mg/L)。目前,多孔硅酸镁材料吸附废水中Ni2+的相关研究报道较少,故本文以废水中Ni2+为目标吸附质,进行系列改性硅酸镁材料的吸附效能研究。
十二烷基磺酸钠(SDS)是一种常见的阴离子型表面活性剂,廉价易得,毒性较小。SDS在水中解离后会生成亲水性阴离子[22-24],该特性可以使吸附材料表面带负电荷,从而加强其对水中重金属阳离子的吸附作用。SDS所含的大量甲基和乙基基团易包裹在颗粒表面形成胶束,加强了与吸附质中正价离子的静电引力,提高了纳米吸附材料的吸附效能。同时,SDS易在微粒表面形成表面膜,能够防止纳米颗粒在水中团聚。综上,本文选用不同质量比例的SDS改性的系列花状硅酸镁[25]为吸附剂,研究SDS添加量对吸附剂吸附废水中Ni2+的影响,以期建立改性花状硅酸镁材料结构性质与吸附行为之间的构-效关系[26],为设计开发具有优良吸附能力的材料提供指导。
1 实验部分
1.1 主要试剂和仪器
系列改性多孔花状硅酸镁[25]均为实验室自制。未添加SDS的硅酸镁纳米材料记为FMS。粉末状SDS添加量(占混合液的质量分数)为1%、3%和5%的改性硅酸镁纳米材料分别记为1-FMS、3-FMS和5-FMS。
NiCl2·6H2O,分析纯(AR),质量分数大于99%,上海阿达玛斯试剂有限公司;浓硝酸,AR,质量分数大于70%,上海阿拉丁试剂有限公司;去离子水为实验室自制。
PHS 3C 型pH计,上海雷磁仪器厂;FA2004型电子天平,上海亭衡衡器有限公司;TS-20H台式恒温摇床,上海天呈实验仪器有限公司;Shimadzu ICPS-7500型电感耦合等离子发射光谱仪(ICP-AES),日本岛津公司;Zetasizer Nano ZSE型Zeta电位测试仪,马尔文帕纳科公司。
1.2 吸附动力学实验
在100 mL去离子水中边搅拌边加入40.50 mg粉末状NiCl2·6H2O,制备质量浓度约100 mg/L的Ni2+溶液,实际浓度由ICP-AES测定,并用HNO3调节pH约为5.0以防止水解。
在100 mL锥形瓶中先加入50 mL Ni2+溶液,然后分别加入约20 mg系列硅酸镁材料,将混合溶液置于摇床上,恒温25 °C,摇床振荡速率120 r/min,开始计时,在不同时间点,用过滤注射器取清液,使用ICP-AES检测清液中Ni2+和 Mg2+的离子浓度。
硅酸镁材料对Ni2+的吸附量(qt)由式(1)计算。
(1)
式中:ρ0为Ni2+的初始质量浓度,mg/L;ρt为t时刻Ni2+的质量浓度,mg/L;V为Ni2+溶液的体积,L;m为硅酸镁吸附材料的质量,g。
1.3 吸附热力学实验
配制一系列不同质量浓度的Ni2+溶液(0~250 mg/L)。取不同质量浓度的Ni2+溶液各50 mL,分别加到100 mL锥形瓶中,加入约20 mg硅酸镁材料进行吸附实验,25 ℃摇床恒温振荡(120 r/min)吸附12 h,用过滤注射器取清液,用ICP-AES检测清液中Ni2+和 Mg2+的离子浓度,并计算吸附量。
2 结果与讨论
2.1 改性花状硅酸镁材料吸附Ni2+的性能
2.1.1 吸附动力学性能
图1为4个花状硅酸镁材料的Ni2+吸附量(qt)随时间(t)的变化。由图1可知:随着SDS用量的增加,所得材料达到吸附平衡的时间越来越短,平衡吸附量(qe)也越来越大,依次为165.55、173.48、202.01和231.62 mg/g。这是由于增加SDS用量,得到的改性硅酸镁的孔径和比表面积更大,吸附效果更好,因此大的孔径有利于传质,促进了Ni2+的传输,使其很快达到吸附平衡,而更大的比表面积则可以吸附更多的Ni2+。
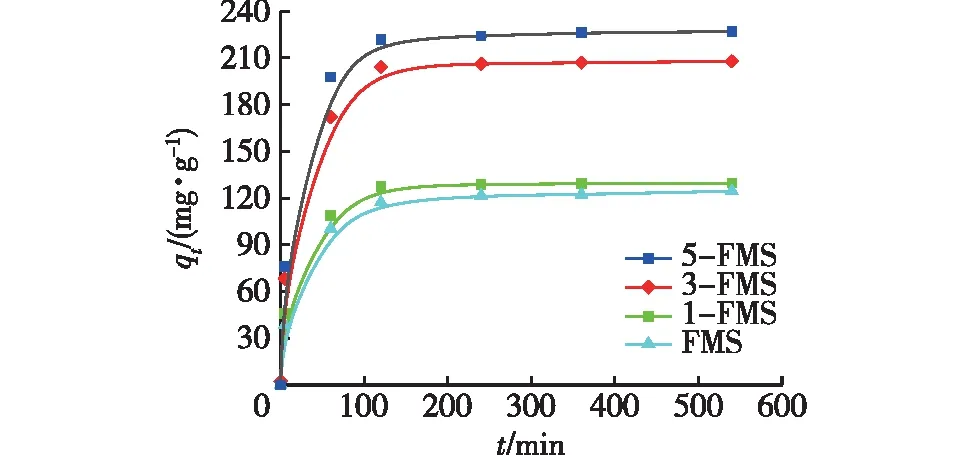
图1 4个材料的Ni2+吸附量Fig.1 Ni2+ adsorption capacity of 4 materials
为深入研究改性花状硅酸镁材料吸附Ni2+的机制,使用拟一级动力学模型(式(2))、拟二级动力学模型(式(3))和颗粒内扩散模型(式(4))对实验结果进行分析,结果见图2。
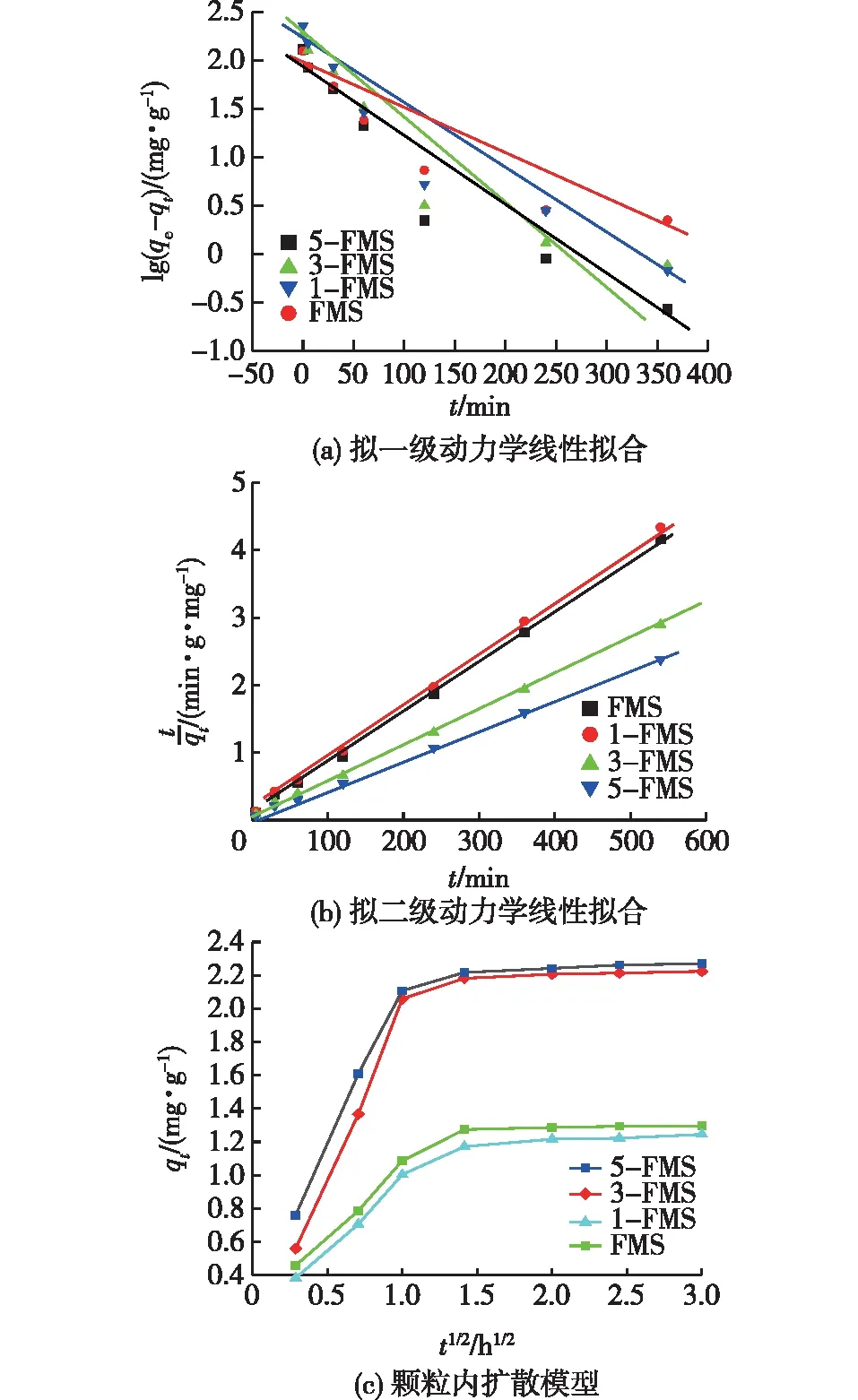
图2 4个材料对Ni2+的吸附动力学Fig.2 Ni2+ adsorption kinetics of 4 materials
(2)
(3)
(4)
式中:k1为拟一级动力学模型的速率常数,min-1;k2为拟二级动力学模型的速率常数,g/(mg·min);kdif为颗粒间扩散模型的速率常数,mg/(g·h1/2);C为截距。
通过图2(a)和2(b)的线性关系确定k1、k2和qe,结果见表1。由表1可见:这4个材料对Ni2+的吸附行为更符合拟二级吸附动力学模型,其相关系数R2更接近于1,qe计算值也与实际值一致。这表明化学吸附在改性花状硅酸镁吸附Ni2+的过程中起重要作用。
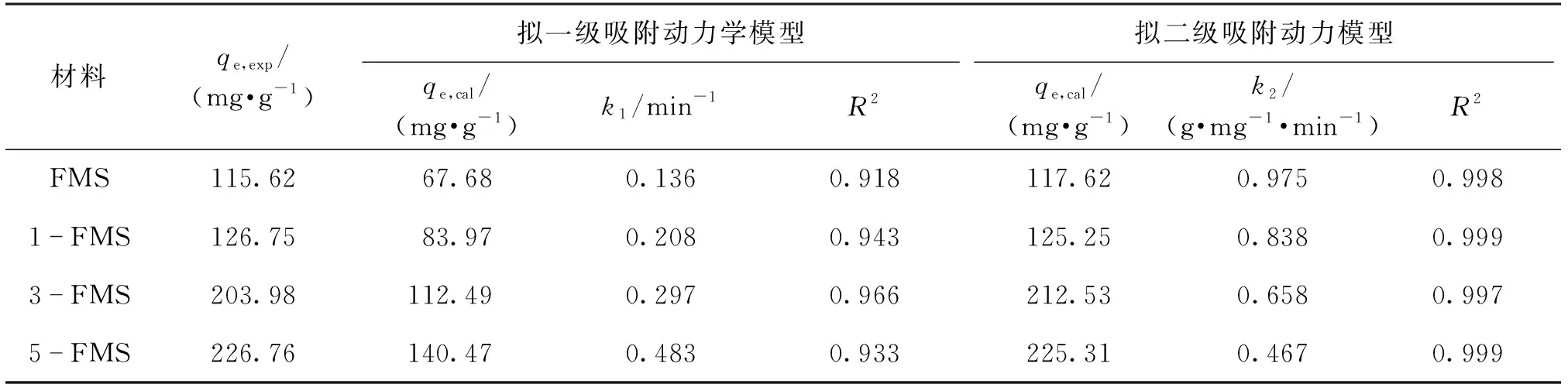
表1 4个材料对Ni2+吸附动力学拟合数值Table 1 Kinetic values for Ni2+ adsorption
由图2(c)可见:4个材料的吸附过程都呈现明显的2个阶段(传质阶段和吸附到达平衡阶段)。传质阶段包括边界层扩散、外表面吸附和颗粒内部扩散。3-FMS和5-FMS材料由于具有大量介孔和大孔,因而Ni2+在其颗粒内的扩散到达平衡的状态更快,平衡浓度更高。
2.1.2 吸附热力学性能
在温度和压力相同的情况下,通过改变模拟废水中重金属离子的质量浓度,测定相应的吸附平衡数据,得到吸附等温曲线。利用Langmuir 吸附等温模型对吸附等温曲线进行非线性拟合,探究吸附机制。
图3为4个材料对水中Ni2+的吸附等温线,采用Langmuir吸附模型(式(5))对其进行了线性拟合,结果见图4和表2。

表2 材料对Ni2+吸附的Langmuir拟合参数Table 2 Langmuir isotherms parameters for Ni2+ adsorption
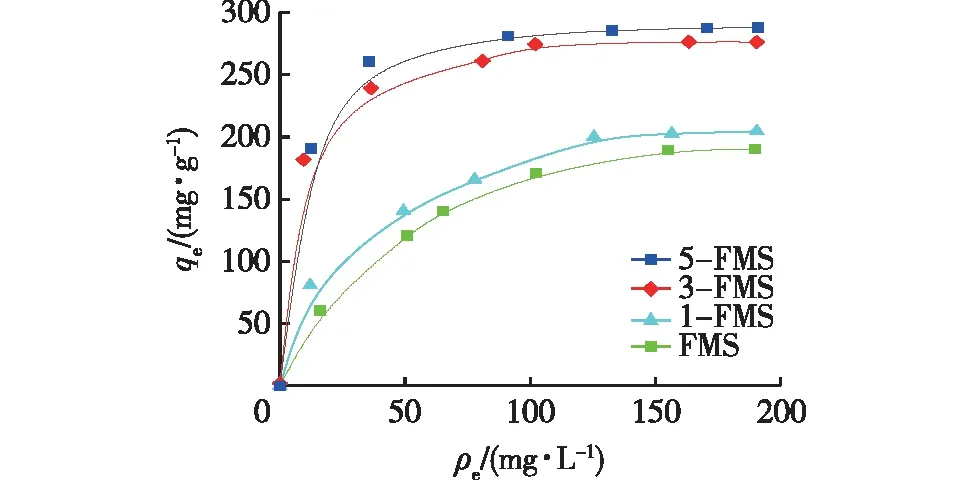
图3 4个材料的Ni2+吸附等温线Fig.3 Adsorption isotherm of Ni2+ for 4 materials
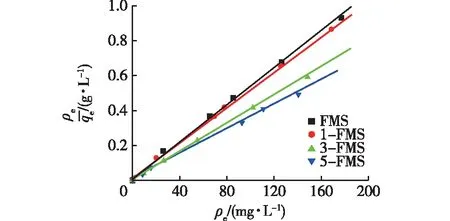
图4 Langmuir模型吸附等温线性拟合Fig.4 Adsorption isothermal linear fitting of Langmuir model
(5)
式中:qm为最大吸附量,mg/g;ρe为达到平衡吸附状态时溶液中Ni2+的平衡质量浓度,mg/L;KL为Langmuir平衡常数,L/mg。
由图4和表2可以看出:4个材料对Ni2+的吸附均符合Langmuir吸附等温模型,说明均为单分子层均匀吸附。随着SDS添加量的增加,所得材料的qm逐渐增大,SDS添加量为5%的5-FMS材料的qm最大,为280.40 mg/g,可见添加一定量SDS的改性花状硅酸镁材料是一种性能优良的高效吸附剂。
4个材料孔分布情况和趋势大体相似[25],均以介孔和大孔为主,尤以3-FMS和5-FMS材料为甚。因大量的介孔和大孔对吸附质在吸附传质阶段十分有利,而且3-FMS和5-FMS材料具有更大的比表面积,有效吸附点位较多,所以Ni2+吸附量也得到了显著提升[27]。为进一步考察材料孔结构与吸附行为间的关系,本文选取3-FMS材料吸附Ni2+后的材料进行了N2吸附-脱附表征,结果如图5所示。由图5可知:吸附Ni2+后,3-FMS材料的比表面积由502降至225 m2/g,孔容从0.63减少到0.25 cm3/g,平均孔径由7.3减小到4.1 nm。因为4个材料的吸附机制均是单分子层化学吸附,吸附材料内外表面上的有效吸附位点有限,当吸附介质完全占据吸附位点时,吸附过程将终止[28]。
2.2 重金属离子吸附机制
花状硅酸镁属于类二维层状结构,其表面有大量活泼的Si—OH,同时,改性花状硅酸镁材料中因加入SDS而含有—SO3H,表面Si—OH和—SO3H均能吸附或解离H+,导致花状硅酸镁表面带电。图6为4个花状硅酸镁材料的Zeta电位测试结果。由图6可见:当pH≈3时,4个材料均处于等电点。因此,当本文吸附实验调节pH≈5时,4个材料表面均带负电,因而花状硅酸镁首先通过静电吸附部分带正电的Ni2+。

图6 4个材料在不同pH下的Zeta电位Fig.6 Zeta potentials at different pH for the four materials
除了静电吸附外,离子交换也是花状硅酸镁吸附Ni2+非常重要的原因[29-30],即以离子键结合在材料表面的离子(如Mg2+)与溶液中的溶质离子(如Ni2+)发生交换。图7为吸附后溶液中Mg2+和Ni2+的质量浓度关系图。由图7可见:溶液中Mg2+浓度随着Ni2+浓度的减小而增大,由此推测Mg2+与Ni2+发生了交换,即离子交换也是改性花状硅酸镁纳米吸附材料的吸附机制之一。吸附Ni2+后虽然增加了水中的Mg2+浓度,但远小于饮用水中对Mg2+的最高限值,因此多级孔硅酸镁材料是绿色、高效的吸附剂。
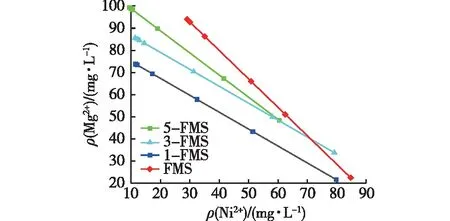
图7 溶液中Mg2+与Ni2+的质量浓度关系Fig.7 Concentration relationship of Mg2+ and Ni2
另外,改性花状硅酸镁结构中含有Si—OH和—SO3H两种酸性基团,它们与水溶液中Ni2+也同样会发生离子交换反应,如式(6)和(7)所示。

(6)

(7)
改性硅酸镁分子式中的其他部分用⦿表示,SDS分子式中的其他部分用❋表示。综上,改性多孔花状硅酸镁材料通过静电吸附、表面金属离子(Mg2+)和酸性基团与溶液中Ni2+的离子交换来达到除去Ni2+的目的。
3 结论
1)随着改性剂SDS添加量的增大,改性硅酸镁材料的孔径和比表面积增大,有利于吸附质Ni2+在孔道内快速传输,同时形成的多级孔结构也有利于增加孔的利用率,因此大大缩短了Ni2+的吸附平衡时间,而且高比表面积也显著提高了Ni2+的吸附量,其中5-FMS材料的平衡吸附量最大,可达231.62 mg/g,理论最大吸附量可达280.40 mg/g。
2)4个材料对Ni2+的吸附行为符合拟二级吸附动力学模型和Langmuir 吸附模型,说明单分子层化学吸附在系列材料对Ni2+的吸附过程中起到重要作用。
3)改性花状硅酸镁纳米吸附材料是通过静电吸附、表面金属离子(Mg2+)和酸性基团与溶液中Ni2+交换来达到除去Ni2+的目的,其吸附过程化学吸附和物理吸附同时存在。

