‘无子瓯柑’E3 泛素连接酶基因CsRNF217 对转基因烟草育性的影响
叶潇铃,赵宇虹,姜 楠,张 敏,张 迟
(1.浙江农林大学 园艺科学学院 农业农村部亚热带果品蔬菜质量安全控制重点实验室,浙江 杭州 311300;2.浙江农林大学 园艺科学学院 浙江省山区农业高效绿色生产协同创新中心,浙江 杭州 311300;3.浙江农林大学 林业与生物技术学院 省部共建亚热带森林培育国家重点实验室,浙江 杭州 311300)
瓯柑Citrussuavissima优良新品种‘无子瓯柑’C.suavissima‘Seedless’是通过芽变选种获得的,其果实无核,遗传性状稳定[1]。与瓯柑相比,两者的花粉量相当,但‘无子瓯柑’花药不易开裂,自然散发的花粉少[2]。形态学和细胞学研究表明:小孢子母细胞减数分裂异常是‘无子瓯柑’雄性不育的重要原因之一[2-3]。瓯柑及‘无子瓯柑’花粉发育早期的花药转录组与蛋白质组关联分析结果表明:差异代谢通路主要富集在苯丙素生物合成、黄酮类化合物生物合成和苯丙氨酸代谢通路[4]。CsRNF217 基因是瓯柑与‘无子瓯柑’在小孢子母细胞时期与苯丙素生物合成途径密切关联的重要基因,与瓯柑相比,该基因在同时期的‘无子瓯柑’中显著上调表达;CsRNF217 基因的氨基酸序列中存在RINGHC_RBR 和IBR 2 个结构域,属于典型的单亚基RING-HC E3 亚家族,定位于细胞核[5]。
泛素化是真核生物中一种高度通用的翻译后修饰,它介导蛋白酶体降解、细胞运输、蛋白质相互作用和细胞蛋白质的功能激活[6-8]。泛素化级联需要3 种不同的酶催化:E1 泛素激活酶、E2 泛素结合酶和E3 泛素连接酶[9]。其中,E3 泛素连接酶具有显著的多样性,它决定了底物的特异性,并作为调节细胞反应的枢纽[10-11]。E3 泛素连接酶分为单亚基和多亚基两类。单亚基组由3 个主要的亚家族组成:RING、HECT 以及U-box 结构域家族[11-13]。CsRNF217 基因即属于单亚基RING 结构域家族。E3 泛素连接酶在植物的生长发育过程中起着关键的作用,包括细胞程序性死亡和抗病防御反应[14]、成花调控[15]、生物[16]和非生物应激反应[14]以及花粉发育[17-19]等。其中,在水稻Oryzasativa[17]、拟南芥Arabidopsis thaliana[18]、白菜Brassicacampestrisssp.chinensis[19]中发现的RING 型E3 泛素连接酶基因DSNP1、DAF、Bra015092 等在花粉发育过程中起重要作用。
本研究以过表达‘无子瓯柑’CsRNF217 的转基因烟草Nicotianatabacum植株为材料,通过对基因表达分析、转基因自交1 代植株(T1)花粉活力、转基因植株自交及与野生型烟草正反交的结实率等参数的测定,分析过表达CsRNF217 对转基因烟草植株育性的影响,为进一步揭示CsRNF217 基因在‘无子瓯柑’雌雄败育过程中的重要作用提供参考。
1 材料与方法
1.1 材料
以野生型烟草(WT)作为对照,采用农杆菌Agrobacteriumtumefaciens介导法获得过表达CaMV35S::CsRNF217 的阳性转基因烟草[5](T0)。将T0自交种子穴盘播种获得转基因烟草自交1 代植株(T1)。采集T1阳性烟草植株6#、35#、63#株系的叶片及含苞待放花蕾的花药,立即置于液氮中速冻并于-80 ℃保存,用于半定量RT-PCR 分析。
1.2 DNA 提取及阳性植株鉴定
采集野生型烟草及T1烟草植株的叶片,采用CTAB 法提取DNA,以pCAMBIA 2300s :CsRNF217 质粒作为阳性对照,ddH2O 为阴性对照,用35S_F 及基因特异引物CsRNF217_R838_S[5](表1)进行PCR 检测筛选阳性植株,PCR 程序为94 ℃,5 min;94 ℃,30 s,55 ℃,30 s,72 ℃,1 min,35 次循环;72 ℃,10 min;12 ℃保存。
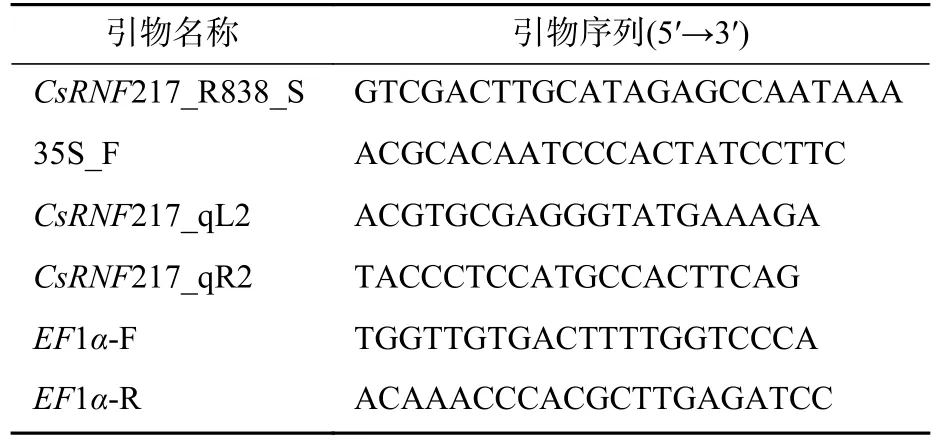
表1 引物信息Table 1 Specific primers used in this study
1.3 花粉活力检测及半定量RT-PCR 分析
于晴天10:00 采集烟草含苞待放的花蕾,采用亚历山大染色法[20]对野生型烟草及经PCR 鉴定的T1阳性植株进行花粉染色活力检测,采用花粉离体培养法[21]对花粉染色活力显著下降的烟草单株进行花粉萌发试验,每个植株随机挑选3 朵花作为生物学重复。花粉粒被染为紫红色的视为有活力的花粉粒,花粉管长度大于或等于花粉粒直径视为萌发。花粉染色活力=着色花粉粒数/视野中的花粉粒总数×100%,花粉萌发率=萌发花粉粒数/视野中的花粉粒总数×100%。
使用MiniBEST Plant RNA Extraction Kit (TaKaRa,日本)试剂盒,提取野生型烟草及花粉活力显著下降的T1烟草阳性植株花药RNA,采用EASYScript one-step gDNA removal and cDNA synthesis supermix (TransGen Biotech code#AE311- 03)试剂盒进行cDNA 合成,使用CsRNF217 基因对引物和烟草内参基因EF1α特异引物(表1)进行半定量RT-PCR 分析,程序为94 ℃,5 min;94 ℃,30 s,55 ℃,30 s,72 ℃,1 min,29 次循环;72 ℃,10 min;12 ℃保存。
1.4 野生型烟草及转基因T1 烟草植株杂交授粉
于晴天10:00 收集野生型和T1已开花,但未散粉植株的花药于离心管,4 ℃干燥保存备用。于傍晚用干净的小镊子摘去即将开放花蕾的花瓣和雄蕊。次日10:00 蘸取花粉轻点已分泌黏液的柱头,套袋,每个植株进行3 朵花的正反交重复,3 d 后摘去袋子。正反交组合配置中,正交授粉以转基因株系为父本,野生型为母本;反交授粉以野生型为父本,转基因株系为母本。种子成熟时统计每个单株采收的蒴果数,测量蒴果横径、纵径及种子总质量。
1.5 数据处理与统计分析
采用SPSS 软件对种子萌发率、花粉染色活力、花粉离体萌发率、蒴果横纵径及种子数量等进行了单因素方差分析(one-way ANOVA,LSD)。
2 结果与分析
2.1 T1 烟草植株阳性检测
T0烟草种子穴盘播种共获得137 个单株,其中6#株系16 株,35#株系80 株,63#株系41 株。以野生型及T0种子播种获得的烟草叶片DNA 为模板,经PCR 检测,共获得68 株阳性植株(表2)。其中,6#株系10 株,35#株系33 株,63#株系25 株,阳性率分别为62.5%、41.2%、61.5%。
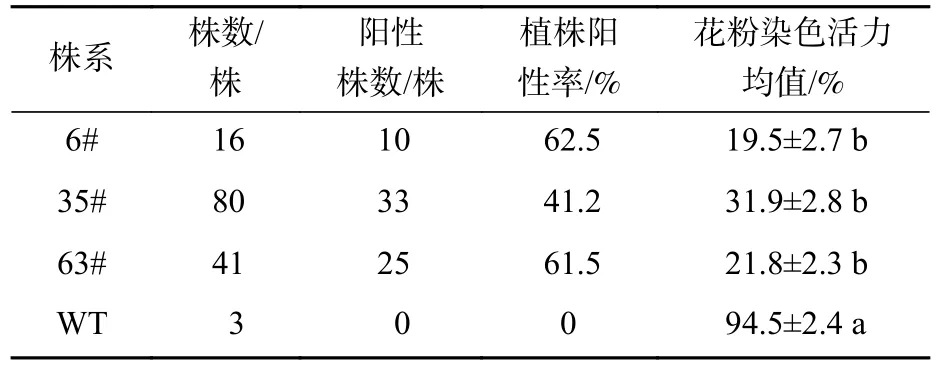
表2 野生型及T1 烟草植株阳性率与花粉染色活力Table 2 Positive rate and pollen viability of wild type and T1 tobacco plants
2.2 花粉活力及半定量RT-PCR 检测结果
T1阳性烟草植株花粉的散粉量与野生型存在差异(图1)。野生型植株花药开裂后,散粉量多,可见大量花粉散布于花瓣及柱头;T1阳性烟草植株花药裂开后,散粉量少,几乎无可见花粉散出。经染色法和花粉离体萌发培养(图2):T1阳性烟草植株花粉染色活力显著低于野生型植株(图3,P<0.05)。有活力的花粉粒经亚历山大染色后呈紫红色,无活力的花粉粒呈黄褐色。野生型植株经亚历山大染色后花粉粒大多呈紫红色(94.5%),阳性植株呈紫红色的花粉粒数量显著少于野生型(图3,P<0.05)。其中6#株系的14 号单株(6#14)、35#株系的4 号单株(35#4)、63#株系的4 号单株(63#4)的花粉经亚历山大染色后着色率最低,分别为9.6%、12.0%、9.7%。有活力的花粉粒能在适宜的离体条件下萌发,T1阳性植株花粉粒的萌发率显著低于野生型植株(60.3%)。其中6#株系的9 号单株(6#9)、6#株系的14 号单株(6#14)、63#株系的4 号单株(63#4)的花粉粒萌发率在各株系中最低,分别为30.6%、29.0%、33.4%。半定量RT-PCR 分析显示(图4):CsRNF217 基因在过表达的各株系中均能表达,其中,外源基因在63#株系各单株花药中的表达量最高。

图1 野生型与T1 阳性植株成熟花药形态及散粉情况Figure 1 Anther morphology and pollen release of wild type and T1 positive plants
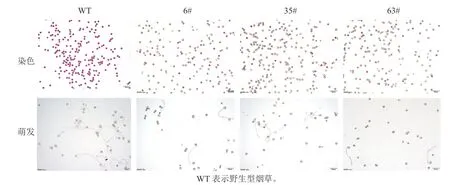
图2 野生型及T1 阳性植株的花粉活力Figure 2 Pollen viability of wild type and T1 positive plants

图4 野生型及T1 阳性植株半定量RT-PCR 分析Figure 4 Semi-quantitative RT-PCR of wild type and T1 positive plants
2.3 野生型烟草及转基因T1 植株杂交授粉结果
对花粉染色活力、萌发率都显著低于野生型的T1转基因阳性单株进行授粉(表3,图5)表明:自交和与野生型进行正反交的各授粉组合均能结实,但蒴果大小及种子数量存在较大差异。蒴果横径的比较结果显示:转基因63#株系自交、与野生型进行正反交的蒴果横径均显著小于野生型自交的蒴果(P<0.05);35#株系自交蒴果的横径显著小于野生型自交(P<0.05)。蒴果纵径的比较结果显示:转基因63#株系自交和与野生型反交的蒴果纵径均显著小于野生型自交(P<0.05),其余组合与野生型自交无显著差异。根据烟草原始种的种子千粒重(0.087 g)[22],计算每个株系的单果种子数量。阳性株系自交、与野生型正反交获得的种子数量都显著低于野生型自交种子数(P<0.05),但转基因株系之间无显著差异。

图5 野生型与T1 阳性植株自交及与野生型正反交授粉后的蒴果及种子Figure 5 Capsules and seeds of wild type and T1 positive plants after self-crossing and cross-pollination with wild type
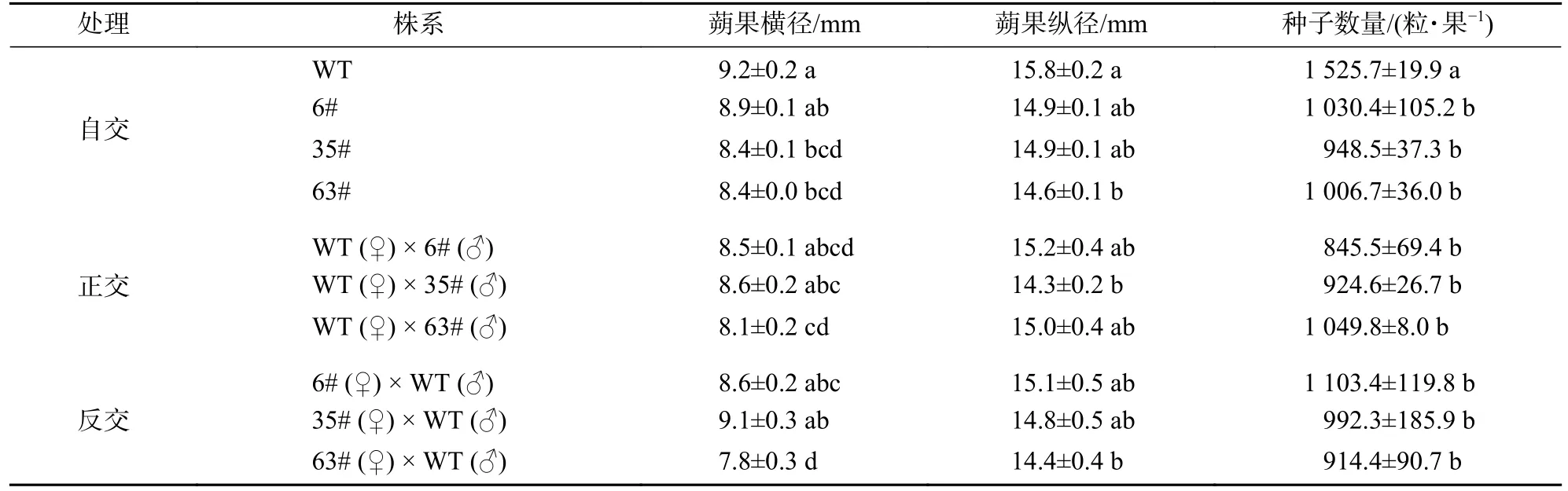
表3 野生型及阳性株系自交及杂交试验的蒴果大小和种子数量Table 3 Capsule and seed number in selfing and hybridization test
3 讨论
本研究表明:过表达CsRNF217 的烟草植株在花粉染色活力、花粉萌发率、蒴果大小及种子数量上均显著低于野生型,说明过表达CsRNF217 降低了转基因烟草的小孢子育性,甚至对胚囊育性也存在一定的影响。
近年来的研究表明:RING 型E3 泛素连接酶基因参与了植物花粉发育[19]、花药开裂[18]、胚囊发育[17]等生命过程。水稻中的RING 型E3 泛素连接酶DSNP1 与水稻减数分裂过程中的联会复合体组装和同源重组关系密切,其突变体dsnp1 中形成的稳定同源配对和重组交叉严重减少,并最终形成活性较低的花粉[17]。然而,白菜中过表达E3 泛素连接酶基因Bra015092,也降低了转基因白菜的花粉染色活力和萌发率,并导致了花粉外部形态的畸形[19]。前期研究表明:‘无子瓯柑’成熟花粉的染色活力和离体萌发率均显著低于有籽瓯柑,其小孢子母细胞减数分裂异常[2-3],CsRNF217 的表达在小孢子发育早期显著上调[5]。本研究中过表达CsRNF217 的烟草花粉离体萌发率为野生型的一半,花粉染色活力则更低。推测CsRNF217 基因可能通过负调控小孢子母细胞的减数分裂过程参与‘无子瓯柑’的花粉发育。拟南芥E3 泛素连接酶基因DAF在雄蕊中特异表达,并通过正向调控茉莉酸生物合成途径来促进花药开裂,通过干涉实验抑制其表达的植株则表现为雄性不育[18]。‘无子瓯柑’的花药自然开裂难、散粉量低[2-3],实时定量PCR 结果显示:CsRNF217 基因在雄蕊的表达丰度显著高于其他花器官[5]。本研究中,过表达CsRNF217 的转基因烟草也表现出自然散粉较弱的特性,推测CsRNF217 可能参与了花药开裂的调控。
以野生型花粉对水稻不育突变体dsnp1 进行授粉,突变体不能结实,表明该突变体既是雄性不育的,也表现出雌性不育[17],说明该RING 型E3 泛素连接酶DSNP1 对水稻的雌雄育性都有影响。本研究表明:转基因烟草不仅花粉活力显著下降,其种子数量也显著减少,说明CsRNF217 的超量表达在负调控花粉育性的同时,对胚囊的育性也存在一定的调控作用。在生产实践中,‘无子瓯柑’在同其他有籽柑橘品种混栽时也表现无籽,说明胚囊败育是‘无子瓯柑’果实无核的重要原因,因此CsRNF217 对‘无子瓯柑’胚囊育性的影响值得进一步研究。
4 结论
E3 泛素连接酶基因CsRNF217 对转基因烟草的育性存在显著影响,过表达‘无子瓯柑’CsRNF217 的T1烟草阳性植株雌雄育性均显著下降,推测CsRNF217 对‘无子瓯柑’的育性存在负调控作用。

