痹祺胶囊治疗膝骨关节炎合并骨髓水肿的临床疗效与影像学评价
梁超伦 ,高 明,肖俊强,李 兴 ,胡志锋,麦秀钧,陈耿鑫,黄永明 *
1.广州中医药大学第二附属医院 骨科,广东 广州 510120
2.广州中医药大学第二临床医学院,广东 广州 510000
膝骨关节炎(knee osteoarthritis,KOA)是一种常见的关节退行性疾病,好发于中老年人,容易造成下肢功能障碍甚至残疾[1]。随着老龄化与肥胖问题的日益严峻,KOA 的发病率逐年上升[2]。疼痛是KOA 最典型的症状之一,其机制包括炎症反应、软骨及下骨损伤、痛觉敏化等[3]。其中炎症一直被视作疼痛产生最重要的病因,因此药物治疗以抗炎镇痛为主[4]。近年来,有研究表明骨髓水肿(bone marrow edema,BME)与疼痛紧密相关,这种疼痛往往骤发骤止,随体位改变而变化,且程度剧烈[5-6]。然而,针对BME 的治疗尚未形成共识,相关指南仍建议服用抗炎镇痛药缓解症状,且效果往往不佳。此外,BME 的存在使得许多轻中度KOA 的患者表现出较为剧烈的疼痛与功能障碍[7-8]。这些都表明临床需要针对性的治疗方法。中医认为KOA 属“骨痹”,是由肝肾亏虚、风寒湿痹阻经络引发的本虚标实之证,治法为补益肝肾、行气活血、祛邪通络。由于KOA 合并BME 的患者发作较急,疼痛剧烈,结合其水肿样病变的表现,考虑标实为主,为湿邪痹阻、气血不行,治疗当以活血利湿为主,孟东方等[9]研究也证实了这一观点。中成药痹祺胶囊具有益气养血、祛风除湿、活血止痛的功效,能有效缓解KOA 带来的疼痛,然而其能否治疗BME 尚未有定论。因此,本研究通过随机对照的方法,基于多种评价指标探讨痹祺胶囊治疗KOA 合并BME 的效果,为其临床应用提供参考。
1 资料与方法
1.1 一般资料
选取2022 年10 月—2023 年4 月在广州中医药大学第二附属医院大学城分院骨科门诊就诊的90例患者作为研究对象,使用随机数字法将所有患者随机分为试验组与对照组(两组各45 例)。本研究已获得广州中医药大学第二附属医院伦理委员会的批准(伦理号YF2022-389-01)及与中国临床试验注册中心的批准(注册号ChiCTR2300076690)。
1.2 随机分组方法
使用Excel 软件进行随机分组。将纳入研究的病例编号,通过Excel 表格填充90 个随机数,并在随机数旁分别对应标注“A”和“B”字母各45 个,其中字母A 代表试验组,字母B 代表对照组。将随机数与字母对应关联,并由小到大进行排列,形成了试验组与对照组的随机排列组合。
1.3 纳入与排除标准
1.3.1 纳入标准 ①KOA 西医诊断标准符合《骨关节炎诊疗指南(2021 年版)》,且Kellgren-Lawrence(K/L)分期不超过III 期[10];中医“骨痹”的诊断标准符合《中医内科病证诊断疗效标准》[11]。②BME的诊断符合金标准[12],即膝关节磁共振检查(magnetic resonance imaging,MRI)显示明确有BME征象:T2 像中股骨内外侧髁或胫骨平台下方出现弥漫性高信号,沿骨骼的轮廓边缘分布,区域形状不规则、信号改变不均匀,边界模糊,无明显的骨皮质断裂[13];中医辨证型为肝肾亏虚、湿邪痹阻。③患者计划在2 月内不执行手术治疗。④病历资料完善。⑤患者为中老年患者(50~75 岁)。⑥自愿参加研究,并签署知情同意书。
1.3.2 排除标准 ①诊断为类风湿关节炎、夏科氏关节病等其他关节病;②因创伤、感染化脓等各种病理因素引起的继发性KOA 者;③有药物过敏史、不耐受或拒绝服药者;④膝关节畸形或骨缺损者;⑤有精神疾病者。
1.3.3 剔除与脱落标准 ①不配合治疗者;②中途失访者(未能按试验方案每隔2 周前来随访并完成所有观察指标的项目);③试验过程中患者接受的其他治疗对试验用药造成影响;④违反纳入标准进入试验者;⑤分组、干预过程中违背试验方案者;⑥患者在参与课题的过程中检查出其他疾病,不能继续参与者;⑦患者要求停止或退出试验。
1.4 干预措施
试验组患者口服痹祺胶囊(天津达仁堂京万红药业有限公司生产,国药准字Z10910026,规格每粒0.3 g,生产批号311965)进行治疗,每次4 粒,每日3 次;对照组患者口服依托考昔片(安康信,杭州默沙东制药有限公司生产,国药准字J20130158,规格每片0.06 g,生产批号XO13435)进行治疗,每次1 片,每日1 次。治疗共持续8 周,患者每隔2 周复诊并记录相关数据。
1.5 观察指标
1.5.1 临床症状指标(主要评价指标) 临床发现大部分合并BME 的KOA 患者在蹲起时疼痛明显加重,因此本研究使用视觉模拟量表(visual analogue scale,VAS)评分评估患者蹲起时的疼痛程度。0 分表示无痛;1~3 分表示轻度疼痛;4~6 分表示中度疼痛;7~10 分表示重度疼痛[14]。膝关节功能则采用西安大略和麦克马斯特大学骨关节炎指数( Western Ontario and McMaster Universities osteoarthritis index,WOMAC)进行评分,该评分量表共涉及疼痛、僵硬与功能3 个方面共24 项,总分为96 分,分数越高,功能越差[15]。
1.5.2 影像学指标 核磁共振设备为Magnetom Prisma 3.0T(西门子公司),检查序列T2W1 TSE,参数设置:Slices 为24,Slice thickness 为3 mm,FOV read 为160 mm,FOV phase 为100%,TR 为3700 ms,TE 为49 ms,脂肪抑制类型为频率选择压脂。首先,使用全膝关节磁共振成像评分(wholeorgan magnetic resonance imaging score,WORMS)评估BME 的严重程度:在MRI T2 像中将患者的膝关节分为15 个区域(图1),根据每个区域被高信号所占的比例进行评分(不存在BME 为0 分,信号占比<25%为1 分,信号占比25%~50%为2分,信号占比>50%为3 分),最后将总分合并统计,分数越高,BME 越严重[16]。其次,为了更精准地评估水肿体积在治疗过程中的变化,使用IKT-Snap软件对BME 体积占比进行测量:将总体测量范围设定与WORMS 评分的区域相同,利用软件的自动分割功能构建出骨髓腔的模型并进行体积测量,随后用手动工具标记感兴趣区域(region of interest,ROI),最终计算出体积的占比(ROI 与骨髓腔体积的比值)。在后续的研究中,将对BME体积比与VAS评分进行相关性分析。在软件分割中,为避免自动分割功能产生的误差,分割后由试验组内经验丰富的骨科医生进行人工纠正[17]。

图1 WORMS 评分将膝关节按照前后、左右的分区Fig.1 Knee joint divided into zones according to front,back, left, and right in WORMS score
1.5.3 实验室检查指标 使用外周血炎症指标外周血中性粒细胞淋巴细胞计数比(neutrophil lymphocyte ratio,NLR)与淋巴细胞单核细胞计数比值(lymphocyte monocyte ratio,LMR)对患者膝关节炎症反应程度进行评价,NLR 为外周血中性粒细胞计数与淋巴细胞计数的比值,LMR 为淋巴细胞计数与单核细胞计数的比值。其中NLR 指标与炎症反应呈正相关,随着炎症反应程度的增加而增加,LMR 指标与炎症反应呈负相关,随着炎症反应程度的增加而减少[18]。
1.5.4 不良反应 记录患者治疗期间出现的不良反应情况。
1.5.5 指标观察的获取 临床症状、影像学指标和实验室检查指标的获取皆由同一医师负责。其中,临床症状在每次复诊时采集,影像学指标与实验室检查指标分别在首次服药前与末次服药后采集。
1.6 疗效评价标准
以患者蹲起时的疼痛VAS 评分与WOMAC 评分之和(总分106)作为疗效评价标准。①治愈:患者在经过治疗后,症状完全消失;②显效:患者经过治疗后,总分下降幅度大于50%;③有效:患者在经过治疗后,总分下降幅度达到了25%~50%;④无效:患者在经过治疗后,总分下降幅度不到25%。
总有效率=(治愈例数+显效例数+有效例数)/总例数
1.7 统计学方法
采用SPSS 25.0 统计软件进行数据分析。计量资料经Shapiro-Wilktest 正态性检验后符合正态分布,用±s进行统计描述,组内、组间比较采用t检验、配对t检验。多时间点的计量资料比较采用重复测量数据的方差分析法。BME 体积占比为连续变量,采用Pearson 相关分析对其与VAS 评分之间的相关性进行分析。计数资料用百分比进行统计描述,采用χ2检验进行分析。检验水准取α=0.05;当P<0.05时,差异有统计学意义。
2 结果
2.1 病例纳入情况与基线资料
本研究共纳入90 例患者,试验组与对照组各45 例。试验组脱落6 例(1 例患者中途失访,1 例患者查出其他疾病、4 例患者因不良反应放弃治疗),对照组脱落4 例(1 例患者中途失访,3 例患者因不良反应放弃治疗),最终共80 例患者(试验组39 例,对照组41 例)接受了完整的治疗(图2)。患者的基线资料见表1。两组患者在性别、年龄、体质量指数方面无统计学差异,具有可比性。

表1 两组患者的基线资料对比Table 1 Comparison on baseline data of two groups

图2 患者筛选流程Fig.2 Patient screening process
2.2 两组患者的临床症状指标比较
2.2.1 VAS 评分 治疗前,两组VAS 评分无显著性差异。治疗8 周后,与治疗前比较,两组各随访点VAS 评分差异均具有统计学意义(P<0.05);从第6 周开始,试验组的VAS 评分明显低于对照组(P<0.05),见表2。
表2 两组VAS 评分的比较 (±s)Table 2 Comparison on VAS score between two groups (±s )

表2 两组VAS 评分的比较 (±s)Table 2 Comparison on VAS score between two groups (±s )
与同组治疗前比较:*P<0.05;与对照组治疗同期比较:#P<0.05*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after same period of treatment
组别 n/例 VAS 评分治疗前 治疗2 周 治疗4 周 治疗6 周 治疗8 周对照 41 4.91±1.85 4.01±1.53 3.49±1.91* 3.35±1.57* 3.18±1.51*试验 39 5.09±2.41 3.82±2.12 3.24±1.33* 2.49±1.43*# 2.01±1.44*#
2.2.2 WOMAC 评分 治疗前,两组WOMAC 评分无统计学差异。治疗8 周后,与治疗前比较,两组患者的WOMAC 评分均出现了明显的下降(P<0.05);从第6 周开始,试验组患者的WOMAC 评分均明显低于对照组(P<0.05),见表3。
表3 两组WOMAC 评分比较 (±s)Table 3 Comparison on WOMAC score between two groups (±s )
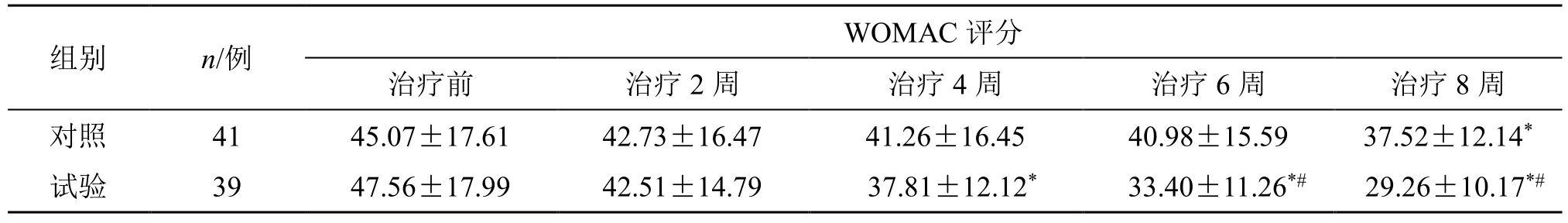
表3 两组WOMAC 评分比较 (±s)Table 3 Comparison on WOMAC score between two groups (±s )
与同组治疗前比较:*P<0.05;与对照组治疗同期比较:#P<0.05*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after same period of treatment
组别 n/例 WOMAC 评分治疗前 治疗2 周 治疗4 周 治疗6 周 治疗8 周对照 41 45.07±17.61 42.73±16.47 41.26±16.45 40.98±15.59 37.52±12.14*试验 39 47.56±17.99 42.51±14.79 37.81±12.12* 33.40±11.26*# 29.26±10.17*#
2.3 两组患者的影像学指标比较
2.3.1 BME 体积占比和WORMS 评分 治疗前两组患者的BME 体积占比与WORMS 评分均无显著性差异。治疗8 周后,与治疗前比较,试验组的BME体积占比明显减小,WORMS 评分明显下降(P<0.05);而对照组BME 体积占比与WORMS 评分均无明显变化(P>0.05)。治疗后,试验组BME 体积占比与WORMS 评分与对照组比较得到明显改善,见表4。
表4 两组BME 体积占比与WORMS 评分的比较 (±s)Table 4 Comparison on BME volume proportion and WORMS score between two groups (±s )
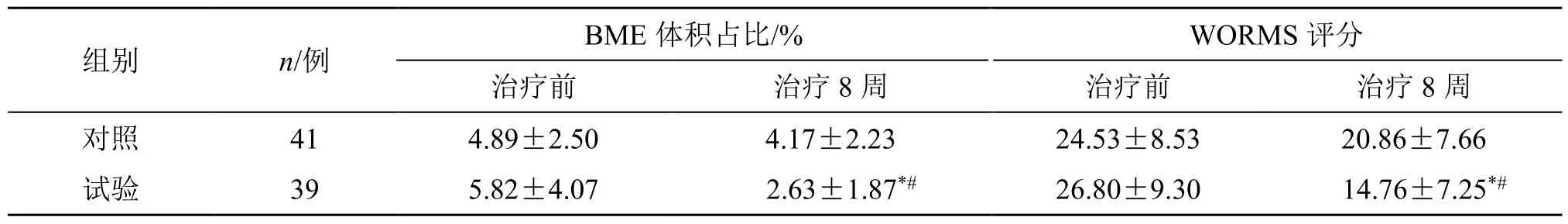
表4 两组BME 体积占比与WORMS 评分的比较 (±s)Table 4 Comparison on BME volume proportion and WORMS score between two groups (±s )
与同组治疗前比较:*P<0.05;与对照组治疗8 周比较:#P<0.05*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after treatment eight weeks
组别 n/例 BME 体积占比/% WORMS 评分治疗前 治疗8 周 治疗前 治疗8 周对照 41 4.89±2.50 4.17±2.23 24.53±8.53 20.86±7.66试验 39 5.82±4.07 2.63±1.87*# 26.80±9.30 14.76±7.25*#
2.3.2 BME 体积与疼痛的相关性分析 结果显示随着BME 体积的增加,VAS 评分明显增加,二者之间具有相关性(r=0.731 8,P<0.05),见图3。
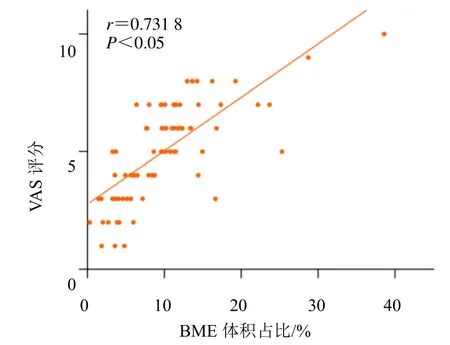
图3 BME 体积占比与VAS 评分的相关性Fig.3 Correlation between BME volume proportion and VAS score
2.4 两组患者的实验室检查指标NLR、LMR 比较
治疗前两组患者外周血NLR、LMR 水平无统计学。治疗后,两组患者外周血NLR 水平明显下降(P<0.05),LMR 水平明显升高(P<0.05),而试验组的NLR 水平明显高于对照组,LMR 水平明显低于对照组(P<0.05),见表5。表明两组的炎症水平均得到了抑制,但依托考昔的抑制能力更强。
表5 两组外周血NLR、LMR 的比较 (±s)Table 5 Comparison on NLR and LMR in peripheral blood between two groups (±s )
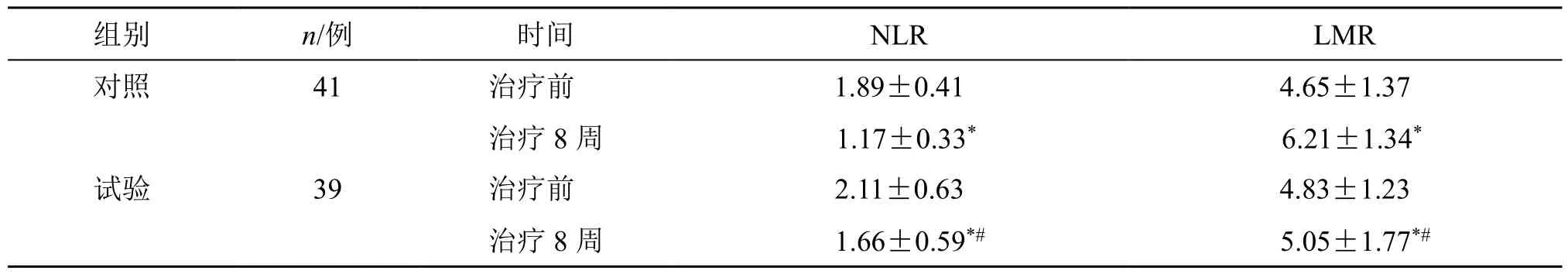
表5 两组外周血NLR、LMR 的比较 (±s)Table 5 Comparison on NLR and LMR in peripheral blood between two groups (±s )
与同组治疗前比较:*P<0.05;与对照组治疗8 周比较:#P<0.05*P < 0.05 vs same group before treatment; #P < 0.05 vs control group after treatment eight weeks
组别 n/例 时间 NLR LMR对照 41 治疗前 1.89±0.41 4.65±1.37治疗8 周 1.17±0.33* 6.21±1.34*试验 39 治疗前 2.11±0.63 4.83±1.23治疗8 周 1.66±0.59*# 5.05±1.77*#
2.5 临床疗效
经过8周治疗,对照组临床总有效率为80.49%,试验组临床总有效率为87.18%,两组之间无明显差异,而试验组的显效率明显高于对照组(P<0.05)。见表6。

表6 两组患者治疗效果比较Table 6 Comparison on treatment effect between two groups
2.6 不良反应情况
治疗期间,试验组有4 人出现过敏样不良反应,对照组有3 人出现胃肠不适,均放弃治疗。对于不良反应的处理方法为远离过敏原,对于胃肠不适的处理方法为服用奥美拉唑并停止使用依托考昔两组患者发生不良反应的发生无显著性差异。
3 讨论
疼痛是KOA 患者能感受到的首要症状,严重阻碍患者的功能。炎症因子被认为是造成KOA 疼痛的主要因素,随着研究的深入,人们逐渐发现了多种与疼痛可能相关的因素,如BME、髓内血管舒缩功能异常、骨代谢异常、痛觉敏化等[19]。目前,BME 已被确认与疼痛高度相关,且大量存在于KOA 中[7,20]。目前BME 的发生机制尚未明确,研究表明其可能与软骨下骨骨质流失导致的骨小梁微骨折有关,许多研究也证明了双磷酸盐、降钙素等治疗骨质疏松药物对BME 的作用[21-23]。然而,目前尚无BME 的相关指南,KOA 相关指南中也仅将BME 视作KOA 进程中的症状之一,并未提出针对性的方案,建议休息、使用抗炎镇痛药物应对疼痛[4]。但临床实践表明发现抗炎镇痛药物并不能从根本上减少BME,患者需要针对性的治疗方案,在这方面中医药有巨大的潜力。
中医认为KOA 属“痹症”。早在《黄帝内经》中便有“风寒湿三气杂至,合而为痹也。其风气胜者为行痹,寒气胜者为痛痹,湿气胜者为著痹也”的说法。因此,中医将KOA 的发病外因归结于外感风、寒、湿邪;同时,《张氏医通》也云:“膝痛无有不因肝肾虚者”。说明KOA 的内因为肝肾亏虚,筋骨不用,日久则下肢痿废。因此,KOA 为本虚标实之证,以肝肾亏虚为本,外邪侵袭、气滞血瘀为标。对于BME 的病机与疗法,中医尚无明确认识,仅将其视作痹症的症状之一,通过外在表现进行辨证论治。疼痛与水肿是BME 的主要症状,因此BME可考虑为湿邪痹阻经络,不通则痛,因此治法当重在利湿通痹。有研究也证明了祛除水湿有利于治疗KOA 中的BME[24-25]。
痹祺胶囊来源于华佗验方“一粒仙丹”,具有消肿除湿、活血化瘀、通络止痛的功效。全方以马钱子为君,其力猛而擅通行络,祛除潜藏的风湿之邪,方中又暗含四君子,健脾益气、利湿消肿,再加丹参益气养血;此外,牛膝、三七、地龙、川芎皆入肝经,能补益肝肾、活血化瘀、通络止痛[26]。目前,痹祺胶囊已广泛应用于治疗KOA、类风湿性关节炎等多种炎症。许多研究都表明痹祺胶囊能有效降低患者的疼痛,改善膝关节功能[27-28]。此外,动物实验也证明痹祺胶囊能抑制炎性细胞的浸润、滑膜的增生和关节软骨的破坏,降低炎症因子水平[29-30]。
本研究结果表明痹祺胶囊与依托考昔均能在短期内有效减轻KOA 合并BME 患者的疼痛并改善其膝关节功能。然而在组间对比中,痹祺胶囊的显效率明显优于依托考昔。随后,关于BME 评分与体积的影像学的研究结果也显示试验组患者的BME 体积占比、WORMS 评分在治疗8 周后明显下降,而对照组患者无显著变化;此时试验组的BME体积占比明显小于对照组。这意味痹祺胶囊对合并有BME 的KOA 患者的疗效短期内优于依托考昔,从药物的机制上考虑,这种优势可能是通过缩小BME 实现的。本研究的结果表明BME 体积占比与疼痛相关,而目前研究也表明BME 体积的减小与患者疼痛的改善是同时发生的,这印证了本试验结果[9,31]。为了进一步验证这个结论,本研究对疼痛的另一重要影响因素——炎症反应进行了考察。衡量炎症反应程度的指标主要为血清白细胞介素-1(interleukin-1,IL-1)、IL-6、基质金属蛋白酶-13(matrix metalloproteinase-13,MMP-13)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子,然而这些指标的检测并没有大规模应用于临床,因此使用外周血炎症指标NLR 与LMR 作为判断炎症反应程度的标准。已有研究表明外周血中炎症指标与KOA 的严重程度相关,其中NLR 与炎症反应的程度呈正比,LMR 呈反比[18]。本研究结果显示痹祺胶囊虽然同样能减轻炎症反应,但短期内抗炎作用弱于依托考昔。因此,痹祺胶囊的疗效优势来源于针对BME 的治疗。由此可见,痹祺胶囊主要通过减少BME 体积有效治疗KOA 合并BME,减少患者疼痛,改善患者膝关节功能水平,与传统抗炎药物相比针对性更强,且无明显不良反应[32]。
本研究也存在许多不足之处,随机对照试验的样本量偏小,治疗周期较短,只能对短期内的疗效进行评估。同时,本研究采用了外周血炎症指标作为评价炎症反应的指标,尽管已有研究证明其与KOA 的分期、分型均具有相关性,但本研究缺乏对血清炎症因子的检测,因此可能出现误差。此外,KOA 患者的疼痛来源较为复杂,本研究仅对主要因素BME 与炎症因子进行研究,可能会导致结论偏倚。未来将在此基础上,使用多中心、大样本、高质量的研究方案进行验证。本研究结果表明痹祺胶囊通过针对性减小BME 的体积来减少KOA 伴BME 的患者的疼痛及改善其膝关节功能。
利益冲突 所有作者均声明不存在利益冲突

