痹祺胶囊治疗类风湿性关节炎的药效研究及网络机制预测
李 新 ,卜睿臻,王玉丽 ,李虎玲 ,韩彦琪 ,王 磊,张星艳 ,赵文静 ,许 浚 ,张铁军 *,刘昌孝 *
1.天津药物研究院 天津市中药质量标志物重点实验室,天津 300462
2.天津药物研究院 中药现代制剂与质量控制技术国家地方联合工程实验室,天津 300462
3.天津药物研究院 药物成药性评价与系统转化全国重点实验室,天津 300462
4.天津达仁堂京万红药业有限公司,天津 300112
5.津药达仁堂集团股份有限公司,天津 300193
类风湿性关节炎(rheumatoid arthritis,RA)是以关节滑膜慢性炎症为主的自身免疫性疾病[1],以关节肿胀、关节压痛和持续性滑膜炎为特征。研究发现,免疫细胞的激活、炎症因子的大量释放、氧化应激等与RA 的发病息息相关,并且在这些活性物质的作用下进一步加快患者病情的进展[2]。RA 没有永久的治疗方法,目前RA 的治疗用药主要依赖于非甾体抗炎药、糖皮质激素、生物制剂等,但内科治疗方法起效缓慢、久服对肝、肾及血液系统损害较大[3]。终末期RA 下只能采用外科的部分或全部关节置换等关节整形手术[4],然而手术前的评估较为严苛,术后可能存在潜在的远期并发症,如感染、磨损、骨溶解等[5]。RA 在中医中称为“痹证”,中医药治疗RA 在改善临床症状、药物不良反应小等方面具有独特的优势。痹祺胶囊是由马钱子、党参、白术、丹参、茯苓、牛膝、地龙、川芎、三七和甘草10 味药材组成的中药复方制剂,具有益气养血、祛风除湿、活血止痛的作用,临床上用于气血不足、风湿瘀阻、肌肉关节酸痛、关节肿大、僵硬变形或肌肉萎缩、气短乏力;风湿、RA,腰肌劳损,软组织损伤属上述证候者[6-7]。痹祺胶囊在临床上表现出较好的抗关节炎作用,研究发现,痹祺胶囊可通过抑制骨保护蛋白(osteoprotegerin,OPG)/核因子-κB 受体激活子(receptor activator of nuclear factor-κB,RANK)/核因子-κB 受体活化因子配基(receptor activator of nuclear factor-κB ligand,RANKL)、Janus 激酶(Janus kinase,JAK)/信号转导子和转录激活子(signal transducer and activators of transcription,STATs)信号通路降低大鼠滑膜增生,减轻关节软骨及骨破坏[8-9]。本研究采用胶原诱导的关节炎(collagen-induced arthritis,CIA)大鼠模型及网络药理学方法[10]研究痹祺胶囊在整体动物模型下对RA 大鼠的药效作用及可能机制。
1 材料
1.1 动物
SPF 级雄性SD 大鼠120 只,体质量110~130 g,由北京斯贝福生物技术有限公司提供,许可证号SCXK(京)2019-0010。饲养在天津天诚新药评价有限公司实验动物屏障系统[合格证SYXK(津)2021-0008],温度、湿度、换气次数由中央系统自动控制,温度维持在20~26 ℃,相对湿度维持在40%~70%,通风次数为10~15 次/h 全新风,光照为12 h 明、12 h 暗。自由摄食饮水。实验动物的使用经天津药物研究院新药评价有限公司实验动物伦理委员会批准(批准号No.2021031803)。
1.2 药品与试剂
痹祺胶囊(0.3 g/粒,批号311574)由天津达仁堂京万红药业有限公司提供;醋酸泼尼松片(5 mg/片,批号21020162)购自新乡市常乐制药有限责任公司;雷公藤总苷片(10 mg/片,批号180502)购自上海复旦复华药业有限公司;鸡II 型胶原蛋白购自美国 Chondrex 公司;大鼠白细胞介素-1β(interleukin-1β,IL-1β)ELISA 试剂盒(批号P261453)、肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)ELISA 试剂盒(批号P254162)购自美国R&D Systems 公司;大鼠IL-17 ELISA 试剂盒(批号2104251)购自上海西唐生物科技有限公司;大鼠IL-10 ELISA 试剂盒(批号22J225)购自ExCell Bio 公司;类风湿因子(rheumatoid factor,RF)检测试剂盒(批号20210407)购自南京建成生物工程研究所;大鼠γ-干扰素(interferon-γ,IFN-γ)ELISA试剂盒(批号B303835)购自Biolegend 公司。
1.3 仪器
YLS-7B 型足肿仪(山东省医学科学院设备站);SpectraMax M5 型酶标仪(美国Molecular Devices 公司);ASP200S 型自动真空组织脱水机;EG1150H 型自动生物组织包埋机、RM2255 型切片机(德国Leica公司);Ci-L 型显微镜(日本Nikon 公司)。
2 方法
2.1 分组、造模与给药
2.1.1 配制II 型胶原混悬乳剂 取0.1 mol/L 冰醋酸溶液10 mL 与鸡II 型胶原20 mg,于棕色试剂瓶内,冰浴下充分混合均匀,直至白色絮状鸡II 型胶原完全溶于冰醋酸内,并于实验前加入弗氏完全佐剂并充分乳化,使鸡II 型胶原质量浓度为1 mg/mL。
2.1.2 CIA 大鼠模型制备 120 只SD 大鼠适应期喂养1 周,随机取10 只作为对照组,其余所有大鼠均进行II 型胶原蛋白造模。于左侧足跎肉垫处皮内注射鸡II 型胶原蛋白(0.1 mL/只),注射后注射点按压防液体外流。对照组大鼠以同样方式注射等体积生理盐水注射液。在第1 次注射免疫的第7 天,在背部注射相同乳剂0.1 mL 进行加强免疫,密切观察大鼠状态至造模15 d 筛选双侧关节出现炎症肿胀的动物进行分组。
2.1.3 给药 选取造模成功大鼠重新标记后用随机数字法分为模型组、泼尼松(10 mg/kg)组、雷公藤总苷(10 mg/kg)组和痹祺胶囊各剂量(0.05、0.10、0.20、0.40 g/kg)组。各给药组ig 相应药物,对照组和模型组ig 0.5%羧甲基纤维素钠溶液,1 次/d,连续15 d,期间给予SPF 级动物常规饲料及饮水。
2.2 指标观察及检测
2.2.1 体质量测定 给药第1、3、5、8、10、12、15 天,用天平对大鼠体质量进行称量,计算每组大鼠的平均体质量。
2.2.2 足趾肿胀度测定 给药第1、3、5、8、10、12、15 天,用足肿胀测定仪测量大鼠右后爪肿胀度。
2.2.3 关节炎评分 左后爪注射II 型胶原15 d 后,右后爪会形成继发性关节炎,监测给药第1、3、5、8、10、12、15 天的关节炎指数评分[11]。0 分代表正常足爪;1 分代表足趾红肿;2 分代表足趾和足掌红肿;3 分代表肿胀至踝关节以下;4 分代表整个足爪完全肿胀,不能弯曲。将每只大鼠的4 只足爪得分相加作为关节炎得分,每只大鼠最高得分为16 分。
2.2.4 血清RF 及炎症因子检测 末次给药前禁食不禁水12 h 以上,于末次给药结束1 h 后,大鼠以戊巴比妥钠进行麻醉后,从腹主动脉采血于采血管中,4 ℃、3000 r/min 离心10 min,分离得到血清样品,按照试剂盒说明书分别检测RF、IL-17、IL-10、TNF-α、IL-1β 和IFN-γ 水平。
2.2.5 脾脏、胸腺指数测定 于末次给药结束1 h腹主动脉采血后,分别收集各组脾脏与胸腺,称定质量并计算脏器指数。
2.2.6 踝关节组织病理学检测 取大鼠右爪踝关节部分,采用10%多聚甲醛溶液固定后,将组织经甲酸甲醛脱钙液处理后,采用不同浓度的乙醇溶液梯度脱水、二甲苯透明、石蜡包埋、切片,依次经苏木素和伊红染色,封片后镜下观察并比较各组踝关节滑膜增生,炎性细胞浸润,关节腔浸出、关节软骨破坏、纤维化等情况。
2.3 网络药理学分析
2.3.1 目标化合物的选取 结合本课题组前期化学物质组及血中移行成分选取痹祺胶囊中39 个化合物为研究对象,详细信息见表1。

表1 痹祺胶囊目标化合物Table 1 Candidate active compounds in Biqi Capsule
2.3.2 靶标蛋白选取 通过 TCMSP 数据库(https://old.tcmsp-e.com/tcmsp.php)、CTD 数据库(https://ctdbase.org)和PharmMapper 数据库(http://lilabecust.cn/pharmmapper/)检索得到目标化合物相关靶标蛋白,通过 OMIM 数据库(https://omim.org/)、TTD 数据库(http://db.idrblab.net/ttd/)、DisGeNet 数据库(http://www.disgenet.org/home/)和GeneCards 数据库(https://www.genecards.org/)检索得到RA 相关靶点,并借助Uniprot 数据库(http://www.uniprot.org/)校正其靶标蛋白为官方名。
2.3.3 构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络并筛选关键蛋白靶点 将化合物靶点与疾病靶点取交互,将整合的交集靶点信息导入STRING10 数据库(http://string-db.org/)中,物种限定为“Homo sapiens”,阈值限定为0.900,获得蛋白间相互作用关系,将结果导入Cytoscape 3.6.0软件中,通过Cytoscape 软件绘制PPI 网络,以度值大于2 倍中位数筛选PPI 网络中关键靶点蛋白。
2.3.4 通路分析及生物信息学分析 运用Omicsbean 软件对靶点蛋白进行生物信息学分析,探究靶点蛋白在细胞组分(cellular component,CC)、分子功能(molecular function,MF)以及生物过程(biological process,BP)方面的作用机制。然后,通过STRING10 数据库得到与靶点相关的通路过程,利用京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库(http://www.genome.jp/kegg/)分析并查阅相关文献,对得到的通路进行深入分析。
2.3.5 “药材-化合物-靶点-通路-疾病”网络构建根据上述痹祺胶囊39 个化学成分的靶点及通路预测结果,在Excel 表格中建立药材-化合物、化合物-靶点、靶点-通路、靶点-疾病的相互对应关系,导入Cytoscape 3.6.0 软件中构建网络,并运用其插件Network Analyzer 计算网络的特征。网络中节点表示化合物、靶点以及作用通路、药理作用、功效。边表示药材-化合物、化合物-靶点、靶点-通路以及靶点-疾病相互作用。经处理后,得到39 个成分的相关靶点、通路预测图,以该图来表示痹祺胶囊“药材-化合物-靶点-通路-疾病”间的相互关系。
2.4 统计学分析
3 结果
3.1 痹祺胶囊对CIA 大鼠体质量、足趾肿胀度和关节炎评分的影响
如图1 所示,15 d 的II 型胶原造模后,大鼠体质量减轻,足趾相继出现红肿,关节肿大,关节畸形,导致行走艰难,严重的甚至会丧失活动能力,说明成功建立了CIA 大鼠模型。连续给药过程中监测大鼠的体质量、足趾肿胀度及关节炎评分,结果显示随着给药时间的延长,痹祺胶囊(0.20、0.40 g/kg)组可改善关节炎大鼠的体质量。在给药5 d 时,痹祺胶囊(0.40 g/kg)组显著降低大鼠的足趾肿胀度(P<0.05),给药8~15 d 后痹祺胶囊各给药组均显著降低足趾肿胀度(P<0.01)。在给药5 d 时,痹祺胶囊(0.40 g/kg)组明显降低关节炎评分(P<0.05),随着给药时间的延长,至给药12 d 时痹祺胶囊(0.10、0.20、0.40 g/kg)组均可显著降低CIA 大鼠关节炎评分(P<0.05、0.01)。综上说明,痹祺胶囊可改善关节炎大鼠状态,具有明显的抗炎作用,表现在改善足趾肿胀度、降低关节炎评分方面。

图1 痹祺胶囊对CIA 大鼠体质量、足趾肿胀度和关节炎评分的影响 (±s , n = 10)Fig.1 Effect of Biqi Capsule on body weight, foot swelling and arthritis score in CIA rats (±s , n = 10)
3.2 痹祺胶囊对CIA 大鼠血清RF 及炎性因子水平的影响
细胞因子在RA 炎症与关节损伤中扮演着重要的角色。如表2 所示,与对照组比较,模型组大鼠血清中RF、IL-17、IFN-γ、TNF-α 和IL-1β 水平均显著升高(P<0.05、0.01、0.001);与模型组比较,痹祺胶囊各剂量组大鼠血清中RF、IFN-γ、TNF-α 和IL-1β 水平均明显降低(P<0.05、0.01、0.001),痹祺胶囊(0.10、0.20、0.40 g/kg)组血清中IL-17 水平显著降低(P<0.05、0.001),且呈剂量相关性。IL-10 具有较强的抗炎作用,提高IL-10 含量有利于抑制体内炎性因子的释放和清除。结果显示,与对照组比较,模型组大鼠血清中IL-10 水平呈下降趋势;与模型组比较,痹祺胶囊可上调大鼠血清中IL-10 水平。
表2 痹祺胶囊对CIA 大鼠血清RF 及炎性因子水平的影响 (±s , n = 6)Table 2 Effect of Biqi Capsule on levels of RF and inflammatory factors in serum of CIA rats (±s , n = 6)

表2 痹祺胶囊对CIA 大鼠血清RF 及炎性因子水平的影响 (±s , n = 6)Table 2 Effect of Biqi Capsule on levels of RF and inflammatory factors in serum of CIA rats (±s , n = 6)
与对照组比较:&P<0.05 &&P<0.01 &&&P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001&P < 0.05 &&P < 0.01 &&&P < 0.001 vs control group; *P < 0.05 **P < 0.01 ***P < 0.001 vs model group
组别 剂量/(g·kg−1) RF/(IU·mL−1) IL-17/(pg·mL−1) IFN-γ/(pg·mL−1)TNF-α/(pg·mL−1)IL-1β/(pg·mL−1)IL-10/(pg·mL−1)对照 — 140.87±3.64 61.13±8.41 8.50±0.67 5.81±0.31 18.70±2.47 27.03±10.04模型 — 180.23±4.83&&& 94.67±8.95& 47.95±15.21&& 11.56±2.08&&& 39.60±6.21&&& 15.01±3.92泼尼松 0.01 146.07±3.15*** 64.81±5.15* 13.40±2.14** 6.06±0.36*** 21.25±2.41** 26.74±3.86雷公藤总苷 0.01 164.93±2.48* 52.96±7.47** 9.67±0.43** 6.62±0.47** 16.27±2.35*** 18.42±5.13痹祺胶囊 0.05 162.30±2.80** 69.90±12.03 13.80±2.55** 6.59±0.66** 21.02±3.32** 15.13±2.53 0.10 153.87±4.92** 58.80±11.55*** 17.38±7.16* 6.26±0.37** 17.38±1.82*** 21.64±8.13 0.20 148.43±5.42** 46.99±5.24* 12.16±1.20** 5.37±0.18*** 22.25±3.25** 22.41±10.01 0.40 136.33±5.84*** 52.05±8.23*** 8.99±0.95** 5.99±0.39*** 20.87±1.20** 23.39±8.88
3.3 痹祺胶囊对CIA 大鼠脾脏及胸腺指数的影响
如图2 所示,与对照组比较,模型组大鼠胸腺及脾脏指数均明显增大(P<0.01、0.001),提示在关节炎病理状态下胸腺和脾脏出现肿大;经15 d 连续给药后,痹祺胶囊各给药组均表现出降低脾脏指数的作用,在降低胸腺指数上显示出剂量相关性,其中0.20、0.40 g/kg 剂量组具有显著性差异(P<0.05、0.01),表明痹祺胶囊对于CIA 导致的脾脏和胸腺损伤有着一定的改善作用。
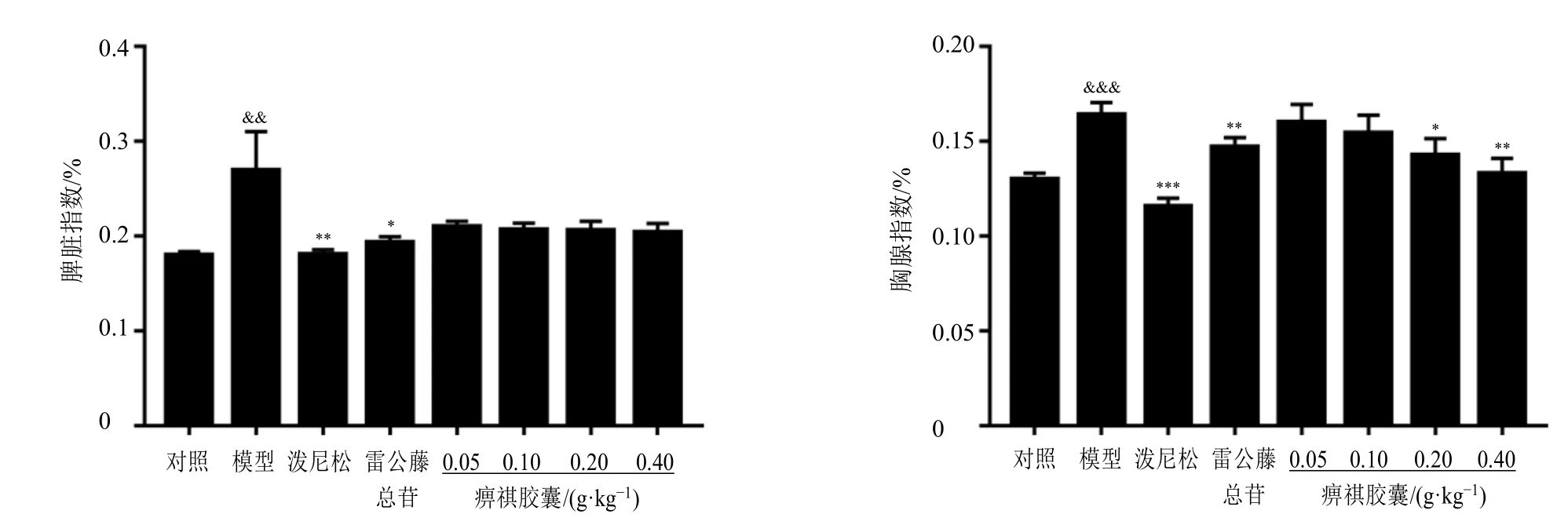
图2 痹祺胶囊对CIA 大鼠脏器指数的影响 (±s , n = 8)Fig.2 Effect of Biqi Capsule on organ index in CIA rats (±s , n = 8)
3.4 痹祺胶囊对CIA 大鼠踝关节组织病理变化的影响
如图3 所示,对照组大鼠踝关节组织结构基本正常,关节面光滑,关节腔内无渗出,滑膜细胞及结缔组织未见增生;模型组大鼠关节软骨被破坏,软骨细胞或大量增生或坏死,局部可见坏死组织碎片,可见大量滑膜结缔组织增生,侵蚀关节软骨及骨,并伴大量炎性细胞浸润;痹祺胶囊给药组对CIA大鼠的治疗作用呈剂量相关性,表现在减轻关节软骨破坏、关节腔内坏死组织减少、软骨细胞增生或坏死减少、滑膜结缔组织增生减少、炎性细胞浸润情况显著降低。

图3 各组大鼠踝关节组织病理观察结果 (HE, ×100)Fig.3 Pathological observation of ankle joint of rats in each group (HE, × 100)
3.5 网络药理学分析
通过 TCMSP 数据库、CTD 数据库和PharmMapper 数据库等预测和检索得到39 个化合物的627 个相关靶点。从OMIM 数据库、TTD 数据库、DisGeNet 数据库和GeneCards 数据库得到RA疾病靶点3368 个,将化合物靶点与疾病靶点取交集,得到交集371 个共同靶点(图4-A、B)。
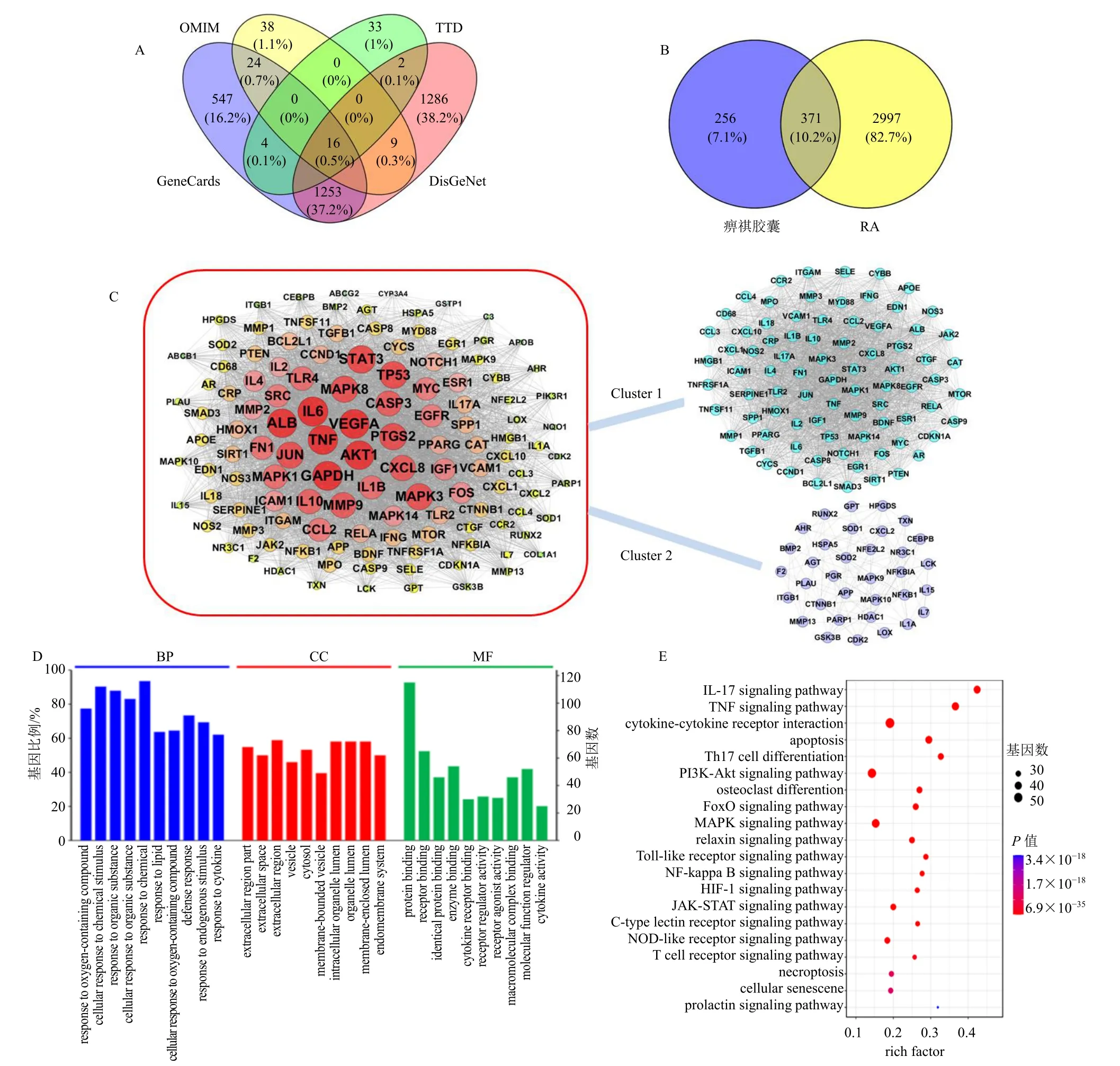
图4 痹祺胶囊治疗RA 的靶点分析Fig.4 Targets analysis of Biqi Capsule in treatment of RA
将371 个共同靶点投放至STRING 10 数据库中获得PPI,然后利用Cytoscape 软件构建PPI 网络图并对网络进行分析,结果(图4-C)显示,IL-6、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、白蛋白(serum albumin,ALB、蛋白激酶B1(protein kinase B1,AKT1)、TNF、肿瘤蛋白p53(tumor protein p53,TP53)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、STAT3、丝裂原活化蛋白激酶3(mitogen-activated protein kinase 3,MAPK3)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、MAPK8、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,CASP3)、基质金属蛋白酶9(matrix metalloproteinases 9,MMP9)、趋化因子配体8(chemokine ligand 8,CXCL8)、JUN、MAPK1 等靶点蛋白拥有较多相互作用关系,位于PPI 蛋白网络中心,这些蛋白涉及氧化应激、炎症反应、免疫调节、血管生成、活血、镇痛、滑膜增生等方面,提示痹祺胶囊抗炎、镇痛、免疫调节等作用与这些蛋白有关。进一步了解PPI 网络的生物作用,使用Cytoscape 的MCODE 插件对网络进行Cluster 模块分析,共获得2 个Cluster 模块(图4-C)。对2 个模块分别进行基因本体(gene ontology,GO)功能和KEGG 通路富集分析,发现Cluster 1主要与免疫调控、炎症反应、凝血级联、血小板激活等生物过程有关;Cluster 2 主要与血管生成、中枢及外周疼痛、血小板激活等生物过程相关。
利用OmicsBean 分析软件对相关靶点蛋白进行功能注释分析,选取P值最小的前10 个进行作图呈现(图4-D)。结果发现,这些蛋白在CC 方面主要参与细胞囊泡、细胞器内腔形成、细胞内膜系统等过程;在MF 方面主要参与蛋白结合绑定、受体结合、酶结合、细胞功能调控等过程;在BP 方面主要涉及有机物或含氧化合物的应激反应、对化学刺激的细胞应答、对内源性刺激的反应等过程。
在STRING 10 数据库中得到229 条相关通路,取false discovery rate<0.01 的通路并筛出无关的通路后共146 条,随后对这146 条通路进行KEGG 通路分析及相关文献查阅,得到80 条相关信号通路,并对前20 的通路进行可视化处理(图4-E),分析富集的通路发现,主要涉及与炎症反应相关的通路,如IL-17 信号通路、TNF-α 信号通路、NOD 样受体信号通路等;与免疫应答相关的通路,如T 细胞受体信号通路、辅助性T 细胞1(helper T cell,Th1)和Th2 细胞分化等;与凋亡相关的通路,如FoxO信号通路、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)-Akt 信号通路等;与活血相关的通路,如血小板活化、黏着斑、VEGF 信号通路、补体和凝血级联等;与疼痛相关的信号通路,如瞬时受体电位(transient receptor potential,TRP)通道的炎症介质调节、Wnt 信号通路、环磷酸腺苷信号通路、多巴胺能神经突触等。
根据对应关系在Cytoscape 3.6.0 软件中,构建痹祺胶囊“药材-化合物-靶点-通路-疾病”的网络关系图,黄色代表药材,绿色代表化合物,紫色代表靶点,蓝色代表通路,红色代表疾病(图5)。采用软件的插件进一步分析发现,网络平均度值为11.4,其中大于度值中位数的化合物有13 个,分别为三七皂苷R1、丹参酮IIA、异甘草素、咖啡酸、迷迭香酸、阿魏酸、人参皂苷Rg1、丹参酮I、丹酚酸B、士的宁、隐丹参酮等;靶点有58 个,主要有MAPK1、MAPK3、AKT1、磷脂酰肌醇3 激酶调节亚基( phosphatidylinositol 3-kinase regulatory subunit alpha,PIK3R1)、MAPK8、MAPK10、TNF、JUN、IL1B、核因子-κB抑制剂α(nuclear factor-κB inhibitor α,NFKBIA)、糖原合成酶激酶3β(glycose sythase kinase 3β,GSK3B)、前列腺素 G/H 合成酶 2(prostaglandin G/H synthase 2,PTGS2)、胰岛素样生长因子1(insulin-like growth factor 1,IGF1)、EGFR、一氧化氮合酶3(nitric oxide synthase 3,NOS3)等;通路有54 个,主要有TNF 信号通路、IL-17 信号通路、PI3K-Akt 信号通路、Toll 样受体信号通路、细胞因子-细胞因子受体相互作用、NOD 样受体信号通路、Th17 细胞分化、MAPK 信号通路、FoxO 信号通路等。网络中既存在1 个分子与多个靶点蛋白的相互作用,也存在不同分子作用于同1个靶点蛋白的现象,显示出痹祺胶囊治疗RA 具有多靶点的作用特点,而多靶点的物质基础在于痹祺胶囊中含有的特征成分,可能通过抗炎、免疫调节、抗血管生成等多种途径发挥治疗RA 作用。
4 讨论
RA 作为一种慢性自身免疫性疾病,全世界约有1%~2%的人口受困于RA,选择理想的动物模型对于评价药效至关重要,CIA 动物模型始于1977年,此动物模型在临床表现和病理机制上与人RA在临床表现、病理、免疫上十分相似,是研究RA 机制和治疗较为理想的动物模型,本研究采用II 型胶原诱导关节炎模型,在体征上表现出多关节肿胀等现象,病理上表现出明显的大量炎性细胞浸润、滑膜增生和软骨破坏等,而痹祺胶囊可明显改善RA大鼠足趾肿胀并降低关节炎评分。从HE 染色结果可见痹祺胶囊可显著改善CIA 大鼠的关节损伤,表现为关节软骨破坏减轻,关节腔内坏死组织减少,软骨细胞增生或坏死减少,滑膜结缔组织增生减少,炎性细胞浸润情况也显著降低。
RA 病理生理学较为复杂,其发病机制被认为始于血液中的免疫复合物,即关节前阶段,在这个阶段会产生针对自身组织成分的自身抗体,同时与自体抗原进入关节,此为过渡阶段。抗体抗原结合至前哨细胞上的Fc 受体γ,先天免疫反应被激活,T 细胞被分化和增殖为Th 细胞和调节性T 细胞(regulatory T cell,Treg),Th 细胞通过浆细胞激活B 细胞产生RF 等抗体,从而通过不同途径破坏骨、软骨和滑膜[4]。本研究表明RA 大鼠血清中RF 水平显著增加,而痹祺胶囊呈剂量相关性降低血清中RF水平,表明痹祺胶囊可以延缓因RF 的大量产生导致对骨、软骨和滑膜的损伤。
RA 特征主要是炎症细胞向滑膜关节浸润增多,最终导致软骨和骨骼损伤,而滑膜巨噬细胞与RA 严重程度密切相关。活化的巨噬细胞产生促炎细胞因子和趋化因子,如IFN-γ、TNF-α 等推动RA的进展[12]。巨噬细胞、树突状细胞等的激活依赖迁移至关节中活化的T 细胞,其中Th1 和Th17 细胞亚群是炎症滑膜组织中发现的主要细胞类型。Th1细胞在滑膜关节中促进促炎细胞因子如TNF-α、IL-6 等释放,继而诱导Th17 细胞活化,分泌IL-17 促进骨吸收,导致关节病变[13-14]。研究发现,痹祺胶囊在临床实践和动物实验(佐剂型关节炎及CIA等)中可调节T 淋巴细胞亚群Th/Ts 之间的平衡,下调IL-1 和TNF-α 水平,显示抗炎、镇痛、免疫调节等药效作用[15]。本研究表明,痹祺胶囊可显著降低CIA大鼠血清中IL-17、TNF-α、IL-1β 和IFN-γ 水平。Treg 通过分泌IL-10、转化生长因子-β(transforming growth factor-β,TGF-β)、IL-35 等细胞因子参与免疫负性调节。研究发现,IL-10 可通过多种途径参与免疫负性调节,如抑制T 细胞向Th 细胞转化并抑制Th 细胞分泌细胞因子,另外IL-10 可抑制B 细胞活化,抑制骨化三醇介导的免疫球蛋白 E(immunoglobulin E,IgE)表达[16]。研究发现,RA患者Treg 细胞百分比及其生成IL-10 的含量较正常人低[17-18]。本研究表明,痹祺胶囊可升高IL-10 的水平,综合以上结果提示痹祺胶囊显示出较好的抗炎和免疫调节作用。
RA 中因特异性自身抗原的持续存在,持续的免疫细胞激活导致关节中一种自我永存的慢性炎症状态和滑膜肿胀,被识别为疼痛和关节肿胀[19]。研究发现,滑膜成纤维细胞( fibroblast-like synoviocytes,FLS)产生TNF-α,通过p38/JNK MAPK 通路造成活性氧(reactive oxygen species,ROS)蓄积,而ROS 经NF-κB 反馈形成ROS/TNFα 正反馈,促进关节破坏,伤害感受器致敏[20]。同时在TNF-α、IL-17 等细胞因子的存在下,NF-κB 信号通路、JAK-STAT 信号通路的激活可导致T 细胞活化,进一步介导炎症反应,还可诱导RA-FLS 异常增殖,激发破骨细胞分泌RANKL,诱导破骨细胞的增殖与活化,导致关节的畸形与骨侵蚀[21],而此过程可被Wnt 信号通路阻断[22]。此外,IL-17A 还可促进滑膜细胞产生MMP1,导致软骨破坏,还可促进内皮细胞分泌MMPs,促进FLS 产生VEGF、血小板衍生生长因子(platelet derived growth factor,PDGF)、成纤维细胞生长因子(fibroblast growth factor,FGF)、粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)、表皮生长因子(epidermal growth factor,EGF)和血管生成素-1(angiopoietin-1,Ang-1)[23],从而促进滑膜组织内血管增生,滑膜不规则增厚,并伸向关节腔和软骨边缘部扩展导致血管翳形成[24]。此外,RA 患者中,在各种细胞活化和凋亡过程中释放的细胞外囊泡(extracellular vesicles,EVs)水平升高,可能与体内凝血激活有关[25]。血小板激活因子(platelet activating factor,PAF)是目前最强的脂质介质,又是强效的炎症介质,PAF 在RA 中与滑膜炎、组织破坏及血管新生密切相关,并且能够诱导血小板聚集,与RA 患者存在血液学异常关系密切[26]。而抑制纤凝、促进纤溶,纠正RA 凝血异常,能阻止滑膜炎症的进展,进而阻止骨质破坏[27]。
本研究的靶点预测及作用通路分析结果提示,痹祺胶囊中党参炔苷、党参苷I、党参苷II、土莫酸、茯苓素、苍术酮、白术内酯I、白术内酯II 等成分可作用于IL-10、IL-4、IL-2、酪氨酸受体激酶Lck(tyrosine-protein kinase Lck,LCK)、热休克蛋白A5(heat shock protein A5,HSPA5)、MAPK1、MAPK9、MAPK14、Toll 样受体4(Toll-like receptor 4,TLR4)、髓性分化原发反应蛋白88(myeloid differentiation primary response protein MyD88,MYD88)、雄激素受体(androgen receptor,AR)、CASP3、骨形成蛋白2(bone morphogenetic protein 2,BMP2)等靶点,通过Toll 样受体信号通路、T细胞受体信号通路、Wnt 信号通路、MAPK 信号通路等发挥免疫调节、成骨/破骨细胞平衡等的作用;咖啡酸、迷迭香酸、丹参酮I、丹参酮IIA、三七皂苷R1、异甘草素、奎宁酸、苍术酮、丹参新酮、三七皂苷CK 等作用于神经源性位点Notch 同源蛋白1(neurogenic locus notch homolog protein 1,NOTCH1)、纤连蛋白(fibronectin,FN1)、凝血酶(thrombin,F2)、连接黏附分子A(Junctional adhesion molecule A,F11R)、VEGFA、NOS3、ALB、细胞间黏附分子1(Intercellular adhesion molecule 1,ICAM1)等靶点,参与调节JAK-STAT、Ca2+、VEGF通路、Ras 通路、FoxO 通路、缺氧诱导因子-1 信号通路等信号通路过程,抑制白细胞与内皮细胞黏附、降解纤维蛋白、抑制血小板聚集,维持血液渗透压,抑制血栓形成和血管翳形成;士的宁、马钱子碱、番木鳖苷酸、咖啡酸、奎宁酸、甘草苷、异甘草素、甘草次酸、迷迭香酸、阿魏酸、洋川芎内酯A、党参苷II、丹参酮IIA、人参皂苷Rg1等作用于PTGS2、谷胱甘肽S 转移酶P1(glutathione S-transferase P1,GSTP1)、TNF、IL1B、CXCL8、NOS2、血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM1)、μ-阿片受体δ1(Delta-type opioid receptor,OPRD1)、OPRM1 等蛋白靶点,通过NF-κB 信号通路、花生四烯酸代谢、C 型凝集素受体信号通路、5-羟色胺突触、神经活性配体-受体相互作用、环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)-蛋白激酶G(protein kinase G,PKG)信号通路等通路,抑制白细胞-内皮细胞黏附及TNF-α、IL-1β 等炎症因子释放和前列腺素的生成以及拮抗前列腺素受体、外周痛觉神经元的刺激或抑制中枢神经兴奋和5-羟色胺释放等发挥外周和中枢镇痛作用。
痹祺胶囊由马钱子、党参、白术、丹参、茯苓、牛膝、地龙、川芎、三七和甘草10 味药材组成,现代药理学研究显示,党参多糖可通过影响TLR4 信号通路激活CD4+T 细胞,触发Th2 转化为Th1[28],从而维持Th1/Th2 细胞、Tregs/Th17、IL-10/TNF-α及IL-10/IL-1β 的免疫稳态[29]。党参醇提物可促进造血干(祖)细胞CD34+、CD3+、CD19+及CD71+分子的表达,抑制CD45+、CD14+分子的表达,使其处于分化早期阶段,维持造血干(祖)细胞的干性,其物质基础主要为党参炔苷和党参苷I[30]。丹参中丹参酮IIA、丹参素和丹酚酸A 可通过抑制血小板蛋白质二硫键异构酶ERp57 和整合素αIIbβ3 的相互作用,降低凝血因子7 的活性,增加血小板中环磷酸腺苷的含量,降低血液黏度,还可激活纤溶酶原-纤溶酶系统,促使纤维蛋白溶解,但同时保持血细胞正常状态等途径发挥活血化瘀作用[31-33]。三七中皂苷类成分三七皂苷R1、人参皂苷Rg1等通过增加内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的磷酸化,激活PI3K/Akt/eNOS途径增加内源性一氧化氮的释放,发挥血管舒张作用[34-35]。地龙中蚓激酶、纤溶酶类成分可直接降解纤维蛋白原与纤维蛋白,活化纤溶酶原、促进组织型纤溶酶原激活物(tissue-type plasminogenactivator,t-PA)等纤溶激活因子的释放,抑制凝血途径,促进凝血因子的水解,防止血小板发生聚集[36]。马钱子碱能抑制外周炎症组织前列腺素E2、5-羟色胺、6-酮-前列腺素Fla 与血栓烷素等炎症介质的释放,并可降低感觉神经末梢对痛觉敏感性,并通过抑制钙激活钾离子通道抑制背根神经节神经元的兴奋性,增加脑内神经递质-脑啡肽含量发挥抗炎、镇痛作用[37-39]。
综上,本研究通过CIA 动物模型及网络药理学手段综合分析了痹祺胶囊的药效作用和可能的作用机制,表明痹祺胶囊可能通过多种与免疫调控、血管生成、骨形成/侵蚀平衡、凝血、镇痛等相关通路调控相关活性物质达到治疗RA 的效果,并为进一步确定痹祺胶囊中的活性成分、具体作用机制奠定基础,然而本研究并未对网络药理学预测出的靶点及通路进行进一步的验证,具体单体组分的作用机理和靶效应也需进一步研究。
利益冲突 所有作者均声明不存在利益冲突

