基于代谢组学的痹祺胶囊治疗类风湿性关节炎作用机制研究
韩彦琪 ,姚鹏飞 ,卜睿臻,许 浚 ,王 磊,张铁军 *,刘昌孝 *
1.天津药物研究院 天津市中药质量标志物重点实验室,天津 300462
2.天津药物研究院 中药现代制剂与质量控制技术国家地方联合工程实验室,天津 300462
3.天津药物研究院 药物成药性评价与系统转化全国重点实验室,天津 300462
4.天津中医药大学,天津 301617
5.天津达仁堂京万红药业有限公司,天津 300112
6.津药达仁堂集团股份有限公司,天津 300193
痹祺胶囊由马钱子、地龙、党参、茯苓、白术、川芎、丹参、三七、牛膝、甘草10 味药材组成,具有益气养血、祛风除湿、活血止痛的功效,用于气血不足、风湿瘀阻、肌肉关节酸痛,关节肿大、僵硬变形或肌肉萎缩,气短乏力;风湿、类风湿性关节炎,腰肌劳损,软组织损伤属上述证候者。多项临床研究表明痹祺胶囊治疗类风湿性关节炎(rheumatoid arthritis,RA)效果良好,且不良反应较少,是治疗RA 安全有效的方药[1-7]。
代谢组学是系统生物学中一种关键的研究技术和方法,当机体受到病原、环境等刺激产生病变时,内源性物质发生相应的代谢响应,这种代谢产物的变化表达成为疾病相关的代谢物组,通过对机体的血清、尿液、粪便、细胞提取物等不同类型的样本中的内源代谢成分进行表征,得到含有代谢产物信息的代谢指纹图谱,并利用多元数据分析方法对信息进行挖掘提取,获取机体在不同生理或疾病状态下的生物标志物,进一步分析机体内源性代谢机制,探讨疾病的内在代谢循环途径和信号通路,为探讨疾病的发病过程和机制提供参考,同时进一步剖析药物作用机制与作用位点的相关信息,阐释药物作用机制[8-10]。本研究采用超高效液相色谱-四极杆串联飞行时间质谱(UPLC-Q-TOF-MS)技术,鉴定与痹祺胶囊干预RA 相关的潜在生物标志物,基于标志物所在的代谢通路,探讨痹祺胶囊治疗RA 的作用机制。
1 材料
1.1 药物
痹祺胶囊(天津达仁堂京万红药业有限公司,国药准字Z10910026,规格0.3 g/粒,批号311574);醋酸泼尼松片(新乡市常乐制药有限责任公司,规格5 mg/片,批号21020162);雷公藤总苷片(上海复旦复华药业有限公司,规格10 mg/片,批号180502)。
1.2 动物
SPF 级Sprague-Dawley 雄性大鼠,体质量(120±10)g,由北京斯贝福生物技术有限公司提供,许可证号SCXK(京)2019-0010,动物实验获天津天诚新药评价有限公司实验动物伦理委员会批准(IACUC:No.2021031803),动物饲养环境(23±3)℃,12 h 昼夜交替,自由进食饮水。
1.3 主要试剂及仪器
鸡 II 型胶原蛋白(Chondrex 公司,批号200323);乙腈(Fisher Chemical 公司,批号F21LCL201);甲酸(Dikma 公司,批号4313887)。
MD200-1A 型氮吹仪(上海登晨生物医疗科技有限公司);Thermo Mixer C 型恒温混匀仪(Thermo公司);TGL-18R 型离心机(珠海黑马医学仪器有限公司);Ultimate 3000 型液相色谱仪(Thermo 公司);Q-Exactive 型质谱仪(Thermo 公司)。
2 方法
2.1 动物分组及给药
SD 大鼠适应性喂养1 周后,随机选择10 只为空白组,其余大鼠在左侧足跎肉垫处皮内注射鸡II型胶原蛋白(0.1 mL/只),空白组注射等体积生理盐水。在第1 次注射免疫的第7 d,在背部注射相同乳剂0.1 mL 加强免疫[11-12],观察大鼠状态至造模15 d,筛选双侧关节出现炎症肿胀的大鼠随机分为模型组、泼尼松组(10 mg/kg)、雷公藤总苷组(10 mg/kg)、痹祺胶囊组(BQH,0.4 g/kg,临床等效剂量),每组10 只。各给药组连续ig 给药15 d,空白组及模型组予以等体积0.5%羧甲基纤维素钠(CMC-Na)溶液。末次给药前禁食不禁水12 h 以上,末次给药结束1 h后,麻醉,腹主动脉采血,4 ℃下3000 r/min 离心10 min,取上清液即为血清,置−80 ℃冰箱备用。
2.2 血清及质控(quality control,QC)样本处理
将血清样本取出,4 ℃下解冻,分别取45 µL血清于EP 管,向每个样本中加入180 μL 乙腈,涡旋1 min,以4 ℃、14 000 r/min 离心15 min,每个样本取45 µL 混合作为QC,每个样本和QC 取135µL 于96 孔板中,氮气吹干,加入70 µL 50%乙腈复溶,4 ℃、14 000 r/min 离心15 min,每个样本取65 µL 上清液进样。样本在进样的分析过程中,为监测LC-MS 系统的稳定性,每进5 针样品进1 针QC 样品。
2.3 LC-MS 分析条件
2.3.1 色谱条件 Phenomenex Kinetex C18(100 mm×4.6 mm,2.6 µm)色谱柱;柱温40 ℃;流动相为0.1%甲酸水溶液(A)和0.1%甲酸乙腈溶液(B),梯度洗脱:1~12 min,5%~60% B;12~13 min,60%~100% B;13~16 min,100% B;16~17 min,100%~5% B;17~20 min,5% B;体积流量0.3 mL/min;进样体积3 μL。
2.3.2 质谱条件 Q Exactive MS 质谱仪,用HESI离子化方式,正、负离子模式扫描,鞘气体积流量35 arb,辅助气体积流量10 arb,喷雾电压3.5 kV,毛细管温度为275 ℃,加热器温度350 ℃,S-lens RF level 50%。轮廓谱分析采用全扫描模式,质量扫描范围为m/z80~900,分辨率70 000 FWHM,自动增益控制目标(AGC target)1×106。结构鉴定采用全扫描/数据依赖二级扫描(full scan/dd MS2)模式,分辨率17 500 FWHM,AGC target 2×105,离子隔离窗口(isolation window)2.0,归一化碎裂能量(stepped NCE)50%,动态排除(dynamic exclusion)6 s。
2.4 数据处理
将通过UPLC-Q-TOF-MS 所采集的原始图谱导入到XCMS 软件进行峰对齐、峰提取、归一化、去卷积等预处理,得到1 个含有保留时间、m/z、峰面积信息的三维矩阵。通过R 语言对归一化后的峰面积进行主成分分析(principal component analysis,PCA)、偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA),以变量投影重要性(variable importance for projective,VIP)≥1.0,差异倍数(fold-change,FC)≥2 或≤0.5 和P<0.01为标准筛选出潜在的生物标志物。
2.5 代谢标志物鉴定及通路分析
代谢标志物定性分析根据同位素峰相对比值确定化合物元素组成,搜索HMDB、PubChem、ChemSpider、Lipid Maps、MassBank、KEGG 等数据库对代谢物进行检索,根据二级质谱离子碎片、化学键断裂规律及相关文献查阅确定代谢标志物结构。
利用MetPA 数据库联合多个高级的路径分析程序对鉴定得到的血液代谢标志物的相关代谢通路进行拓扑特征分析,将通路影响值(pathway impact)>0.05 的代谢通路作为潜在靶标代谢通路。
3 结果
3.1 QC 分析
QC 样本PCA 结果见图1。QC 样本可以相对聚集在一起,聚集越好表明仪器检测状态越稳定,采集的数据质量越好。经过PCA,QC 样本在2 个采集模式下都比较聚集,数据采集质量较好,QC 结果合格。

图1 QC 样本PCAFig.1 PCA of QC samples
3.2 代谢物轮廓分析
通过UPLC-Q-TOF-MS 分析,获得不同组别大鼠血清样品在正、负离子模式下的代谢指纹谱,如图2 所示。为了更好揭示组间差异及代谢轮廓,采用OPLS-DA 进行数据分析,结果见图3。空白组、模型组和痹祺胶囊组均聚集在95%的置信区间内,各聚为一类。空白组与模型组分布于不同象限区域内,且组内样品聚集良好,表明建立RA 模型后,大鼠内源性小分子代谢物发生显著变化,模型复制成功。痹祺胶囊给药干预后,整体上远离模型组,向空白组靠拢的趋势明显,表明痹祺胶囊对RA 大鼠的治疗效果显著。

图2 大鼠血清代谢指纹图谱Fig.2 Serum metabolic fingerprint of rats

图3 空白组 (C)、模型组 (M) 和痹祺胶囊组 (BQH) PLS-DA 图Fig.3 PLS-DA analysis diagram of blank group (C), model group (M) and Biqi Capsules (BQH) group
3.3 生物标志物的筛选及鉴定
将模型组和空白组、痹祺胶囊组和模型组大鼠血清的质谱数据进行单变量、多变量分析(PLSDA)。图4 分别展示了正、负模式下的火山图,FC≤0.5 且P<0.01 的点用绿色标识;FC≥2 且P<0.01 的点用红色标识,其余点为黑色,图中所示虚线为一般筛选标准线。图5 分别展示了正、负模式下的PLS-DA 模型(参数见表1),可以看出空白组和模型组能完全分开,说明两组大鼠血液代谢产物差异明显。在OPLS-DA 基础上进行S-plot 分析,选择VIP 值≥1.0 且P<0.01,FC≥2 或FC≤0.5 的变量,对潜在差异代谢标志物进行结构验证,最终表征了18 个RA 血液差异代谢标志物,其中正离子模式下9 个,负离子模式下9 个,分析发现其中8 个代谢差异物表现为不同程度的下调,10 个表现为不同程度的上调,详细信息见表2。对18 个生物标志物的相对含量研究发现(图6、7),与模型组相比,痹祺胶囊组对14 个生物标志物产生了逆转作用,除对6-硫代鸟苷一磷酸、3-(3-羟基苯基)丙酸、三氯乙醇葡萄糖醛酸、吲哚乙酸4 个生物标志物的作用没有统计学差异外,其余14 个生物标志物可以被其完全逆转(FC≥2 或FC≤0.5 且P<0.01),见表2。
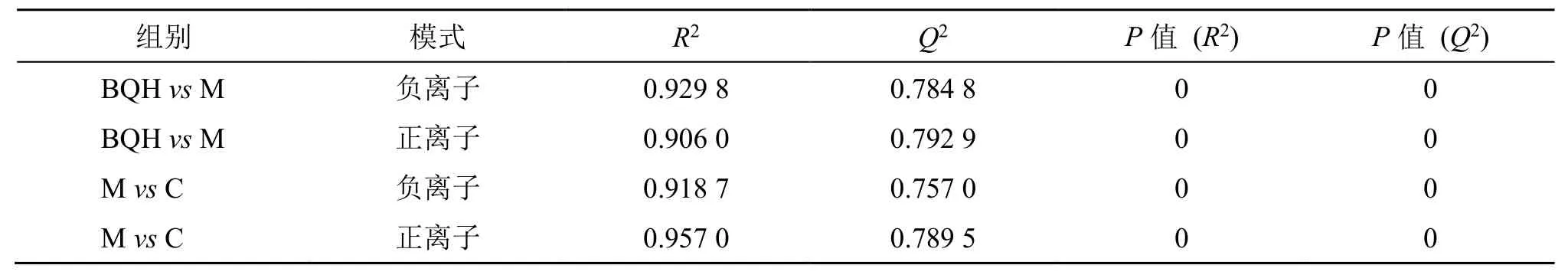
表1 PLS-DA 模型参数Table 1 PLS-DA model parameters

表2 血清中差异代谢物鉴定结果Table 2 Identification of differential metabolites in serum

图4 大鼠血清代谢物火山图Fig.4 Volcano plots for metabolites in serum of rats

图5 PLS-DA 得分图Fig.5 Score plot of PLS-DA

图6 痹祺胶囊给药后对RA 大鼠血清生物标志物含量变化的影响 (±s , n=10)Fig.6 Effect of biomarkers levels in serum of RA rats after administration with Biqi Capsules (±s , n=10)

图7 各组潜在生物标志物热图Fig.7 Heat map of potential biomarkers in different groups
3.4 痹祺胶囊干预RA 的代谢通路分析
利用MetPA 数据库联合多个高级的路径分析程序对表2 中鉴定得到的18 个血液代谢标志物的相关代谢通路进行拓扑特征分析,将通路影响值>0.05 的11 条代谢通路作为潜在靶标代谢通路,包括(1)苯丙氨酸、酪氨酸和色氨酸的生物合成;(2)苯丙氨酸代谢;(3)醚脂代谢;(4)组氨酸代谢;(5)三羧酸循环;(6)精氨酸生物合成;(7)精氨酸和脯氨酸代谢;(8)丙氨酸、天冬氨酸和谷氨酸代谢;(9)药物代谢-其他酶类;(10)丙酮酸代谢;(11)嘌呤代谢。见图8。

图8 潜在生物标志物代谢通路富集Fig.8 Enrichment of metabolic pathways of potential biomarkers
4 讨论
本研究以RA 模型大鼠为研究对象,探究痹祺胶囊治疗RA 的作用机制。利用UPLC-Q-TOF-MS技术对大鼠血清进行代谢组学分析,筛选潜在生物标志物,并富集相关代谢通路,阐释痹祺胶囊作用机制。共筛选鉴定出18 个差异代谢物与RA 密切相关,且痹祺胶囊能显著回调这些潜在生物标记物,通过信号通路富集分析发现,痹祺胶囊主要通过调节花生四烯酸代谢、甘油磷脂代谢、氨基酸代谢、与能量代谢相关的三羧酸循环等代谢途径发挥治疗作用(调控网络见图9)。

图9 痹祺胶囊调控RA 的代谢网络Fig.9 Metabolic network of Biqi Capsules regulating RA
4.1 花生四烯酸代谢
花生四烯酸是人体中一种重要的脂肪酸,可通过环氧化酶(cyclooxygenase,COX)和脂氧合酶(lipoxygenase,LOX)催化生成多种致炎因子,如前列腺素E2(prostaglandin E2,PGE2)、白三烯B4(leukotriene B4,LTB4)、血栓素(thromboxane,TXB)等,介导或调节RA 的炎症反应,增加血管弹性,调节血细胞功能[13]本研究发现,在RA 大鼠血清中花生四烯酸代谢产生的前列腺素F2α 与12-酮-白三烯B4含量显著升高。研究表明前列腺素F2α 可抑制血管平滑肌舒张,导致瘀血疼痛[14]12-酮-白三烯B4是白三烯家族中一个重要的炎症调节因子,LTB4可激活T 淋巴细胞释放多种细胞因子产生炎症反应;同时通过抑制中性粒细胞凋亡,诱导其定向迁移、致关节疼痛和骨损伤、调控免疫细胞分化,致使RA 患者出现关节炎症、肿痛、骨质破坏等症状[15-16]。经痹祺胶囊给药干预后,前列腺素F2α与12-酮-白三烯B4含量显著下降,表明痹祺胶囊可通过调节花生四烯酸代谢途径,降低炎症因子表达,发挥抗炎止痛、活血化瘀的作用。
4.2 甘油磷脂代谢
溶血磷脂酰胆碱(lysophosphatidylcholine,LPC)是由甘油磷脂类化合物经磷酸酯酶A2 水解得到的主要产物之一,在细胞增殖和炎症反应中均起着重要作用。LPC 与G 蛋白偶联受体结合可诱导T 淋巴细和巨噬细胞的迁移,促进致炎细胞因子的产生,诱导氧化应激,促进细胞凋亡,从而聚集炎症[17]。研究表明,在RA 的发病机制中,脂质介质起着至关重要的作用,LPC 主要参与调节免疫、诱导致炎因子的产生,促进炎症反应,其中LysoPC(O-18:0/0:0) 表现出一定的致炎作用[18-19]。本研究发现,在RA 大鼠血清中LysoPC(O-18:0/0:0) 含量显著升高,经痹祺胶囊干预后显著降低,可见痹祺胶囊可通过调控甘油磷脂代谢途径,抑制LPC 的代谢生成,从而发挥抗炎作用。
4.3 氨基酸代谢
氨基酸代谢途径紊乱与滑膜炎症反应密切相关。L-苯丙氨酸可以在苯丙氨酸羟化酶作用下生成酪氨酸;酪氨酸也是合成儿茶酚胺的前体,其可在酪氨酸羟化酶、巴胺羟化酶等多种酶的催化作用下生成儿茶酚胺[20-21]。儿茶酚胺与免疫细胞表面受体结合,抑制细胞免疫和体液免疫,与β 肾上腺素能受体结合可发挥抗炎效应[22]。在RA 中,淋巴细胞的内源性儿茶酚胺具有抑制辅助性T 细胞17(T helper cell 17,Th17)/调节性T 细胞(regulatory T cells,Treg)失衡、促进Th1 细胞向Th2 细胞方向分化,减轻关节炎症及骨损伤的作用[23-24]。本研究发现在RA 大鼠血清中L-苯丙氨酸含量显著增加,此外其下游代谢物马尿酸和二甲基马尿酸含量明显升高,由此可推测L-苯丙氨酸-酪氨酸-儿茶酚胺代谢途径可能受到阻碍。经痹祺胶囊干预后,L-苯丙氨酸、马尿酸和二甲基马尿酸含量显著回调,可能会使免疫系统发生调节改变。
研究表明,在RA 的关节滑液中的谷氨酸浓度与关节肿胀程度、骨侵蚀及痛觉的敏感度密切相关,其能刺激滑膜成纤维细胞的增殖,破坏关节软骨,同时引起巨噬细胞释放多种细胞因子促进炎症反应[25-26]。同时谷氨酸会参与脱氢抗坏血酸的转运,其在RA 患者血清中浓度显著升高,可能反映了RA 中维生素的抗氧化和清除自由基活性增加,与关节炎症程度有关[27-28]。谷氨酸能被谷氨酰胺合成酶酰胺化为谷氨酰胺,或经脱氨基转化为α-酮戊二酸[29]。本研究发现,在RA 大鼠血清中,α-酮戊二酸含量显著下降,痹祺胶囊干预后显著回调,表明痹祺胶囊通过调节谷氨酸代谢途径缓解炎症反应,从而抑制滑膜细胞增殖及软骨破坏。
研究发现RA 患者的血清、软骨组织和滑膜细胞中诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和NO 呈现高表达,精氨酸在体内代谢主要是在NOS 的催化下代谢产生NO,可刺激T 淋巴细胞的增生并释放细胞因子,促进炎症发展[30-31]。本研究发现在RA 大鼠血清中L-精氨酸含量显著下降,经痹祺胶囊给药后其含量显著回升,表明可通过调节精氨酸代谢途径抑制NO 生成,发挥抗炎作用。
4.4 三羧酸循环
三羧酸循环作为有氧代谢过程的中心代谢途径,是机体获得能量的主要方式,是糖类、脂类、氨基酸的代谢联系的枢纽和最终代谢通路。三羧酸循环过程中相关的中间代谢物与酶参与炎症及免疫调节,与多种人类疾病相关[32-33]。研究发现RA 患者体内三羧酸循环的中间产物α-酮戊二酸、苹果酸和柠檬酸会降低[34]。α-酮戊二酸能够增加M2/M1巨噬细胞极化的比例,发挥抗炎作用[35-36]。α-酮戊二酸、苹果酸等含量降低,意味着RA 患者的有氧代谢受阻,而糖降解途径增强,进一步促进滑膜细胞的快速增殖[37]。同时,三羧酸循环受阻后也会引发氧化应激,RA 患者滑膜组织缺氧的状态会刺激自身免疫组织活化以及滑膜细胞的分化,同时引起炎症及氧化损伤[38]。本研究发现,模型组中α-酮戊二酸和苹果酸水平显著下降,说明RA 模型中三羧酸循环途径受阻,经痹祺胶囊治疗后,α-酮戊二酸和苹果酸显著回调,表明其可通过干预三羧酸循环,调节糖类的有氧代谢途径,进而发挥抗炎、抑制滑膜增殖及氧化损伤作用,最终实现对RA 的治疗作用。
综上分析,痹祺胶囊可通过调节花生四烯酸代谢、甘油磷脂代谢、氨基酸代谢(L-苯丙氨酸、谷氨酸、精氨酸)、三羧酸循环能量代谢等代谢途径,改善内源性代谢物的水平,在机体供能、抗炎及免疫调节过程中发挥作用,从而达到对RA 的治疗效果。本研究从代谢组学的角度筛选了痹祺胶囊治疗RA 的潜在生物标志物,解析了其作用机制,为进一步机制研究奠定基础,同时也为痹祺胶囊的临床合理用药提供科学依据。
利益冲突 所有作者均声明不存在利益冲突

