基于体外细胞模型的痹祺胶囊药效物质基础研究
宋紫腾 ,卜睿臻,韩彦琪 ,王 磊,姚鹏飞 , ,许 浚 ,张铁军 *,刘昌孝 *
1.天津药物研究院 天津市中药质量标志物重点实验室,天津 300462
2.天津药物研究院 中药现代制剂与质量控制技术国家地方联合工程实验室,天津 300462
3.天津药物研究院 药物成药性评价与系统转化全国重点实验室,天津 300462
4.天津达仁堂京万红药业有限公司,天津 300112
5.津药达仁堂集团股份有限公司,天津 300193
6.天津中医药大学,天津 301617
类风湿性关节炎(rheumatoid arthritis,RA)是一种以关节滑膜慢性炎症为主要特征的、导致多关节进行性破坏为特征的慢性自身免疫性疾病[1]。RA在临床上的病理特征主要表现为3 个方面:炎症、滑膜增生、骨破坏[2]。因其发病机制尚不完全明确,市面上没有治疗RA 的特效药,RA 仍危害着大量人群的健康[3]。目前临床治疗RA 的化学药主要用于减轻症状,长期使用会产生不良反应,包括呕吐、皮疹、白细胞减少和肝肾损伤[4]。相反,中药不仅来源广泛、种类丰富、不良反应小,且具有多成分、多环节、多靶点、多通路综合作用的特点[5-6],因此中药在类风湿性关节炎的治疗上具有独特的优势。中医学认为RA 属于“痹证”范畴,中医经典中的“历节病”“骨痹”“顽痹”“尪痹”“鹤膝风”等均归于RA[7]。其中,风寒湿邪、经络不畅、痰瘀互结是导致RA 发生、发展的关键病机。故RA 的临床治疗亦遵循祛风除湿、散寒通络、扶正祛邪、祛痰化瘀、清热利湿、活血通络的治则[8]。中医药良好的控制炎症和免疫调节作用在治疗RA 中得到了广泛研究与应用[9-10]。
痹祺胶囊来源于汉代名医华佗传世验方“一粒仙丹”,用于治疗水湿之地百姓常见的骨病,由马钱子、党参、丹参、白术、茯苓、川芎、三七、地龙、甘草、牛膝10 味中药组成,具有益气养血、祛风除湿、活血止痛的功效,临床上用于治疗气血不足、风湿阻滞、肌肉关节酸痛、关节僵硬变形等,经多年临床使用证实其对RA 有确切疗效[11-13]。然而,痹祺胶囊治疗RA 的作用机制尚不完全明确,限制了其广泛应用。因此,本研究通过建立脂多糖(lipopolysaccharide,LPS)诱导单核巨噬细胞RAW264.7 炎症模型、细胞核因子-κB 受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)和巨噬细胞集落刺激因子(macrophagestimulating factor,M-CSF)与RAW264.7 共孵育诱导破骨细胞分化模型以及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)诱导人风湿性关节滑膜成纤维细胞RA-HFLS 增殖模型,探究痹祺胶囊及其方中19 个重要单体成分马钱子碱、士的宁、党参炔苷、白术内酯III、茯苓酸、丹参素、丹参酮IIA、丹酚酸B、迷迭香酸、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、阿魏酸、藁本内酯、蜕皮甾酮、牛膝皂苷D、次黄嘌呤、甘草次酸、甘草苷发挥抗炎镇痛、抑制破骨细胞形成及抑制滑膜增生的药效及相关作用机制,并确定痹祺胶囊的药效物质基础。
1 仪器与材料
1.1 仪器
BDS200 型倒置显微镜、311 型MCO-5M CO2细胞培养箱均购自赛默飞世尔科技公司;HFsafe-1200LC 型超净工作台购自上海Heal Force 公司;Spectra Max M5 型酶标仪、T100 型PCR 仪购自美国Bio-Rad 公司;BD FACSVerse 型分析型流式细胞仪购自美国BD 公司;LightCycler480II 型荧光定量PCR 仪购自Roche 公司。
1.2 药品与试剂
痹祺胶囊(批号311574,天津达仁堂京万红药业有限公司),地塞米松、LPS、抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒(批号分别为WXBD5583V、12190801、SLCK0288,美国Sigma 公司),胎牛血清、双抗(批号分别为2173968CP、2321126,美国Gibco 公司),甲基三氯硅烷(methyltrichlorosilane,MTS)(批号474372,美国Promega 公司),小鼠白细胞介素-6(interleukin-6,IL-6)、TNF-α 酶联免疫吸附检测试剂盒(批号分别为2105251、2110261,上海西塘生物科技有限公司),一氧化氮(nitric oxide,NO)试剂盒(批号120320210414,上海碧云天生物技术有限公司),人TNF-α、RANKL、M-CSF(批号分别为021825、0319233、0419245,美国Peprotech 公司),Annexin V-FITC 细胞凋亡检测试剂盒(批号为021921210512,上海碧云天生物技术有限公司),TRNzol Universal Reagent(批号为W9623,北京天根科技生物公司),cDNA 合成反转录试剂盒、FastStart Universal SYBR Green Master(ROX)(批号分别为54746820、57313500,瑞士Roche 公司),定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)引物(上海生工生物工程股份有限公司)。马钱子碱、士的宁、人参皂苷Rb1(批号分别为110706-200505、110705-200306、110704-201827,质量分数分别为95.9%、97.0%、91.2%,中国药品生物制品检定所),阿魏酸、牛膝皂苷D、次黄嘌呤(批号分别为L03A9D57744、S04GB159770、T13J11X107944,质量分数分别为≥98%、≥94%、≥98%,上海源叶生物科技有限公司),党参炔苷、白术内III、茯苓酸、丹参素、丹参酮IIA、丹酚酸B、迷迭香酸、三七皂苷R1、人参皂苷Rg1、藁本内酯、蜕皮甾酮、甘草次酸、甘草苷(批号分别为MUST-21061005、MUST-20110611、MUST-18072910、MUST-18060920、MUST-17101811、MUST-21030110、MUST-18053110、MUST-21011910、MUST-20110810、MUST-21090104、MUST-21060110、MUST-21030707、MUST-21052114,质量分数分别为99.57%、99.97%、98.31%、98.38%、99.33%、98.60%、99.02%、98.12%、99.16%、≥98%、99.12%、99.10%、99.16%,成都曼斯特生物科技有限公司)。
1.3 细胞来源及培养
小鼠单核巨噬细胞系RAW264.7,购自中国科学院上海生命科学院研究院,于DMEM 高糖完全培养基(含1%双抗和10%胎牛血清)置37 ℃、5%CO2细胞培养箱中培养,2~3 d 传代1 次。人类风湿关节炎成纤维样滑膜细胞RA-HFLS,购自赛百慷(上海)生物技术股份有限公司,于DMEM/F12 完全培养基(含1%双抗和10%胎牛血清)置37 ℃、5% CO2细胞培养箱中培养,2~3 d 传代1 次。
2 方法
2.1 痹祺胶囊及单体化合物抗炎药效实验
2.1.1 供试液的制备 精确称取痹祺胶囊粉末100 mg,加入1 mL DMSO 超声提取30 min,离心后过0.2 μm 的滤膜,得到质量浓度为100 mg/mL 的高浓度储存液。精确称取适量马钱子碱、士的宁、党参炔苷、白术内酯Ⅲ、茯苓酸、丹参素、丹参酮ⅡA、丹酚酸B、迷迭香酸、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、阿魏酸、藁本内酯、蜕皮甾酮、牛膝皂苷D、次黄嘌呤、甘草次酸、甘草苷对照品,加入一定量DMSO 同法配制成浓度为100 mmol/L 的高浓度储存液,经梯度稀释得到供试溶液。
2.1.2 对RAW264.7 细胞存活率的影响 取对数生长期的RAW264.7 细胞以2×105个/mL 均匀接种于96 孔板,于37 ℃、5% CO2培养箱孵育过夜。加入含不同浓度痹祺胶囊(4、20、100、200、500 μg/mL)或单体化合物(1、10、50、100 μmol/L)的培养基处理细胞,同时设对照组,继续培养24 h 后每孔加20 μL MTS 溶液置于培养箱孵育2 h,测孔板490 nm处的吸光度值,计算细胞存活率。
2.1.3 对NO、TNF-α 及IL-6 含量的影响 取对数生长期的RAW264.7 细胞以2×105个/mL 均匀接种于96 孔板,于37 ℃、5% CO2培养箱孵育过夜后吸去上清,按实验分组,每组设3 个复孔,空白组每孔加入100 μL 含2%血清的DMEM,模型组加入100 μL 终质量浓度为0.1 μg/mL 的LPS,阳性药地塞米松组加入100 μL 终浓度为100 μmol/L 地塞米松和0.1 μg/mL LPS 的混合溶液,痹祺胶囊组每孔加入100 μL 终质量浓度为200、20、2 μg/mL 的痹祺胶囊与0.1 μg/mL LPS 混合溶液,马钱子碱、士的宁、党参炔苷、白术内酯III、茯苓酸、丹参素、丹酚酸B、迷迭香酸、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、阿魏酸、蜕皮甾酮、牛膝皂苷D、次黄嘌呤、甘草苷给药组分别加入100 μL 终浓度为100、10、1 μmol/L 供试品和0.1 μg/mL 的LPS 混合溶液,丹参酮IIA、甘草次酸溶液给药组分别加入100 μL 终浓度为50、10、2 μmol/L 供试品和0.1 μg/mL的LPS 混合溶液,藁本内酯给药组分别加入100 μL终浓度为10、2、0.4 μmol/L 供试品和0.1 μg/mL 的LPS 混合溶液。各组细胞处理后,置于37 ℃、5%CO2培养箱中培养24 h。收集细胞培养上清液,用试剂盒检测NO、TNF-α、IL-6 的含量,具体实验步骤参照试剂盒说明书。
2.2 痹祺胶囊及单体化合物对破骨细胞分化的影响
2.2.1 对破骨细胞形成的影响 取生长至80%~90%的RAW264.7 细胞,以5×103/孔的密度接种于24 孔板,8 h 后(已贴壁)吸去原培养基,按实验分组,每组设3 个复孔,空白组每孔加入500 μL DMEM 完全培养基,模型组加入500 μL 含100 ng/mL RANKL、30 ng/mL M-CSF 的DMEM 完全培养基,痹祺胶囊组每孔加入500 μL 终质量浓度为200、100、50 μg/mL 的痹祺胶囊及100 ng/mL RANKL、30 ng/mL M-CSF 的DMEM 完全培养基;马钱子碱、士的宁、党参炔苷、白术内酯III、茯苓酸、丹参素、丹酚酸B、迷迭香酸、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、阿魏酸、蜕皮甾酮、牛膝皂苷D、次黄嘌呤、甘草苷组每组加入500 μL终浓度为100、10 μmol/L 的供试品及100 ng/mL RANKL、30 ng/mL M-CSF 的DMEM 完全培养基,丹参酮IIA、甘草次酸组每组加入500 μL 终浓度为50、5 μmol/L 的供试品及100 ng/mL RANKL、30 ng/mL M-CSF 的DMEM 完全培养基,藁本内酯组每组加入100 μL 终浓度为10、1 μmol/L 的供试品及100 ng/mL RANKL、30 ng/mL M-CSF 的DMEM完全培养基。各组细胞处理后于培养箱孵育,隔天换液,共培养5 d 后,进行TRAP 染色,根据TRAP染色试剂盒说明书进行实验操作。
2.2.2 对破骨细胞形成相关基因TRAP、组织蛋白酶K(cathepsin K,CTSK)表达的影响 取对数生长期RAW264.7 细胞,接种于6 孔板,于37 ℃,5% CO2的培养箱中孵育8 h 后,选取对破骨细胞分化有显著抑制作用的化合物,按照“2.2.1”项下进行分组和给药,培养24 h,隔天换液,培养至第5天采用TRIZOL 法提取细胞总RNA 后,测定RNA浓度,按照反转录试剂盒说明书将RNA 反转为cDNA,于荧光定量PCR 仪上检测TRAP、CTSK的mRNA 相对表达量。引物序列见表1。

表1 TRAP、CTSK 引物序列Table 1 Primer sequences of TRAP and CTSK
2.3 痹祺胶囊及单体化合物对TNF-α 诱导的RAHFLS 细胞增殖和凋亡的影响
2.3.1 对TNF-α 诱导的RA-HFLS 细胞增殖的影响取生长至80%~90%的RA-HFLS 细胞,调整细胞密度为1×104个/孔均匀接种于96 孔板,于37 ℃、5% CO2培养箱孵育24 h 后给药处理,实验设置空白组,每孔加100 μL 完全培养基;模型组每孔加含10 ng/mL TNF-α 的完全培养基;痹祺胶囊组每孔加入100 μL 终质量浓度为1000、500、250 μg/mL 的痹祺胶囊和10 ng/mL 的TNF-α 混合溶液;马钱子碱、士的宁、党参炔苷、白术内酯III、茯苓酸、丹参素、丹参酮IIA、丹酚酸B、迷迭香酸、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、阿魏酸、藁本内酯、蜕皮甾酮、牛膝皂苷D、次黄嘌呤、甘草次酸、甘草苷组每孔加入100 μL 终浓度为100、10、1 μmol/L 的供试品和10 ng/mL 的TNF-α 混合溶液。给药后于37 ℃、5% CO2培养箱中培养24 h,每孔加入20 μL MTS,37 ℃,5% CO2的环境下孵育2 h后于490 nm 下检测吸光度值,计算细胞存活率。
2.3.2 流式细胞术检测细胞凋亡 取对数生长期RA-HFLS 细胞,调整细胞密度为1×105个/mL,接种于12 孔板,置于37 ℃,5% CO2的培养箱中孵育24 h 后,设对照组和给药组,对照组加入1 mL含10 ng/mL TNF-α 的完全培养基,给药组加入1 mL质量浓度分别为1000、500、250 μg/mL 的痹祺胶囊或不同浓度的待测化合物(除藁本内酯和甘草次酸浓度设为50、5 μmol/L 外,其余化合物浓度均设为为100、10 μmol/L)与10 ng/mL 的TNF-α 混合溶液,培养24 h 后,将所有细胞转移至离心管内,1000 r/min 离心3 min,弃上清,取一定量细胞加入195 μL Annexin VFITC 结合液,混匀后加入5 μL Annexin V-FITC 以及10 μL 碘化丙啶染色液,室温避光孵育20 min 后用流式细胞仪检测细胞凋亡状况。
2.3.3 对RA-HFLS 细胞基质金属蛋白酶-3(Matrix metalloproteinases-3,MMP-3)、RANKL基因表达的影响 取对数生长期RA-HFLS 细胞,接种于6 孔板,于37 ℃,5% CO2的培养箱中孵育24 h 后,按实验分组给药,空白组加入2 mL 完全培养基,模型组加入2 mL 含10 ng/mL TNF-α 的完全培养基,各给药组加入不同浓度的供试品溶液(浓度设置同“2.3.2”项下)与10 ng/mL 的TNF-α 混合溶液,培养24 h,按照TRIZOL 法提取细胞总RNA 后,测定RNA 浓度,按照反转录试剂盒说明书将RNA 反转为cDNA,于荧光定量PCR 仪上检测MMP-3、RANKL的mRNA 相对表达量。引物序列见表2。

表2 MMP-3、RANKL 引物序列Table 2 Primer sequences of MMP-3 and RANKL
2.4 统计分析
3 结果
3.1 痹祺胶囊及单体化合物对LPS 诱导RAW264.7细胞炎症反应的影响
3.1.1 对RAW264.7 细胞存活率的影响 如图1-A 所示,痹祺胶囊质量浓度低于200 μg/mL 时,细胞存活率与空白组相比无显著性差异,因此,后续实验痹祺胶囊最大质量浓度设为200 μg/mL。19 个化合物不同浓度下对RAW264.7 细胞存活率的影响如图1-B、C所示,丹参酮IIA和甘草次酸溶液浓度为100 μmol/L时细胞存活率显著低于空白组(P<0.001),藁本内酯溶液浓度高于50 μmol/L 时细胞存活率显著低于空白组(P<0.001),其余16 个化合物在1~100 μmol/L 对RAW264.7 细胞增殖均无显著影响。因此,丹参酮IIA和甘草次酸活性检测最大浓度设为50 μmol/L,藁本内酯活性检测最大浓度设为10 μmol/L,其余16 个化合物活性检测最大浓度设为100 μmol/L。
3.1.2 对LPS 诱导RAW264.7 细胞炎症反应的影响结果如图2、3 所示,LPS 作用于细胞后,细胞上清液中的NO、TNF-α 和IL-6 分泌量明显增加,与空白组比较有显著性差异(P<0.001),阳性药地塞米松给药浓度为100 μmol/L 时能显著抑制NO、TNF-α 和IL-6的释放(P<0.001)。与模型组比较,除2 μg/mL 痹祺胶囊对细胞上清液中TNF-α 的分泌量无显著差异外,各浓度痹祺胶囊能明显降低细胞上清液中的NO、TNF-α 和IL-6 含量(P<0.05、0.001),并且呈剂量相关性。与模型组比较,0.4 μmol/L 藁本内酯对细胞上清中NO 的释放无显著抑制作用;低浓度士的宁和丹参素、低浓度和中浓度马钱子碱和人参皂苷Rg1以及3 个浓度党参炔苷给药组细胞上清液中TNF-α 的含量无显著性差异;低浓度次黄嘌呤和牛膝皂苷D,低浓度和中浓度士的宁、白术内酯III、茯苓酸和丹参素以及3 个浓度丹参酮IIA、甘草次酸和藁本内酯给药组细胞上清液中IL-6 的含量无显著性差异,其他单体化合物在高、中、低浓度时对细胞上清液中NO、TNFα 和IL-6 的含量均有显著性抑制作用(P<0.05、0.01、0.001),并且呈现剂量相关性。
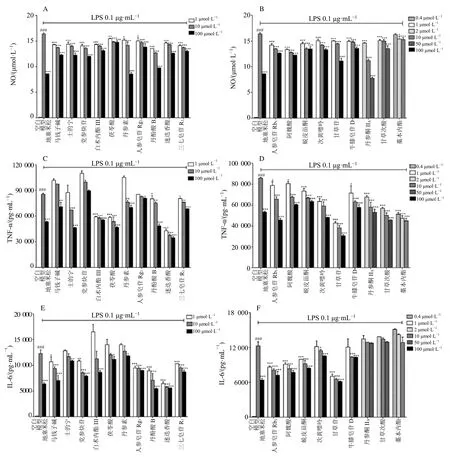
图3 单体化合物对RAW264.7 细胞上清液中NO (A、B)、TNF-α (C、D) 和IL-6 (E、F) 释放的影响 (±s , n=3)Fig.3 Effects of monomer compounds on release of NO (A, B), TNF-α (C, D) and IL-6 (E, F) in supernatant of RAW264.7 cells(±s , n=3)
3.2 痹祺胶囊及单体化合物对RAW264.7 细胞分化为破骨细胞的抑制作用
3.2.1 对破骨细胞形成的影响 通过对各组RAW264.7 细胞进行TRAP 染色,研究痹祺胶囊及19个单体化合物对RANKL 和M-CSF 诱导RAW264.7细胞分化为破骨细胞的影响。从图4 可以看出,空白组中没有观察到破骨细胞分化,而添加RANKL和M-CSF 的模型组破骨细胞数显著增多(P<0.001),说明模型建立成功。与模型组相比,痹祺胶囊各浓度均能显著抑制破骨细胞分化的数量(P<0.05、0.01、0.001),且呈剂量相关关系。如表3 所示,与模型组相比,阿魏酸和丹参酮IIA低浓度给药组,白术内酯III、蜕皮甾酮、次黄嘌呤和牛膝皂苷D 低浓度和高浓度给药组破骨细胞数均无显著性差异,其余化合物低浓度和高浓度给药组均能显著抑制破骨细胞的分化,破骨细胞数显著减少(P<0.05、0.01、0.001),且呈剂量相关性。
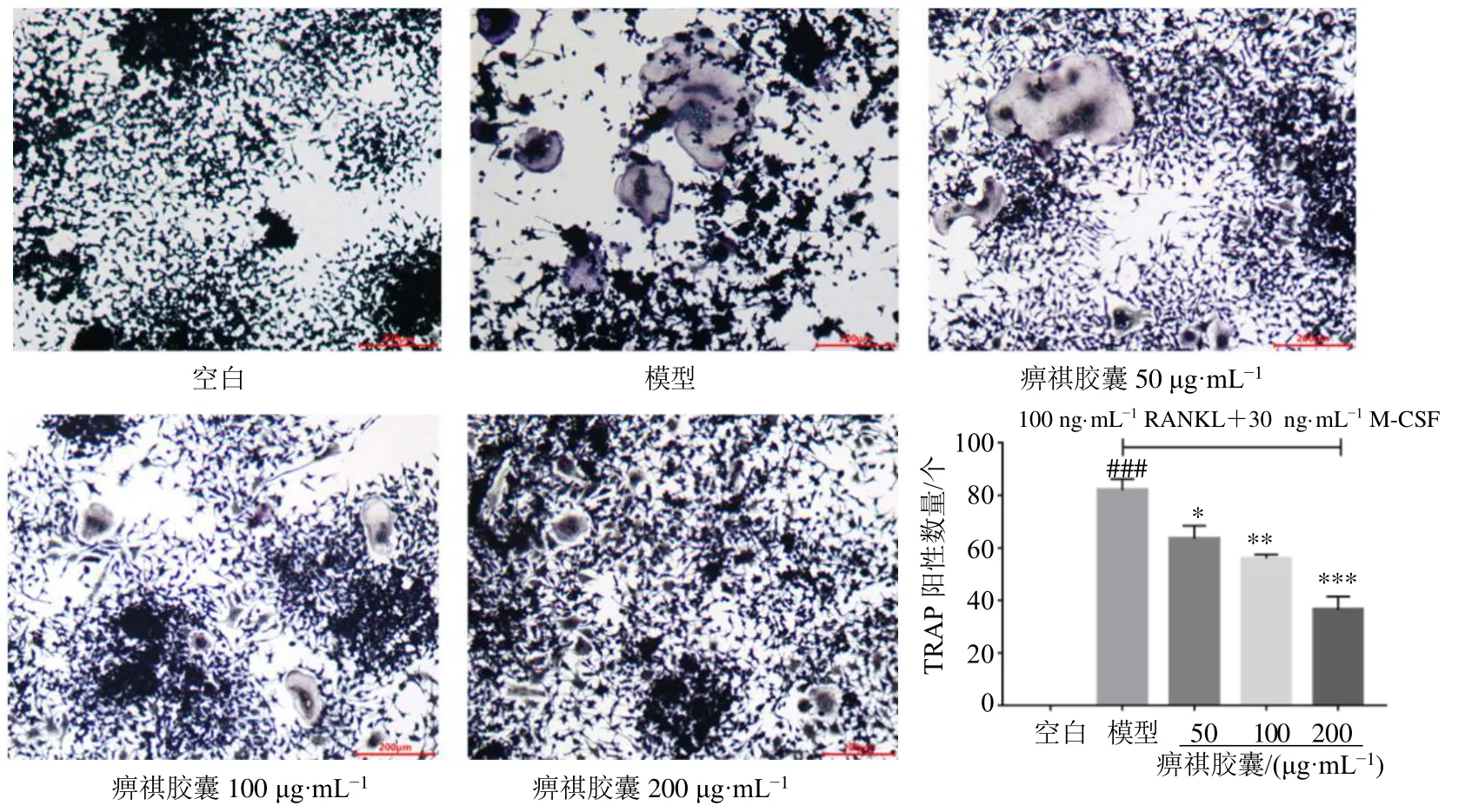
图4 痹祺胶囊对RAW246.7 细胞分化为破骨细胞的影响 (×500,±s , n=3)Fig.4 Effects of Biqi Capsules on differentiation of RAW246.7 cells into osteoclasts (× 500,±s , n=3)
表3 不同浓度化合物给对RAW246.7 细胞分化为破骨细胞的影响 (±s , n=3)Table 3 Effects of compounds on differentiation of RAW246.7 cells into osteoclasts (±s , n=3)

表3 不同浓度化合物给对RAW246.7 细胞分化为破骨细胞的影响 (±s , n=3)Table 3 Effects of compounds on differentiation of RAW246.7 cells into osteoclasts (±s , n=3)
与空白组比较:###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001###P < 0.001 vs blank group; *P < 0.05 **P < 0.01 ***P < 0.001 vs model group
组别 浓度/(μmol·L−1) 破骨细胞数/个 组别 浓度/(μmol·L−1) 破骨细胞数/个空白 — 0 三七皂苷R1 100 15.5±2.1***模型 — 91.5±3.5### 10 20.0±1.4***藁本内酯 10 7.0±1.4*** 人参皂苷Rg1 100 51.5±3.5***1 55.5±5.0** 10 66.0±2.8**马钱子碱 100 39.0±2.8** 人参皂苷Rb1 100 56.5±2.1***10 63.0±5.7* 10 69.5±2.1**士的宁 100 33.0±2.8*** 阿魏酸 100 77.0±2.8*10 50.5±3.5** 10 88.0±1.4党参炔苷 100 52.0±2.8** 蜕皮甾酮 100 83.5±2.1 10 71.0±5.7* 10 87.5±3.5白术内酯Ⅲ 100 89.5±2.1 次黄嘌呤 100 86.0±1.4 10 90.0±4.2 10 89.0±1.4茯苓酸 100 45.0±4.2** 甘草苷 100 7.0±1.4***10 63.5±4.9* 10 65.5±3.5**丹参素 100 13.5±2.1*** 牛膝皂苷D 100 82.5±4.9 10 37.0±2.8*** 10 89.5±3.5丹酚酸B 100 18.5±2.1*** 丹参酮ⅡA 50 7.0±1.4***10 61.0±2.8** 5 74.0±7.1迷迭香酸 100 16.0±1.4*** 甘草次酸 50 6.0±1.4***10 57.0±4.2** 5 77.5±3.5*
3.2.2 对破骨细胞形成相关基因TRAP、CTSK表达的影响 如图5、6 所示,RAW264.7 细胞与RANKL和M-CSF 共孵育后,与空白组相比,破骨细胞标志性基因CTSK和TRAP表达量显著升高(P<0.001),痹祺胶囊各浓度给药处理后CTSK和TRAP的基因表达量均显著减少(P<0.001),且呈剂量相关性。与模型组相比,马钱子碱、党参炔苷、丹酚酸B、人参皂苷Rg1和藁本内酯低浓度给药组CTSK基因相对表达量无显著性差异,丹酚酸B 低浓度给药组TRAP基因相对表达量无显著性差异,其余化合物低浓度和高浓度给药组CTSK、TRAP基因均显著降低(P<0.05、0.01、0.001),且呈剂量相关性。
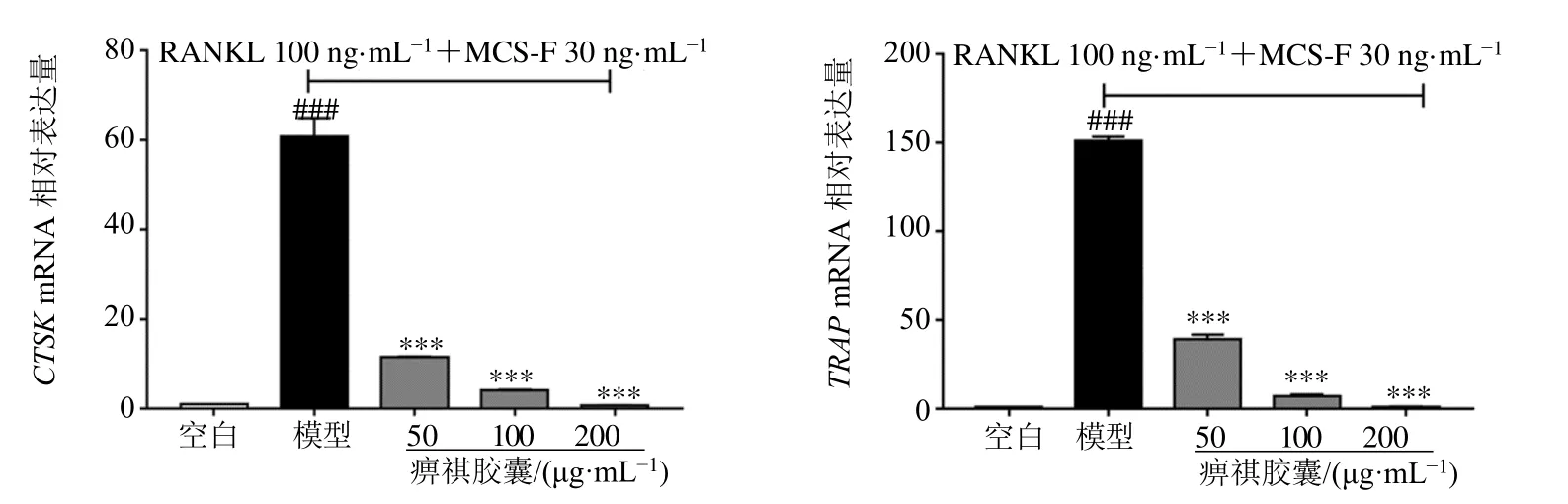
图5 痹祺胶囊对RAW264.7 细胞与RANKL 和M-CSF 共孵育后CTSK、TRAP mRNA 表达的影响 (±s , n=3)Fig.5 Effect of Biqi Capsules on mRNA expression of CTSK and TRAP in RAW264.7 cells after co-incubation with RANKL and M-CSF (±s , n=3)

图6 13 个化合物对RAW264.7 细胞与RANKL 和M-CSF 共孵育后CTSK、TRAP mRNA 表达的影响 (±s , n=3)Fig.6 Effects of 13 compounds on mRNA expression of CTSK and TRAP in RAW264.7 cells after co-incubation with RANKL and M-CSF (±s , n=3)
3.3 痹祺胶囊及单体化合物对TNF-α 诱导RAHFLS 细胞增殖和凋亡的影响
3.3.1 对TNF-α 诱导的RA-HFLS 细胞增殖的影响痹祺胶囊及19 个单体化合物对TNF-α 诱导的RAHFLS 细胞增殖活性影响结果如图7、8 所示。与空白组相比,TNF-α 诱导后细胞增殖能力显著增高(P<0.001),表明造模成功。痹祺胶囊在3 个给药浓度下均能显著降低TNF-α 诱导的细胞增殖活性(P<0.05、0.01、0.001),且呈剂量相关性。与模型组相比,马钱子碱、士的宁、丹参素、阿魏酸、藁本内酯、次黄嘌呤在3 个给药浓度下均能显著降低TNFα 诱导的细胞增殖活性(P<0.05、0.01、0.001),丹参酮IIA、人参皂苷Rb1、甘草次酸、牛膝皂苷D 在高浓度和中浓度下能显著降低TNF-α诱导的细胞增殖活性(P<0.05、0.01、0.001),三七皂苷R1、人参皂苷Rg1和蜕皮甾酮仅在高浓度给药时显著降低TNF-α 诱导的细胞增殖活性(P<0.01、0.001),其中藁本内酯、甘草次酸在100 μmol/L 浓度下有很强的抑制活性,细胞存活率均低于50%,因此后续实验最大浓度设为50 μmol/L,其余化合物抑制细胞增殖活性不明显。
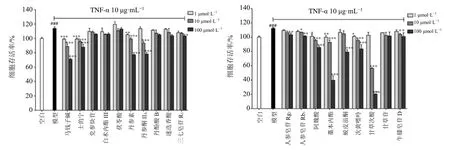
图8 不同浓度单体化合物对TNF-α 诱导的RA-HFLS 细胞增殖的影响 (±s , n=3)Fig.8 Effects of different concentrations of monomer compounds on TNF-α-induced RA-HFLS cell proliferation(±s , n=3)
3.3.2 痹祺胶囊及单体化合物对TNF-α 诱导的RAHFLS 细胞凋亡的影响 通过流式细胞仪检测痹祺胶囊及抑制细胞增殖活性较好的9 个单体化合物对RA-HFLS 细胞凋亡的影响,结果如图9、10 所示。与对照组相比,痹祺胶囊高浓度和中浓度给药组均能显著促进RA-HFLS 细胞的凋亡(P<0.05、0.001),且呈剂量相关关系。与对照组相比,马钱子碱、士的宁、丹参素、阿魏酸、藁本内酯、次黄嘌呤、丹参酮IIA、蜕皮甾酮、甘草次酸在低浓度和高浓度给药时均能明显促进RA-HFLS 细胞的凋亡(P<0.05、0.01、0.001)。

图9 不同浓度痹祺胶囊对TNF-α 诱导的RA-HFLS 细胞凋亡的影响 (±s , n=3)Fig.9 Effects of Biqi Capsules at different concentrations on TNF-α-induced apoptosis of RA-HFLS cells (±s , n=3)
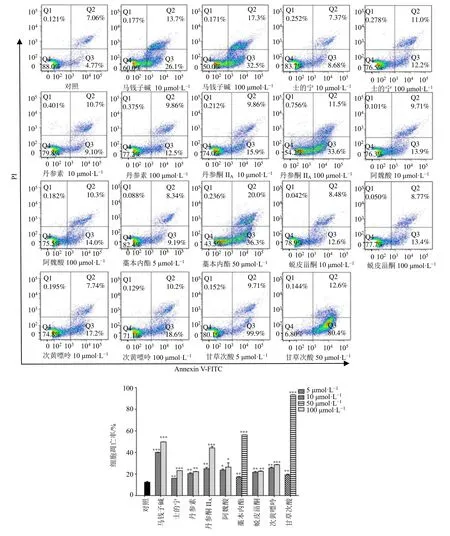
图10 不同浓度单体化合物对TNF-α 诱导的RA-HFLS 细胞凋亡的影响 (±s , n=3)Fig.10 Effects of different concentrations of compounds on TNF-α-induced apoptosis of RA-HFLS cells (±s , n=3)
3.3.3 对TNF-α 诱导的RA-HFLS 细胞MMP-3、RANKL基因表达的影响 痹祺胶囊及9 个单体化合物对MMP-3和RANKL基因表达的影响结果如图11、12 所示。与空白组相比,TNF-α 作用于RAHFLS 细胞后MMP-3和RANKL基因的表达量显著升高(P<0.001)。与模型组相比,痹祺胶囊高、中、低浓度组MMP-3基因的表达量均显著减少(P<0.05、0.01、0.001),且呈剂量相关关系;痹祺胶囊高、中浓度也同样能显著抑制RANKL基因的表达(P<0.001),抑制活性随浓度的增大而升高。与模型组相比,马钱子碱、士的宁、丹参素、阿魏酸、蜕皮甾酮、次黄嘌呤和甘草次酸在高、低浓度给药时均能显著抑制MMP-3基因的表达(P<0.05、0.01、0.001),丹参酮IIA和藁本内酯在高浓度给药时显著抑制MMP-3基因的表达(P<0.001);马钱子碱、丹参素、阿魏酸、藁本内酯、次黄嘌呤和甘草次酸在高、低浓度给药后均能显著抑制RANKL基因的表达(P<0.05、0.01、0.001),士的宁、丹参酮IIA和蜕皮甾酮高浓度给药时对RANKL基因表达的抑制效果显著(P<0.001)。

图11 痹祺胶囊对TNF-α 诱导的RA-HFLS 细胞MMP-3、RANKL 基因表达的影响 (±s , n=3)Fig.11 Effects of Biqi Capsules on TNF-α-induced expression of MMP-3 and RANKL in RA-HFLS cells (±s , n=3)
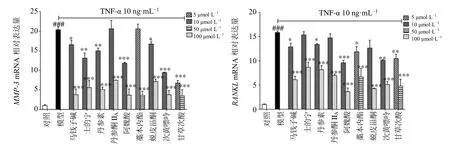
图12 单体化合物对TNF-α 诱导的RA-HFLS 细胞MMP-3、RANKL 基因表达的影响 (±s , n=3)Fig.12 Effects of compounds on TNF-α-induced expression of MMP-3 and RANKL in RA-HFLS cells (±s , n=3)
4 讨论
RA 是一种由自身免疫功能障碍引起的疾病,具体以关节病变为主,常伴有其他脏器功能受损的慢性炎症疾病。RA 患者的主要症状是滑膜增生、关节窝炎性细胞浸润、关节破坏、严重者功能丧失等,其特征是手、腕及对称足关节炎症[14]。目前RA的发病机制尚不明确,但多数研究认为T 淋巴细胞及巨噬细胞释放大量炎性细胞因子如TNF-α、白细胞介素-1β(interleukin-1β,IL-1β)和IL-6 等引起骨关节破坏是RA 发病的主要机制[15-16]。除了T细胞及巨噬细胞外,成纤维样滑膜细胞(fibroblastlikesynoviocytes,FLS)是RA 中引起滑膜炎症病变及关节破坏的主要效应细胞[17],炎症反应产生的大量TNF-α 在RA 患者滑液、血清、关节滑膜等组织中表达异常升高,且一定浓度的TNF-α 能刺激FLS 大量增殖并分泌炎性细胞因子(IL-6、TNFα 等)、成纤维细胞生长因子(fibroblast growth factor,FGF)、趋化因子、MMPs 等,进一步导致局部炎症反应、滑膜细胞增殖与凋亡平衡失调、血管翳生成、软骨破坏及骨侵蚀[18]。FLS 的过度增殖使其通过类肿瘤细胞样方式侵蚀组织,是RA 滑膜炎及最终导致骨破坏的重要机制[19-20]。关节骨质破坏是关节畸形的重要因素,而破骨细胞是引起骨破坏的关键细胞之一,破骨细胞是体内唯一负责吸收骨质的巨大多核细胞,其起源于骨髄单核-巨噬细胞谱系细胞,由单核前体细胞通过多种方式融合而形成[21],受M-CSF 和RANKL 2 个细胞因子调控。M-CSF 结合其受体巨噬细胞集落刺激因子受体(macrophage-stimulating factor receptor,c-Fms),在加快破骨细胞分化中具有重要的生物学功能[22]。RANKL 结合破骨细胞前体细胞或者破骨细胞的膜蛋白RANK,可激活一系列下游信号通路,促进破骨细胞分化[23-24]。另外,滑膜大量的炎症因子,如TNF-α 可促进破骨细胞生成和提高活性,最终使骨重建的天平失衡,介导骨破坏。因此,抑制破骨细胞的生成和功能,有助于改善RA 的病程发展[25]。
本研究利用LPS 刺激RAW264.7 细胞作为炎症模型,对痹祺胶囊及19 个关键化学成分的抗炎活性进行验证,结果表明痹祺胶囊及马钱子碱、士的宁、党参炔苷、白术内酯III、茯苓酸、丹参素、丹参酮IIA、丹酚酸B、迷迭香酸、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、阿魏酸、藁本内酯、蜕皮甾酮、牛膝皂苷D、次黄嘌呤、甘草次酸、甘草苷19 个成分均表现出显著的抗炎活性,均能显著抑制LPS 诱导的细胞内NO、TNF-α、IL-6 的释放,因此推测,该19 个单体成分可能为痹祺胶囊发挥抗炎作用的关键药效物质基础。进一步通过体外小鼠单核巨噬细胞 RAW264.7 与 M-CSF 和RANKL 因子共培养,建立体外破骨细胞分化模型,探究痹祺胶囊及19 个单体化合物对破骨细胞分化的抑制作用,TRAP 染色结果表明痹祺胶囊及马钱子碱、士的宁、党参炔苷、茯苓酸、丹参素、丹酚酸B、迷迭香酸、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1、藁本内酯、甘草次酸和甘草苷13 个化合物均能显著抑制破骨细胞的分化,其作用可能是通过抑制破骨细胞发挥骨吸收作用的关键靶标酶CTSK和TRAPmRNA 的相对表达实现的[26-27],因此推测该13 个单体成分是痹祺胶囊抑制破骨细胞分化的关键药效物质基础。通过建立TNF-α 诱导的RA-HFLS 细胞增殖模型检测痹祺胶囊及19个单体化合物对RA-HFLS 细胞增殖和凋亡的影响,结果表明痹祺胶囊及马钱子碱、士的宁、丹参素、丹参酮IIA、阿魏酸、藁本内酯、蜕皮甾酮、次黄嘌呤和甘草次酸9 个化合物对RA-HFLS 细胞的增殖均有显著的抑制作用,进一步流式细胞检测结果表明痹祺胶囊和9 个化合物均能不同程度促进细胞的凋亡,且均能显著抑制RA-HFLS 细胞中参与骨破坏相关因子MMP-3和RANKL基因的表达[28-29],因此推测该9 个化合物是痹祺胶囊中发挥抑制滑膜增生作用的药效物质基础。
利益冲突 所有作者均声明不存在利益冲突

