不同堆积醅对芝麻香型白酒发酵过程中主要微生物演替及代谢的影响
贾一清,孙 昭,廖博曦,陈建新*
( 1.江南大学 生物工程学院,江苏 无锡 214100;2.江南大学 粮食发酵与食品生物制造国家工程研究中心,江苏 无锡 214100;3.无锡市玉祁酒业有限公司,江苏 无锡 214100)
芝麻香型白酒在中国白酒传统工艺的基础上,汲取了酱香型的高温堆积[1]、高温发酵,清香型的清蒸清吊,浓香型的续糟发酵等特点,经过不断地实践总结与理论研究,形成了与自身风格特征相对应的独特工艺特征[2]。此外,其生产的工艺流程一般包括高温润粮、蒸煮摊凉、醅料混匀、堆积及入窖发酵等[3]。在堆积发酵阶段,各类微生物在营养丰富的条件下代谢消长,并且微生物与其代谢产生的各种酶类[4]共同作用生成更多的底物及风味成分的前体物质[5],为窖池发酵创造有利条件。
堆积发酵时,微生物活动会使糟醅的温度上升,表层堆积醅接触空气多散热快,利于好氧且不耐高温微生物的生长代谢,中下层糟醅的高温微氧或无氧环境适合厌氧且耐高温微生物的生长。同时,随着堆积时间增加,表层醅料开始出现白色的菌膜并不断增加,中下层醅料中白色斑点较少。高传强[2]研究表明,表层醅出现的白色菌膜,是一个复杂的微生物区系,由多种微生物组成,其中酵母菌占大多数。白酒发酵过程是多种微生物协同发酵、相互作用和群落演替的过程,主要包含酵母、细菌、霉菌三大功能微生物体系,芽孢杆菌和乳酸杆菌是主要的细菌属[6],酵母属是乙醇的主要贡献者[7],霉菌主要产生降解酶,如淀粉酶等[8-10],这对原料中淀粉降解为还原糖的过程具有重要作用。
对于堆积发酵酒醅,李一关等[11-12]研究发现,不同位置取样入窖发酵后的酒精度和风味物质有明显差异。张红霞[13]也指出,功能微生物菌群的演替方向带有不确定性,研究白酒发酵过程中具有群落调节功能的微生物,将有助于明晰发酵过程中微生物相互作用的本质,对保证白酒发酵系统生产性能和稳定性具有重要作用。入窖前的糟醅状态即菌体浓度、初始菌群比例和底物情况对窖池发酵过程有重要影响,实现影响白酒窖池发酵前期的微生物因素的人为调控具有一定的可行性。因此,本研究以芝麻香型白酒发酵过程为重点,把握在窖池发酵前期产生的影响,探究主要微生物的相互作用与初始菌株的分布、料醅比、酒醅糖化力或淀粉的老化的相关性,以期揭示初始条件对芝麻香型白酒关键微生物群落的演替及代谢的影响,为解决生产实践中出现的问题提供理论依据。
1 材料与方法
1.1 材料与试剂
原料(堆积48 h的酒醅样品、预处理后的高粱颗粒、稻壳):无锡市玉祁酒业有限公司;盐酸、酒石酸钾钠、五水硫酸铜、酚酞、亚铁氰化钾、无水葡萄糖等(均为分析纯):国药集团化学试剂有限公司;氯化钠、氢氧化钠、磷酸二氢钾等(均为分析纯):上海泰坦科技股份有限公司;葡萄糖淀粉酶(酶活力260 000 U/mL):夏盛(北京)生物科技开发有限公司;OMEGA Soil DNA Kit(D5625-01)试剂盒:安诺伦(北京)生物科技有限公司。
1.2 仪器与设备
SPX-250B-Z生化培养箱:上海博讯实业有限公司医疗设备厂;FE20 pH计:梅特勒-托利多仪器有限公司;SWCJ-2FD超净工作台:苏州净化气团安泰公司;CT90A高压灭菌锅:上海伯能仪器有限公司;-70 ℃超低温冰箱:日本Sanoyo公司。
1.3 方法
1.3.1 样品处理
酒醅样品取回后及时进行实验,高粱颗粒和稻壳取回后真空密封,于4 ℃冷库保存。
1.3.2 实验方法
(1)酶液的配制以及固态发酵培养基的制备
酶液:取310 μL葡萄糖淀粉酶,加入10%的乙酸-乙酸钠缓冲液(pH为4.6),用无菌水定容至100 mL。
固态发酵培养基的制备:取预处理后的高粱颗粒600 g,加入约63 ℃的蒸馏水420 mL,混匀后润粮100 min,加入60 g稻壳(即高粱原料的10%)混匀后继续润粮20 min,随后蒸粮40 min,蒸粮完成后混匀摊凉至手摸不烫,备用。
(2)料醅的不同组合方式
将酒厂堆积48 h的酒醅样品分为全上层(表层0~3 cm白花较多的料醅)和中下层(距离表层25 cm取样)两部分,将1.3.2实验方法(1)中实验室制备的固态发酵培养基称为新粮,设置了全上层、全上层∶中下层=1∶6(g∶g)、全上层∶新粮=1∶6(g∶g)三种不同的组合;相同的组合设置加酶(加酶量为10%)和不加酶(加10%无菌水)两种,具体组合方式见表1。

表1 酒厂堆积48 h酒醅样品的不同组合方式Table 1 Different combinations of fermented grains samples stacking for 48 h in distillery
(3)发酵方式及取样时间点设定
发酵方式:将混匀后的酒醅样品装入200 mL灭菌的组培瓶中,装样量约为130 g,利用生化培养箱控温30 ℃模拟发酵过程,定时取样,混匀后放置-70 ℃冰箱留存。
根据白酒窖池发酵两个阶段的特征以及全上层样品的特异性,将全上层及其加酶样品取样时间设定为:1 d、2 d、3 d、4 d、5 d、6 d、10 d、15 d、23 d、30 d;其余样品:1 d、3 d、6 d、10 d、15 d、23 d、30 d。
(4)不同酒醅初始理化及微生物指标分析
酒厂的堆积样品中已经含有实验所需微生物,故未进行额外的接菌操作,取装瓶前的酒醅样品进行初始理化指标(淀粉含量、还原糖含量以及酸度)以及微生物指标(霉菌、酵母、细菌以及乳酸菌的数量)的测定,并根据初始微生物状态计算不同料醅比样品的接菌比例。
1.3.3 测定方法
(1)理化及微生物指标测定
理化指标:按照参考文献[14]的方法进行测定;微生物指标:根据T/CBJ 004—2018《固态发酵酒醅通用分析方法》[15]进行测定。
(2)酒醅样品基因组的提取与高通量测序
将酒醅样品采用自封袋分装后采用低温转运的方式委托上海派森诺生物科技有限公司进行Illumina NovaSeq高通量测序,采用OMEGA Soil DNA Kit(D5625-01)试剂盒提取样品总基因组DNA,聚合酶链式反应(polymerase chain reaction,PCR)扩增选用细菌16SrDNA V3-V4区特异性引物,338F(5'-barcode+ACTCCTACGGGAGGCAGCA-3'),806R(5'-GGACTACHVGGGTWTCTAAT-3')。
1.3.4 数据处理
每个试验均进行3次平行试验,试验结果采用“平均值±标准差”表示。运用Excel 2010和SPSS 27.0进行显著性分析;运用OriginPro 2018C绘图。参考谢丹等[16]的方法借助派森诺基因云平台对高通量测序结果进行多样性分析。
2 结果与分析
2.1 不同料醅初始理化及微生物指标
2.1.1 理化指标差异
不同酒醅组合初始理化指标分析结果见表2。由表2可知,不同料醅在入窖前的淀粉含量和还原糖含量均有显著差异(P<0.05),全上及其加酶样品、1∶6及其加酶样品淀粉含量低,还原糖含量高;1∶6X及其加酶样品的测定结果与之相反,还原糖含量仅为0.08 g/10 g酒醅。这是由于堆积过程中一部分淀粉质原料被霉菌分泌的糖化酶降解为还原糖,所以在入窖前有一定的还原糖积累,而实验室制备的固态发酵培养基尚未被微生物利用,所以淀粉含量高、还原糖含量低。
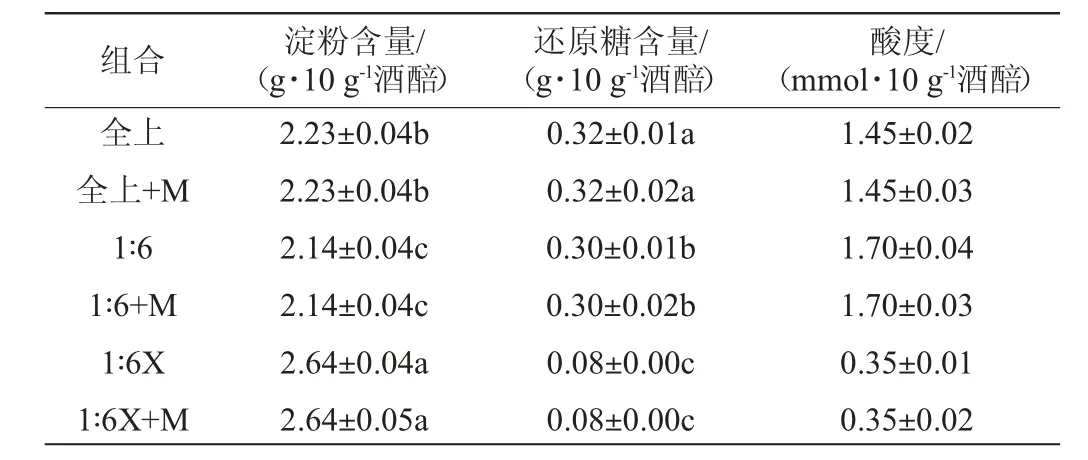
表2 不同酒醅组合初始理化指标分析结果Table 2 Determination results of initial physicochemical indexes of different combinations of fermented grains
另外,全上及其加酶样品的初始酸度约为1.45mmol/10g酒醅,低于1∶6及其加酶样品(1.70 mmol/10 g酒醅)。这是由于在堆积过程中,中下层样品处于微氧或厌氧状态,有利于酵母[17]、梭状芽孢杆菌[18]和乳酸菌[19]等微生物代谢产生酸性物质(如乙酸、乳酸、己酸等)。
2.1.2 微生物指标
不同酒醅组合初始微生物指标分析结果见表3。由表3可知,全上及其加酶样品初始微生物分布较均匀,1∶6及其加酶样品中酵母和乳酸菌较多,这是由于堆积酒醅中的氧气从外向内是一个逐渐减少的过程,不利于好氧微生物生命活动,随堆积时间增加,微生物活动剧烈,中心醅温度最高可达到50 ℃以上,除一部分耐高温微生物外,其余微生物不耐受此温度而失活[20]。此外,表层醅微生物代谢产生的热量可通过空气对流传热散失,可以使表层醅保持一个适宜微生物生长的环境。

表3 不同酒醅组合初始微生物指标分析结果Table 3 Determination results of initial microbiological indexes of different combinations of fermented grains
2.2 酒醅发酵过程中微生物数量变化
酒醅发酵过程中微生物数量变化见图1。由图1可知,在发酵前期(0~6 d),不同料醅比样品中的酵母菌和霉菌数量呈下降趋势,乳酸菌数量呈上升趋势且在成为优势菌株(约为[8.80~9.26 lg(CFU/g)],芽孢杆菌菌落数略有波动但整体保持稳定。当发酵进行到中期(6~15 d),酵母数量骤减且霉菌发酵10 d以后未能检出,此时细菌整体成为发酵的优势菌群,芽孢杆菌数量达到7.45~7.86 lg(CFU/g)或6.05~6.08 lg(CFU/g)(添加新粮的样品),乳酸菌数量虽然在发酵10~15 d略有降低,但菌体数量仍然可达到7.00~7.80 lg(CFU/g)。发酵后期(15~30 d)芽孢杆菌逐渐成为优势菌,发酵结束时数量为7.54~7.72 lg(CFU/g)或5.80 lg(CFU/g)(添加新粮的样品),乳酸菌在后期数量逐渐降低,最终数量为5.86~7.62 lg(CFU/g)。

图1 实验室模拟窖池发酵微生物生长情况Fig.1 Microbial growth in simulated pit fermentation in laboratory
入窖发酵时,全上及全上+M样品虽然在发酵过程中霉菌数量逐渐减少,但在发酵前期仍能维持较高浓度。这是因为发酵前期微生物对于有限底物的竞争抑制了酵母的乙醇代谢,而乳酸菌在这个阶段主要进行菌体生长,酸度产生速率较缓,所以霉菌在低乙醇低酸的条件下仍能维持一定浓度。
发酵前期1∶6及1∶6+M样品中乳酸菌的生长趋势较其他样品相比有显著差异(P<0.05)。这是由于中下层堆积酒醅中含有较多的乳酸,对乳酸菌的长产生抑制作用[21],同时较高的酵母初始含量也会在窖池发酵初期更有利于酵母通过糖酵解(Embden-Meyerh of-Parnas pathway,EMP)途径产生乙醇,从而影响该阶段其他微生物的生长代谢。
2.3 不同酒醅堆积发酵微生物多样性及群落结构分析
2.3.1 微生物多样性
由表4可知,全上层样品在发酵过程中物种丰富程度与系统发育多样性增加,各物种的相对丰度逐渐均匀,1∶6样品在发酵过程中与全上层酒醅呈现完全相反的现象,这可能是由于表层醅料在发酵过程中低酸低乙醇的环境不能抑制杂菌生长,而1∶6样品初始酸度高且初始酵母浓度高,在发酵过程中微生物的相互作用及代谢产物能有效抑制酒醅中的杂菌[22-23],具体原因尚不明晰,可进一步研究。
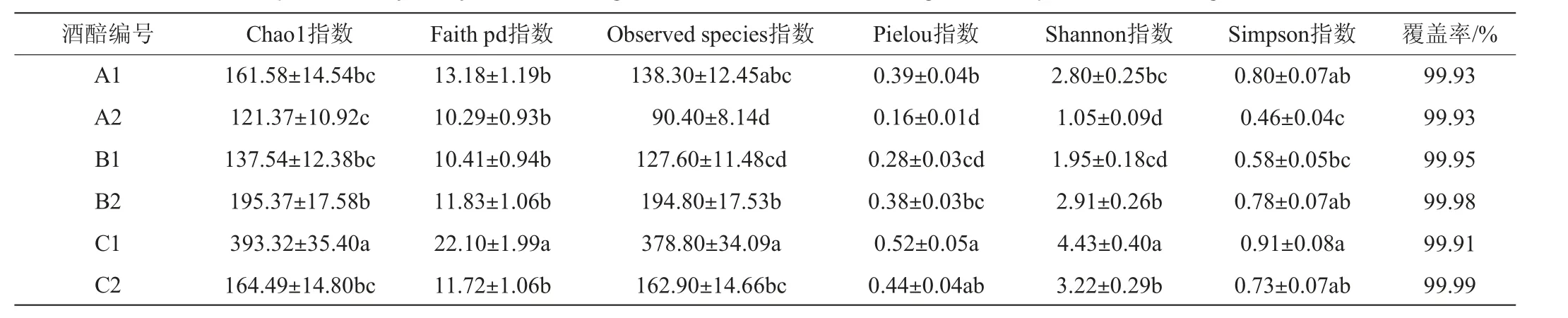
表4 不同酒醅样品堆积发酵微生物Alpha多样性分析Table 4 Alpha diversity analysis of microorganism of different fermented grains samples with stacking fermentation
2.3.2 不同酒醅样品堆积发酵菌群差异
由图2可知,实际工厂窖池发酵结束时上层样品丰度占比较高的为乳酸杆菌(Lactobacillus)(70.7%)和芽孢杆菌属(Bacillus)(27.6%),发酵结束时的中下层酒醅中Lactobacillus占比高达99.4%。不同堆积醅对于发酵过程中微生物演替的影响较大,在入窖发酵前,表层堆积醅中的优势细菌为Delftia、Ralstonia和Bacillus,相对丰度分别为48%、17.9%以及16.4%,1∶6样品中相对丰度超过10%的菌属为Lactobacillus(75.7%)、Bacillus(14.9%),发酵结束时,表层醅中的优势菌演变为Bacillus(34.8%)、Lactobacillus(28.8%)以及Delftia(15.0%),Ralstonia的相对丰度降至8.8%,1∶6样品中Lactobacillus的相对丰度上升至90.6%,Bacillus的相对丰度下降至3.8%。这是由于发酵初期窖池表层仍存在微量氧气,好氧菌仍能维持一定浓度,但随着发酵的进行,微生物的代谢产物逐渐下沉,下层发酵环境不利于好氧及耐酸性较差的微生物生长。
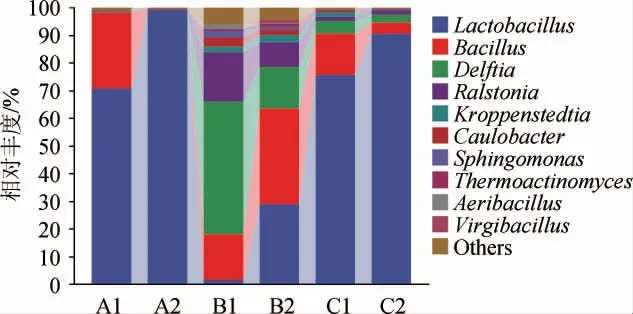
图2 不同酒醅样品堆积发酵中细菌在属水平上的相对丰度Fig.2 Relative abundance of bacteria at genus level of different fermented grains samples in stacking fermentation
2.4 底物产生及利用情况
由于霉菌的菌落形态会干扰平板计数结果,而霉菌在白酒发酵中的主要作用是分泌糖化酶,为发酵过程提供底物支持,所以通过测定酒醅的糖化力及还原糖含量来辅助体现不同初始状态对入窖后霉菌代谢的影响。由图3a可知,入窖发酵过程中糖化酶活逐渐下降,不同料醅比在发酵前期的糖化酶活变化趋势差异不显著(P>0.05),发酵中期全上层发酵样品糖化酶活变化与其他样品相比下降速度较缓,1∶6样品在发酵10 d时的糖化酶活降至最低点,这与表层醅可被降解的淀粉少、醅中微生物在厌氧条件下生命活动变缓有关。

图3 实验室模拟窖池发酵底物产生及利用情况Fig.3 Production and utilization of fermentation substrate in simulated pit in laboratory
由图3b可知,除1∶6X+M样品外,其余样品中还原糖含量均呈先下降(0~1 d),后上升(1~10 d),最后趋于稳定(10~30 d)的趋势。这是因为1∶6X+M样品的淀粉含量高、菌体浓度低以及初始的糖化酶活高,酒醅中还原糖的产生速率大于微生物对还原糖的消耗速率,所以该样品在整个窖池发酵过程中都处于底物充足的状态。蔡凤娇等[24]的研究表明,发酵过程中还原糖浓度先少量减小后增大,这是因为发酵前8 天微生物生长及产乙醇使还原糖消耗,8 d后,淀粉酶作用及大部分酵母菌衰亡的情况下,还原糖含量增大。
由表5可知,虽然各样品在初始发酵时的淀粉含量相差不大,但由于全上层酒醅在堆积过程中有一些淀粉发生老化导致可以被酶分解的底物减少,1∶6X中虽然可水解淀粉含量高但微生物分泌的糖化酶不能将其完全降解,所以当发酵至酒精度恒定时两者被微生物利用的淀粉量与其他样品相比有显著性差异(P<0.05)。
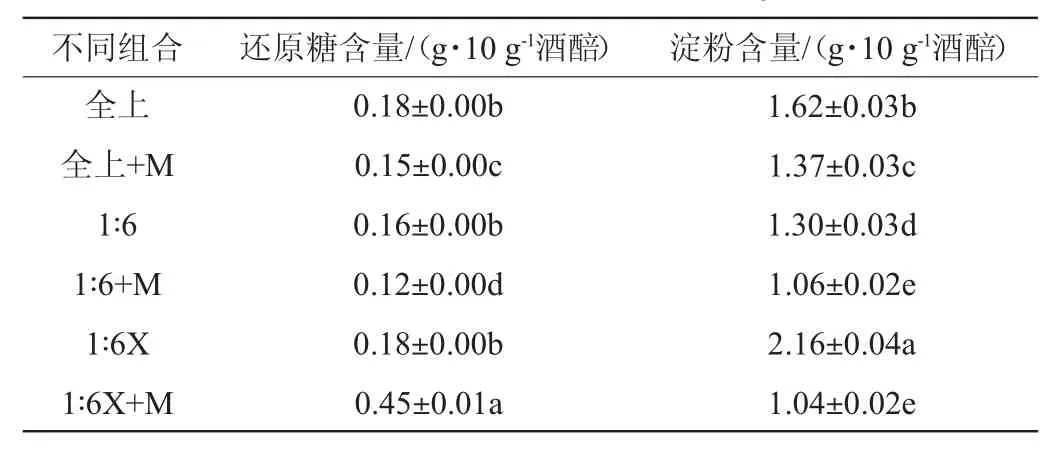
表5 酒精度达到稳定时酒醅中的还原糖及淀粉含量Table 5 Contents of reducing sugar and starch in fermented grains when the alcohol content reached stability
2.5 代谢产物情况
实验结果表明, 入窖后0~3 d为酒精发酵阶段,3~15 d为酸度产生阶段,发酵后期乙醇和酸度增长基本稳定,与宋瑞滨等[25]的研究结果基本一致。 由图4a及表6可知,不同料醅比、添加糖化酶能显著影响发酵结束时乙醇含量(P<0.05), 全上层酒醅样品发酵结束的乙醇含量仅为0.22 g/10 g酒醅,1∶6+M样品发酵结束时乙醇含量最高,为0.61 g/10 g酒醅。 这是由于全上层酒醅淀粉老化程度高、微生物数量多,导致在入窖发酵初期主要微生物对有限底物的竞争激烈,霉菌的生长代谢受到抑制,同时也阻碍了酵母的乙醇代谢,且较高的初始酸度会抑制酿酒酵母乙醇的生成[26]。 1∶6+M样品底物较为充足且酒醅中菌体浓度低,对于底物的竞争相对缓和,利于微生物的生长代谢。

图4 实验室模拟窖池发酵代谢产物情况Fig.4 Metabolites of simulated pit fermentation in laboratory
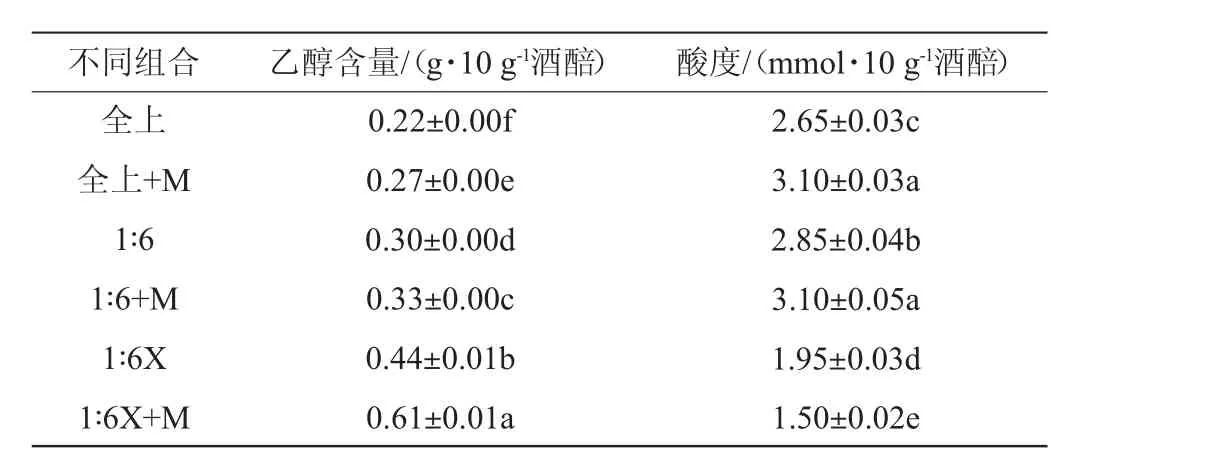
表6 不同料醅组合发酵结束时的乙醇含量和酸度测定结果Table 6 Determination results of ethanol content and acidity at the end of fermentation of different combinations of fermented grainsof fermentation of different combinations of fermented grains
由图4b及表6可知,不同料醅比、添加糖化酶的样品在发酵结束时的酸度有显著差异(P<0.05),其中全上+M和1∶6+M样品酸度最高为3.10 mmol/10 g酒醅,这是由于全上层样品中细菌初始比例高,且在发酵过程中乙醇的产率和产量低,不能起到抑制杂菌的作用。1∶6+M样品由于中下层酒醅的占比较多,样品中乳酸菌浓度以及初始酸度高于其他组合,一定程度上抑制了其他微生物的生长,微酸环境也有利于乳酸菌的生长代谢。
3 结论
通过实验室模拟窖池发酵发现,在入窖发酵前期,酵母和乳酸菌在数量上成为优势菌株,此阶段为酒精产生阶段,发酵中期,真菌数量骤减,细菌整体成为发酵的优势菌群,此阶段也为酒醅的酸性物质积累阶段,发酵后期芽孢杆菌逐渐成为优势菌,酒精和酸性物质的含量动态平衡。不同堆积醅对于发酵过程中微生物演替的影响较大,表层堆积醅中的优势细菌从48%Delftia、17.9%Ralstonia以及16.4%的Bacillus演变为34.8%Bacillus、28.8%Lactobacillus以及15.0%的Delftia,Ralstonia的相对丰度降至8.8%,1∶6样品中优势细菌的相对丰度由Lactobacillus75.7%、Bacillus14.9%变化至Lactobacillus90.6%、Bacillus3.8%。
虽然在入窖发酵前补加糖化酶能样品发酵结束时酒醅中的乙醇含量,但是全上层的样品由于微生物数量较多、淀粉老化程度高等原因导致酒醅糖化力低,使得发酵结束时酒精度仍然较低,说明表面有白斑的料醅在发酵过程中占比较高不利于实际生产。
实际工厂发酵中可通过在堆积过程中添加糖化能力高的霉菌、入窖发酵前添加糖化酶、减少表层醅在发酵酒醅中的比例等方法改善微生物在发酵过程中相互作用带来的负面影响。本实验初步研究了不同堆积醅对主要微生物在窖池发酵过程中产生的影响,而对于主要微生物的演变机理尚不明晰,可以此为基础进行进一步探究。

