凤香型白酒窖泥理化特性及微生物多样性分析
高丽娜,张永利,郑欣欣,乔晓婷,闫宗科,金成勇*
(陕西西凤酒股份有限公司,陕西 宝鸡 721406)
窖泥作为微生物栖息富集的载体,含有己酸菌、乳酸菌、放线菌、甲烷菌及硝酸盐还原菌等多种功能菌[1-2],对酒体的风格形成具有重要作用[3],是白酒酿造微生物的重要来源。凤香型白酒酿造工艺中,采用土暗窖发酵,酒醅与窖泥接触面积较大、时间较长,为保证己酸乙酯含量在合理范围,每年会更新一次窖泥,因而对窖泥的依赖程度低于浓香型白酒,酒体风格融合了清香、浓香的优点,具有醇香秀雅、甘润挺爽、诸味协调、尾净悠长的特点[4]。
近年来,随着白酒产业发展及现代分子生物学技术的不断创新应用,窖泥微生物与白酒酿造的关系得到深入研究[5],其中窖泥的微生物多样性解析及其对酿酒生产、基酒品质的影响[3,6-8]也得到较多关注。目前,多数窖泥依赖型白酒如浓香型、酱香型白酒等,已通过窖泥相关理论实践研究逐渐明晰了不同地理位置、窖龄及窖池空间位置窖泥菌群构成及窖泥功能菌作用等理论[9-12]。然而,现有涉及凤香型窖泥的研究甚少、时间较早,且主要集中在窖泥理化指标分析和人工窖泥培养等方面[13-16],关于对凤香型窖泥微生物的研究鲜见报道,窖泥在凤香型白酒酿造中的作用、窖泥质量评价标准等也都有待研究。
本研究通过对凤香型白酒窖泥的理化性质、微生物多样性解析,了解不同车间来源、窖池不同空间位置窖泥性质,并采用典范对应分析(canonicalcorrespondence analysis,CCA)探究窖泥的理化性质与微生物群落的关系,一方面丰富凤香型白酒窖泥相关理论,另一方面也为白酒窖泥的质量评价提供理论参考。
1 材料与方法
1.1 材料与试剂
窖泥:取自陕西西凤酒厂酿造车间;Fast脱氧核糖核酸(deoxyribonucleic acid,DNA)SPIN kit for soil:美国Mpbio公司;M0491L Q5超保真DNA聚合酶:美国Bio Labs公司;75510-019 Agarose、P7589 Quant-iT PicoGreen dsDNA Assay Kit:美国invitrogen公司;氢氧化钠、酒石酸钠钾、盐酸、浓硫酸、氟化铵、钼酸铵、氯化亚锡、磷酸二氢钾、碘化汞、碘化钾(均为分析纯):国药集团化学试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
TU-1810可见光分光光度计:北京普析通用仪器有限责任公司;FE28型pH计、ME303E电子分析天平:梅特勒-托利多仪器(上海)有限公司;HH-WO-5L油浴锅:上海一凯仪器设备有限公司;UVS-1振荡器:北京优晟联合科技有限公司;lllumina NovaSeq测序仪:美国lllumina公司;2720聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国ABI公司;FLX800T酶标仪、Nano Drop 2000超微量分光光度计:美国Thermo Scientific公司;DYY-6C电泳仪:北京六一仪器厂;BG-gdsAUTO(130)凝胶成像系统:北京百晶生物技术有限公司。
1.3 方法
1.3.1 窖泥取样方法
于圆窖期分别在车间T(一直采用传统凤型制酒工艺)、F(之前一直采用浓香型制酒工艺,改绵柔凤型制酒工艺1年多)随机挑选窖池3个(窖号:1#、12#、24#)和2个(窖号:1#、13#),采用五点取样法,分别对各窖池的窖壁泥(JB)、窖底泥(JD)进行取样,按照“车间-窖池位置-窖号”编号,样品编号为TJB-1、TJB-12、TJB-24、TJD-1、TJD-12、TJD-24,FJB-1、TJB-13、FJD-1、TJD-13,相同车间窖池相同位置的窖泥指标取均值得到编号为TJB、TJD、FJB、FJD的四组样品。
1.3.2 窖泥理化指标的测定
水分含量采用烘干恒重法测定[17],pH值采用pH计测定[17],氨基酸态氮含量采用纳氏试剂比色法测定[17],有效磷含量参照NY/T 1121.7—2014《土壤检测第7部分:土壤有效磷的测定》测定[18],有机质含量参照NY/T 1121.6—2006《土壤检测第6部分:土壤有机质的测定》测定[19]。
1.3.3 窖泥微生物菌群多样性分析
新鲜窖泥样品采用Fast DNA SPIN Kit for Soil试剂盒提取总DNA,以其为模板,分别采用引物对338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对细菌的16S rDNA V3-V4区基因序列进行PCR扩增,采用引物对ITS5F(5'-GGAAGTAAAAGTCGTAACAAGG-3')和ITS1R(5'-GCTGCGTTCTTCATCGATGC-3')对真菌的ITS V1区基因序列进行PCR扩增。PCR扩增体系(25 μL):5×reaction buffer 5 μL、5×GC buffer 5 μL、2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)2 μL,上下游引物各1 μL,DNA模板2 μL,双蒸水(ddH2O)8.75 μL,Q5 DNA聚合酶0.25 μL。PCR扩增条件:98 ℃预变性2 min;98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,25~30个循环;72 ℃再延伸5 min,10 ℃保温。PCR扩增及lllumina NovaSeq高通量测序委托上海派森诺生物科技有限公司完成。
1.3.4 数据分析
采用Vsearch 2.13.4、Cutadapt 2.3、QIIME2-2019.4软件对测序获得的原始序列进行质量控制;采用Vsearch 2.13.4软件在97%相似度水平下对高质量序列进行操作分类单元(operational taxonomic unit,OTU)聚类;选用Silva 132、Unit 8数据库对细菌和真菌序列进行比对,并采用QIIME2的classify-sklearn算法进行分类学注释;采用随机抽平方法分别计算α-多样性指数。采用Origin 9.0软件绘制窖泥优势菌门柱状堆积图,采用HemI软件绘制窖泥优势菌属热图,采用Canoco 5软件进行窖泥理化因子与优势菌群组成的典范对应分析(CCA)及绘图。利用SPSS 20.0软件进行窖泥理化指标方差分析、相关性分析。
2 结果与分析
2.1 凤香型白酒窖泥的理化指标
不同来源、位置窖泥样品的理化指标测定结果见表1。

表1 不同窖泥样品理化指标测定结果Table 1 Determination results of physicochemical indexes of different pit mud samples
由表1可知,窖泥的水分含量为31.26%~40.47%,pH值为6.38~8.69,氨基酸态氮含量为29.30~80.66 mg/100 g,有效磷含量为1.66~2.43 g/kg,有机质含量为27.49~78.47 g/kg。从不同来源看,F、T车间窖泥样品的平均水分含量分别为39.70%、32.29%,平均pH值分别为8.64、6.94,平均氨基酸态氮含量分别为76.50 mg/100 g、44.93 mg/100 g,三项指标差异显著(P<0.05);平均有效磷含量分别为2.12 g/kg、1.95 g/kg、平均有机质含量分别为55.46 g/kg、39.78 g/kg,两项指标差异均不显著(P>0.05)。从不同位置看,同一车间JB、JD样品的各项理化指标存在差异但均不显著(P>0.05)。结果表明,不同来源窖泥样品的水分、pH值、氨基酸态氮存在显著差异,这可能与两个车间的窖池管理水平有关。
2.2 凤香型白酒窖泥的微生物菌群多样性
2.2.1α-多样性分析结果
凤香型白酒窖泥微生物菌群的α-多样性指数见表2。由表2可知,所有样本的覆盖率(Coverage)均>99%,表明测序结果能真实反映窖泥样品的微生物菌群组成信息。从窖泥细菌菌群来看,F车间JD样品的OTU数、Chao1指数、Shannon指数、Pielou_e指数均高于JB样品,Simpson指数略低于JB样品,但差异均不显著(P>0.05);而T车间JD样品的所有指数均低于JB样品,但差异也均不显著(P>0.05)。从窖泥真菌菌群来看,同一车间内JB、JD样品的各项指数均较为接近;F车间窖泥样品的OTU数、Chao1指数、Shannon指数、Pielou_e指数略高于T车间窖泥样品,Simpson指数略低于T车间窖泥样品,但差异均不显著(P>0.05)。结果表明,不同车间、窖池不同位置窖泥样品细菌、真菌菌群的α-多样性差异不显著(P>0.05)。
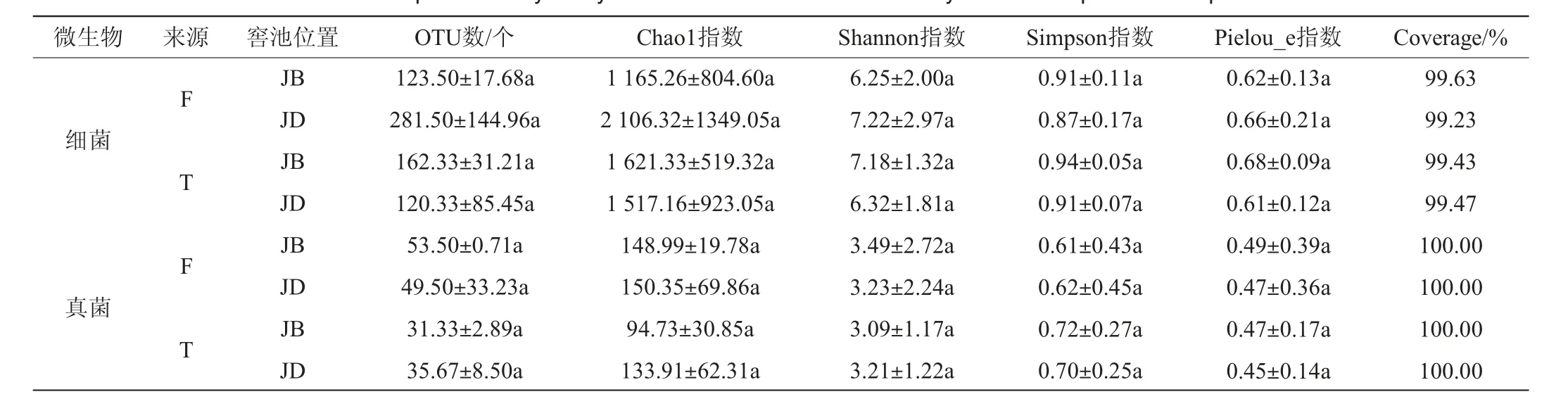
表2 不同窖泥样品微生物菌群Alpha多样性分析结果Table 2 Alpha diversity analysis results of microbial community in different pit mud samples
2.2.2β-多样性分析结果
(1)细菌菌群结构分析
采用QIIME2软件classify-sklearn算法和Silva 132数据库从窖泥样品中共注释到38个细菌门、626个细菌属。基于门、属水平,不同来源、不同位置窖泥样品中细菌群落组成见图1。

图1 基于门(a)和属(b)水平不同窖泥样品细菌菌群结构Fig.1 Bacterial community structure of different pit mud samples based on phylum (a) and genus (b) levels
由图1a可知,在门水平上,窖泥样品的优势细菌门(平均相对丰度>1%)为厚壁菌门(Firmicutes)(59.56%)、变形菌门(Proteobacteria)(21.94%)、拟杆菌门(Bacteroidetes)(9.23%)、绿弯菌门(Chloroflexi)(3.50%)、放线菌门(Actinobacteria)(2.67%)。其中,Firmicutes在F、T车间JD样品中均为绝对优势细菌门,相对丰度分别为77.21%、76.97%,分别是其JB样品中的1.78和1.89倍。Proteobacteria在F、T车间JB样品中相对丰度较高,分别为47.54%、20.61%,分别是其JD样品中的4.49和2.29倍。Bacteroidetes在F车间窖泥样品中相对丰度均较低,但在T车间窖泥样品中为优势细菌门,且在JB样品中的相对丰度是其JD样品的4.06倍。结果表明,Firmicutes、Proteobacteria为凤香型白酒窖泥中的主导优势细菌门,且T车间窖泥优势细菌门类更丰富。
由图1b可知,在属水平上,窖泥样品的优势细菌属(平均相对丰度>2%)为Fastidiosipila(9.31%)、己酸菌属(Caproiciproducens)(7.86%)、梭菌属(Solibacillus)(7.44%)、八叠球菌属(Sporosarcina)(7.25%)、嗜冷杆菌属(Psychrobacter)(6.80%)、不动杆菌属(Acinetobacter)(5.18%)、拟杆菌属(Petrimonas)(4.74%)、乳酸杆菌属(Lactobacillus)(3.72%)、Christensenellaceae_R-7_group(2.22%)。其中,Caproiciproducens是窖泥中产己酸的重要菌群[20];Solibacillus的丰度与己酸、己酸乙酯、丁酸、丁酸乙酯水平相关[21];Petrimonas具有代谢糖类生成乙酸功能[20];Lactobacillus是凤香型酒醅中的优势细菌属[22],且有生成乳酸作用,并与乳酸乙酯含量正相关[21],而乙酸、己酸、乳酸、丁酸和乙酸乙酯、己酸乙酯、乳酸乙酯、丁酸乙酯也分别是凤香型白酒中的四大有机酸和四大酯[23],推测窖泥优势细菌对基酒微量成分有一定贡献[24]。从不同来源看,F车间窖泥样品中平均相对丰度较高的优势细菌属为Fastidiosipila(18.59%)、Sporosarcina(13.16%)、Psychrobacter(13.60%)、Acinetobacter(10.28%);而T车间与F车间窖泥样品中相对丰度较高的优势细菌属组成不同,为Caproiciproducens(15.41%)、Solibacillus(13.54%)、Petrimonas(8.60%)、Lactobacillus(6.70%)。从空间位置看,JB、JD样品中相对丰度较高的优势细菌属分布差异较大,F车间JB样品中相对丰度较高的优势细菌属为Psychrobacter(27.14%)、Acinetobacter(19.90%)、Sporosarcina(17.77%),JD样品中相对丰度较高的优势细菌属为Fastidiosipila(33.27%)、Sporosarcina(8.56%);而T车间JB样品中相对丰度较高的优势细菌属为Petrimonas(16.92%)、Lactobacillus(13.13%)、Christensenellaceae_R-7_group(6.05%),JD样品中相对丰度较高的优势细菌属为Caproiciproducens(27.07%)和Solibacillus(25.51%)。综上,不同车间窖泥优势细菌菌群组成差异较大,不同窖池位置窖泥样品细菌群落组成具有明显的空间异质性。
(2)真菌菌群结构分析
采用QIIME2软件classify-sklearn算法和Unit 8数据库从窖泥样品中共注释到9个真菌门、166个真菌属。基于门、属水平,不同来源、不同位置窖泥样品中真菌群落组成见图2。
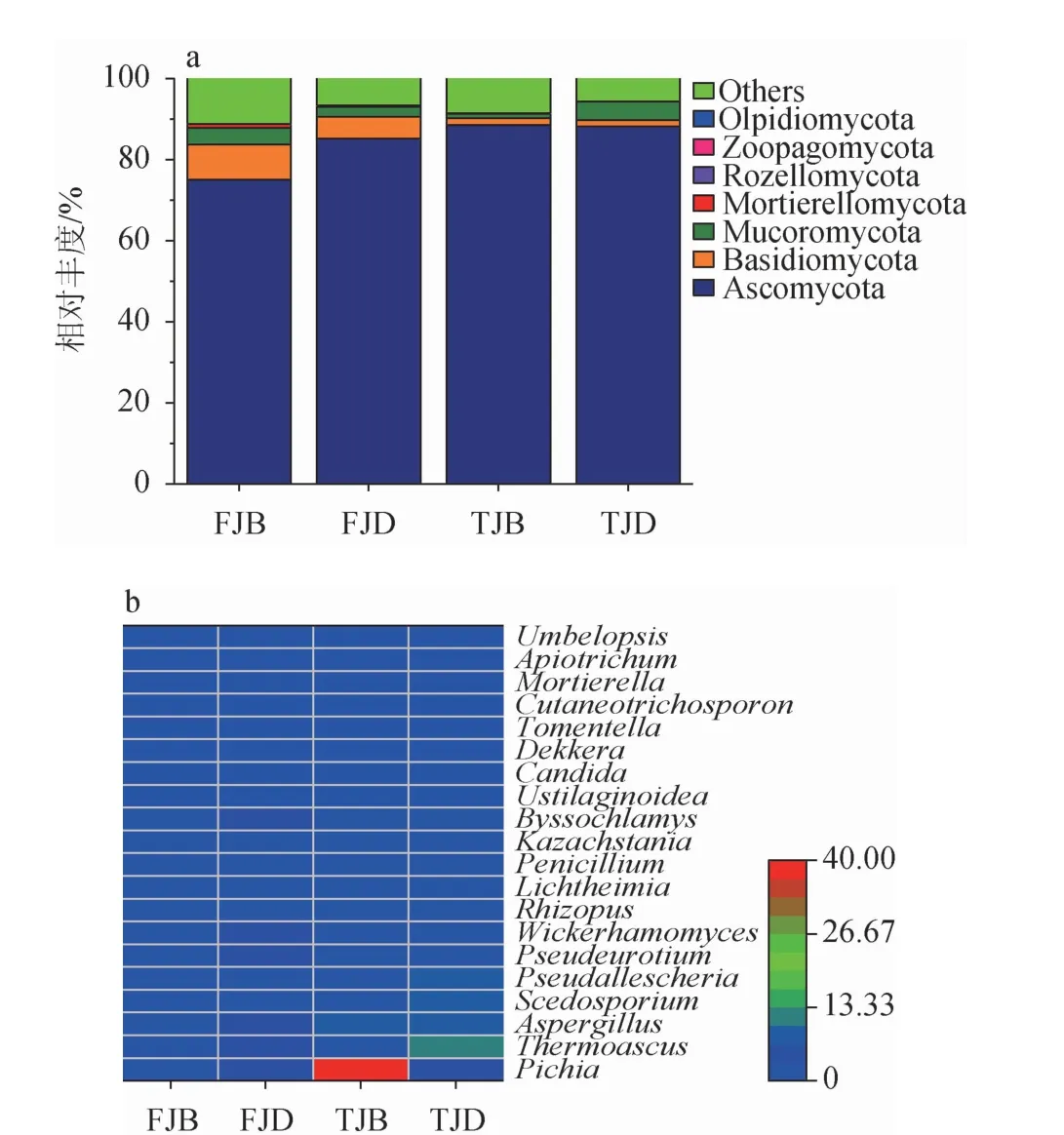
图2 基于门(a)和属(b)水平不同窖泥样品真菌菌群结构Fig.2 Fungal community structure of different pit mud samples based on phylum (a) and genus (b) levels
由图2a可知,在门水平上,窖泥样品的优势真菌门(相对平均丰度>1%)为子囊菌门(Ascomycota)(84.22%)、担子菌门(Basidiomycota)(4.33%)、毛霉菌门(Mucoromycota)(3.07%)。其中,Ascomycota为窖泥样品中的绝对优势细菌门,其在F和T车间JB、JD样品中的相对丰度分别为75.07%、85.14%和88.50%、88.16%。Basidiomycota在F车间JB、JD样品中相对丰度较高,分别为8.67%、5.40%,分别是T车间JB、JD样品中的5.18和3.39倍。Mucoromycota在F车间JB样品、T车间JD样品中相对丰度较高,分别为4.13%和4.59%。结果表明,Ascomycota为凤型窖泥中的绝对优势真菌门。
由图2b可知,在属水平上,窖泥样品的优势真菌属(平均相对丰度>1%)为毕赤酵母属(Pichia)(12.78%)、嗜热子囊菌属(Thermoascus)(5.92%)、曲霉菌属(Aspergillus)(5.54%)、赛多孢菌属(Scedosporium)(2.45%)、假霉样真菌属(Pseudallescheria)(2.45%)、假散囊菌属(Pseudeurotium)(1.86%)、威克汉姆酵母属(Wickerhamomyces)(1.57%)、根霉菌属(Rhizopus)(1.35%)、横梗霉属(Lichtheimia)(1.24%)、青霉菌属(Penicillium)(1.03%)。其中,Pichia具有较强的产酯能力[25],Thermoascus对糖化力、液化力有提升作用[26],Aspergillus的酯化酶和糖化酶活力强[27],三个菌属也是凤香型酒醅中的优势真菌属[22]。从不同来源看,F、T车间窖泥样品中相对丰度较高的优势真菌属各有5种,其中共有的优势真菌属为Thermoascus(4.22%、7.63%)、Pichia(2.83%、22.74%)、Aspergillus(3.08%、7.99%),且相对丰度均在T车间较高;特有的相对丰度较高优势真菌属在F车间为Pseudeurotium(3.54%)、Wickerhamomyces(3.03%),在T车间为Pseudallescheria(4.90%)、Scedosporium(4.71%)。从空间位置看,JB、JD样品中相对丰度较高的优势真菌属分布差异较大,F车间JB样品中各优势真菌属相对丰度均较低,JD样品中相对丰度较高的真菌属为Thermoascus(6.62%)、Wickerhamomyces(6.06%)、Pseudeurotium(5.39%)、Aspergillus(4.83%)、Pichia(3.54%);T车间JB样品中相对丰度较高的优势真菌属为Pichia(39.65%)、Aspergillus(7.16%)、Thermoascus(3.15%),在JD样品中与F车间JD样品共有的相对丰度较高的优势真菌属有3种,Aspergillus(12.10%)、Thermoascus(8.82%)、Pichia(5.82%),特有的相对丰度较高的优势真菌属为Pseudallescheria(9.66%)、Scedosporium(9.29%)、Rhizopus(3.05%)。综上,窖泥真菌群落组成也具有明显的空间异质性。
2.3 凤香型白酒窖泥理化因子与优势菌群相关性分析
窖泥的理化性质差异是影响微生物群落多样性的重要因素[28-29]。采用典范对应分析对窖泥理化因子与优势菌群(平均相对丰度前10的细菌属与真菌属)间相关性进行分析,结果见图3。由图3可知,CCA1和CCA2轴共解释了优势细菌群落39.57%的变异率,优势真菌群落43.53%的变异率,且均主要集中在CCA1轴,表明微生物群落在一定程度上受到窖泥理化性质影响。
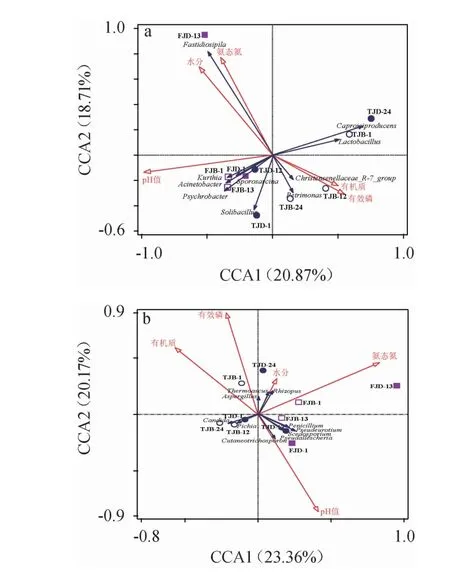
图3 窖泥理化因子与优势细菌属(a)和真菌属(b)的典范对应分析结果Fig.3 Canonical correspondence analysis results of physicochemical factors of pit mud and dominant bacterial genera (a) and fungal genera (b)
由图3a可知,窖泥优势菌属结构的影响来自多个理化因子的综合作用,如Caproiciproducens、Lactobacillus、Petrimonas、Christensenellaceae_R-7_group均与pH值、水分、氨基酸态氮含量呈负相关,与有效磷、有机质含量呈正相关;Psychrobacter、Sporosarcina、Acinetobacter、Kurthia与pH值呈正相关,与其他指标呈负相关;Fastidiosipila与水分、氨基酸态氮含量、pH值呈正相关,与有效磷、有机质含量呈负相关;Solibacillus与pH值、有效磷、有机质含量呈正相关,与其他指标呈负相关。条件限制性分析结果显示,pH值(29.9%)对优势细菌结构的影响极显著(P<0.01),氨基酸态氮含量(25.6%)的影响显著(P<0.05),其他理化指标影响大小依次为有效磷含量(18.3%)、有机质(14.6%)含量、水分含量(11.5%),但影响均不显著(P>0.05)。由图3b可知,不同来源窖泥优势真菌群落差异与多个理化因子相关,Pichia、Candida与氨基酸态氮、水分、有效磷含量呈负相关,与有机质含量呈正相关;Penicillium、Pseudeurotium、Scedosporium、Pseudallescheria、Cutaneotrichosporon与pH 值、氨基酸态氮含量呈正相关,与其他理化指标呈负相关;Thermoascus、Rhizopus、Aspergillus与pH值呈负相关,与其他指标呈正相关。条件限制性分析结果显示,氨基酸态氮含量(44.6%)对优势真菌结构的影响最大,其次为pH值(42.1%),其他依次为水分含量(6.5%)、有效磷含量(3.6%)、有机质含量(3.3%),但影响均不显著(P>0.05)。窖泥pH值对微生物的生长繁殖具有重要影响[29-30],如pH值较低时有助于乳酸杆菌等耐/嗜酸菌群富集;氨基酸态氮是窖泥功能菌生长、繁殖的主要氮源[30]。综上,pH值、氨基酸态氮含量极有可能是影响凤香型白酒窖泥微生物菌群在不同来源、不同位置中分布差异的主要理化因子。
3 结论
本研究在对窖泥理化指标分析基础上结合高通量测序技术,分析了不同来源、位置凤香型白酒窖泥的理化特性及微生物群落结构差异。理化性质分析表明,不同来源窖泥的pH值、氨基酸态氮和水分含量存在显著差异(P<0.05),有效磷、有机质含量差异均不显著(P>0.05);不同位置窖泥样品的各项理化指标存在差异但均不显著(P>0.05);窖泥的水分含量为31.26%~40.47%,pH值呈弱酸性至中性,为6.38~8.69,氨基酸态氮含量为29.30~80.66 mg/100 g,有效磷含量为1.66~2.43 g/kg,有机质含量为27.49~78.47 g/kg。微生物多样性分析结果显示,不同来源、位置窖泥的细菌和真菌菌群α-多样性存在差异但均不显著(P>0.05);细菌、真菌群落组成在来源、窖池位置上均具有空间异质性,但主要优势细菌属为Fastidiosipila(9.31%)、己酸菌属(Caproiciproducens)(7.86%)、梭菌属(Solibacillus)(7.44%)、八叠球菌属(Sporosarcina)(7.25%)、嗜冷杆菌属(Psychrobacter)(6.80%)、不动杆菌属(Acinetobacter)(5.18%)等,主要优势真菌属为毕赤酵母属(Pichia)(12.78%)、嗜热子囊菌属(Thermoascus)(5.92%)、曲霉菌属(Aspergillus)(5.54%)等。通过典范对应分析(CCA)探究窖泥菌群分布特征与其理化因子的关系,结果表明,pH值、氨基酸态氮含量极有可能是影响凤香型白酒窖泥微生物菌群在不同来源、不同位置中分布差异的主要理化因子。

