益生菌对鸡葡萄球菌性关节炎的预防效果研究
宋 翔,谢全喜,谷 巍
( 山东宝来利来生物工程股份有限公司 山东省动物微生态制剂重点实验室,山东 泰安 271000 )
鸡葡萄球菌性关节炎是由金黄色葡萄球菌(SA)引起鸡的急性或慢性细菌性传染病,该病发病无明显季节性。SA 主要引起腱鞘、关节的黏液囊等部位的局部化脓、脐炎、眼炎,偶见细菌性心内膜炎和脑脊髓炎、败血症、关节炎、皮肤坏死和骨膜炎等[1-2]。SA 感染通常引起幼鸡败血症、中鸡关节炎、成鸡慢性局灶性病变,一般认为6~12周龄育成鸡是发生关节炎的高峰期[3]。由于鸡葡萄球菌性关节炎发病后很难痊愈,生产指标显著下降,现已成为困扰集约化养禽业的重要传染病之一。鸡葡萄球菌性关节炎若能够及时发现鉴别并采取防治措施,可减少一定的经济损失。实际生产中多采用添加抗生素防治疾病,但抗生素不规范使用导致耐药性问题愈发严重,因此寻求更为安全、环保、有效防控鸡葡萄球菌性关节炎的途径迫在眉睫。本研究建立鸡葡萄球菌性关节炎模型,比较对SA 敏感的抗生素和益生菌对SA 的抑制效果,以期为鸡葡萄球菌性关节炎的临床防治及益生菌应用于兽医诊疗提供参考。
1 材料与方法
1.1 试验材料
病料来源:山东省泰安市某规模化三黄鸡场2022—2023年大群多批次出现跛行、瘫鸡、关节肿等症状,发病鸡以每天约以1‰增加,淘汰率居高不下。养殖户曾针对病鸡症状多次投药,治疗效果不明显。本研究使用的病料为出现关节病变鸡关节囊中的关节渗出液。
药敏纸片共计18种,分别为多西环素、庆大霉素、林可霉素、大观霉素、四环素、头孢克肟、阿莫西林、恩诺沙星、卡那霉素、链霉素、万古霉素、左氧氟沙星、环丙沙星、甲氧嘧啶、克拉霉素、美罗培南、硫酸新霉素、氨苄西林,均购自北京天坛药物生物技术开发公司。
益生菌共计14 株,其中植物乳杆菌4 株(BLCC2-0015、BLCC2-0355、BLCC2-0410、BLCC2-0426),鼠李糖杆菌5 株(BLCC2-0175、BLCC2-0527、BLCC2-0016、BLCC2-0182、BLCC2-0106),罗伊氏乳杆菌5株(BLCC2-0345、BLCC2-0118、BLCC2-0241、BLCC2-0275、BLCC2-0312),均由山东宝来利来生物工程股份有限公司生物工程研究院菌种资源保藏中心提供。
主要试剂:基础培养基、Baird-Parker琼脂培养基购自青岛海博生物技术有限公司;TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0 购自宝生物工程(大连)有限公司。免疫球蛋白G(IgG)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)检测试剂盒均购自上海酶联生物科技有限公司。
1.2 试验方法
1.2.1 鸡葡萄球菌性关节炎的鉴定
1.2.1.1 临床症状及PCR鉴定测序
病禽出现腿部关节症状主要考虑鸡葡萄球菌性关节炎、滑液囊支原体病或病毒性关节炎,因此主要针对SA、滑液囊支原体及禽呼肠孤病毒进行实验室诊断鉴定。
参考文献[4-6]设计SA、滑液囊支原体和禽呼肠孤病毒引物各一对,由济南博尚生物工程股份有限公司合成。无菌采集病死鸡的关节渗出液分别进行SA、滑液囊支原体、禽呼肠孤病毒的PCR 鉴定及测序,3 种病原PCR 引物信息见表1。

表1 3种病原PCR引物Tab.1 PCR primers for three pathogens
1.2.1.2 菌落及菌体形态特征
将关节渗出液接种于Baird-Parker 琼脂培养基,置于37 ℃培养18 h后进行观察。勾取典型单菌落进行涂片,革兰氏染色后镜检。
1.2.1.3 生化特性
按照Raid ID 32 STREP阳性菌鉴定试条说明书,将纯化培养的分离菌置37 ℃下培养24~48 h,用ATB自动化微生物生化鉴定系统进行生化特性鉴定。
1.2.2 具有抑制SA作用的抗生素的筛选
按K-B 法对分离纯化的SA 进行药敏试验[7],检测其对18种常用抗菌药物的敏感性,抑菌效果判断标准参考美国临床实验室标准委员会(CLSI)的标准。将培养的菌液浓度为108CFU/mL 的SA 稀释至106CFU/mL,吸取20 μL至倾注的固体基础培养基上均匀涂布,等间距对称放置7个药敏纸片,37 ℃温箱培养18 h,采用游标卡尺测量抑菌圈直径。每种药敏纸片做3个重复,取其平均值。
1.2.3 具有抑制SA作用的益生菌的筛选
将培养的菌液浓度为108CFU/mL 的SA 稀释至106CFU/mL,吸取100 μL 至倾注的固体基础培养基上均匀涂布,采用牛津杯法[8-9]测定14株益生菌培养物对SA的体外抑菌效果,分别在牛津杯内加入200 μL 益生菌发酵液,37 ℃温箱培养18 h,采用游标卡尺测量抑菌圈直径,每株益生菌设3个重复,取其抑菌圈直径的平均值。
1.2.4 敏感抗生素与益生菌抑制SA效果比较
1.2.4.1 鸡葡萄球菌性关节炎模型构建
借鉴斯日古楞等[10]、叶秋莹等[11]对小鼠进行的金黄色葡萄球菌性关节炎的病理模型的构建方法,选取20 日龄SPF鸡,随机分为2组,分别为试验组和对照组,每组10只。试验组每只鸡左侧腿部关节腔内注射1×106CFU/mL 的SA菌悬液,剂量为0.2 mL/只;对照组每只鸡左侧腿部关节腔内注射无菌生理盐水,剂量为0.2 mL/只。观察期14 d,根据各组鸡的精神状态、采食、饮水、站立与行动状态、腿部关节剖检等综合判断模型构建是否成功。
1.2.4.2 预防效果验证
选取13 日龄,体重相近、健康情况基本相同的SPF 鸡120 只,随机分为4 组,每组30 只。空白对照组、攻菌对照组的试验鸡正常饲喂;抗生素组在饮水中添加筛选的对SA敏感的抗生素,于18~20日龄连续饮用3 d,使用剂量参照产品说明进行;益生菌组在饮水中添加筛选出的益生菌培养物,于13~20 日龄连续饮用7 d,饮用剂量为1×109CFU/只,2 h 内饮完。除空白对照组外的其余3 组,均在20日龄参照1.2.4.1进行SA的攻菌。连续观察14 d。
分别在攻菌后0、7、14 d,每组随机选择5 只翅静脉采血,进行血清IgG 抗体水平及IL-6、IL-10 含量的检测;观察期结束后各组进行安乐死,取关节腔内的关节液进行PCR鉴定,检测SA感染率。
1.2.5 数据统计与分析
试验数据采用SPSS软件进行单因素方差分析。结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 鸡葡萄球菌性关节炎的鉴定
2.1.1 临床及剖检症状
部分病鸡表现为消瘦、精神萎靡、羽毛蓬乱,个别鸡脚趾变形,呈“八字步”,严重者腿关节瘫伏、着地。
由图1可知,部分病鸡趾关节、跗关节、脚垫等病变部位有出血、结痂;严重者跗关节有炎性渗出物,部分已凝固,其他脏器未见明显异常。

图1 腿部病变Fig.1 Leg lesions
2.1.2 PCR扩增结果(见图2)
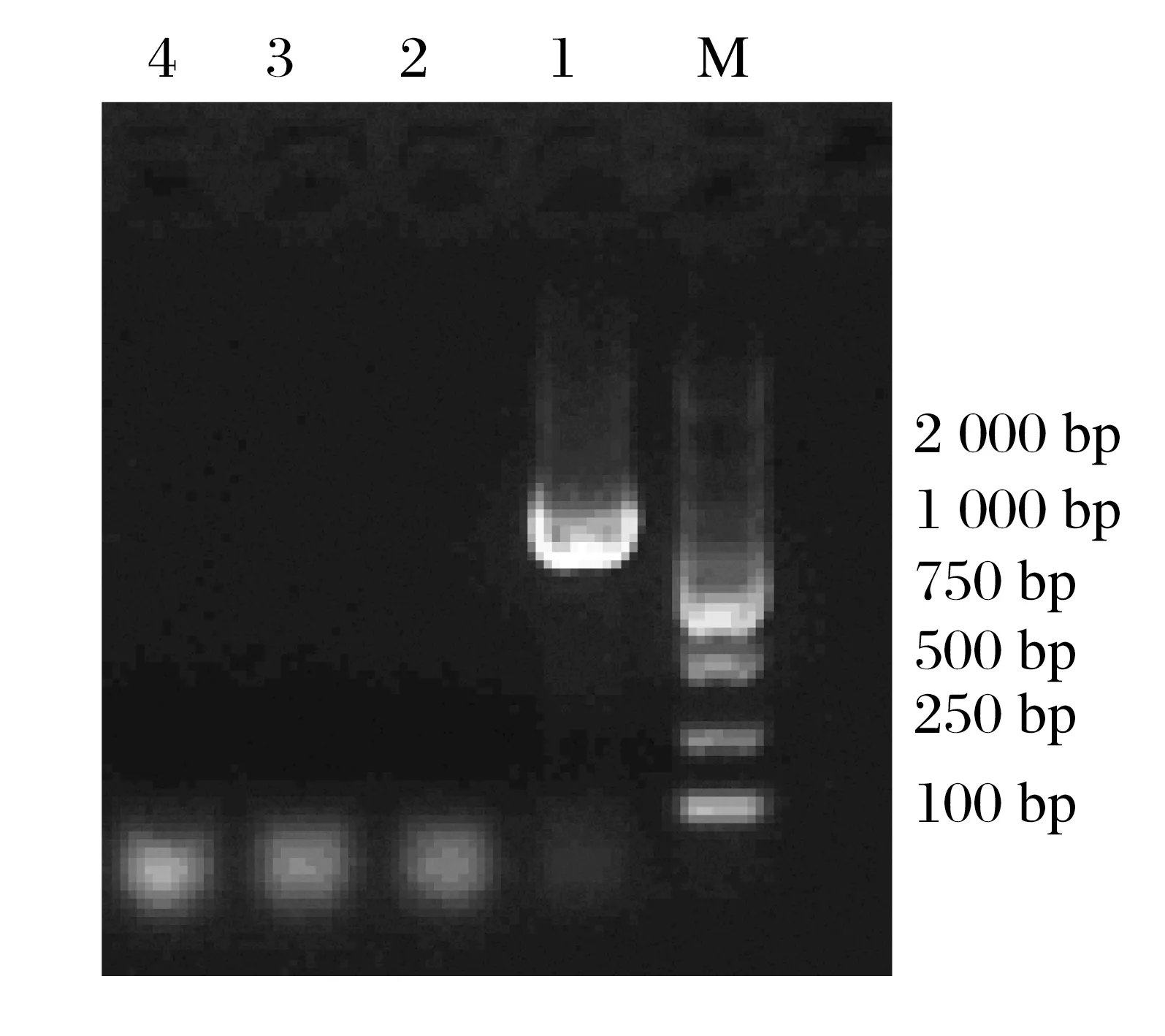
图2 PCR扩增结果Fig.2 PCR amplification results
由图2 可知,细菌16S rRNA 的PCR 鉴定分离菌株用16S rRNA PCR 扩增出约1 492 bp 的PCR 目的基因条带,而滑液囊支原体和禽呼肠孤病毒均未检测到目的条带。
分离菌株PCR产物测序结果与Gen Bank中登录的参考株SA 的基因序列同源性为98.9%~99.9%。综上,可初步确定致病原为SA。
2.1.3 菌落形态特征(见图3)

图3 Baird-Parker琼脂培养基上菌落形态特征Fig.3 Morphological characteristics of colonies on Baird-Parker AGAR medium
由图3可知,经培养出现灰黑色、有光泽、有浅色边缘的菌落,菌落周围绕有不透明圈。
勾取典型单菌落与无菌采取的病变组织分别进行涂片、革兰氏染色、镜检。各培养物涂片和病料直接涂片的形态基本一致,均为葡萄状、数量众多的革兰氏阳性球菌,初步鉴定为SA。
2.1.4 生化特性鉴定
通过过氧化氢酶试验和血浆凝固酶试验,发现该菌株呈过氧化氢酶试验阳性、血浆凝固酶试验阳性,V-P 试验和过氧化氢酶试验阳性;不产生H2S,可分解葡萄糖、半乳糖、甘露糖、麦芽糖、蔗糖,产酸不产气。上述生化特点符合SA 的特性,因此,综合临床症状、剖检变化和实验室诊断,确诊该病例主要是由SA感染引起的关节炎。
2.2 药敏试验结果(见表2)
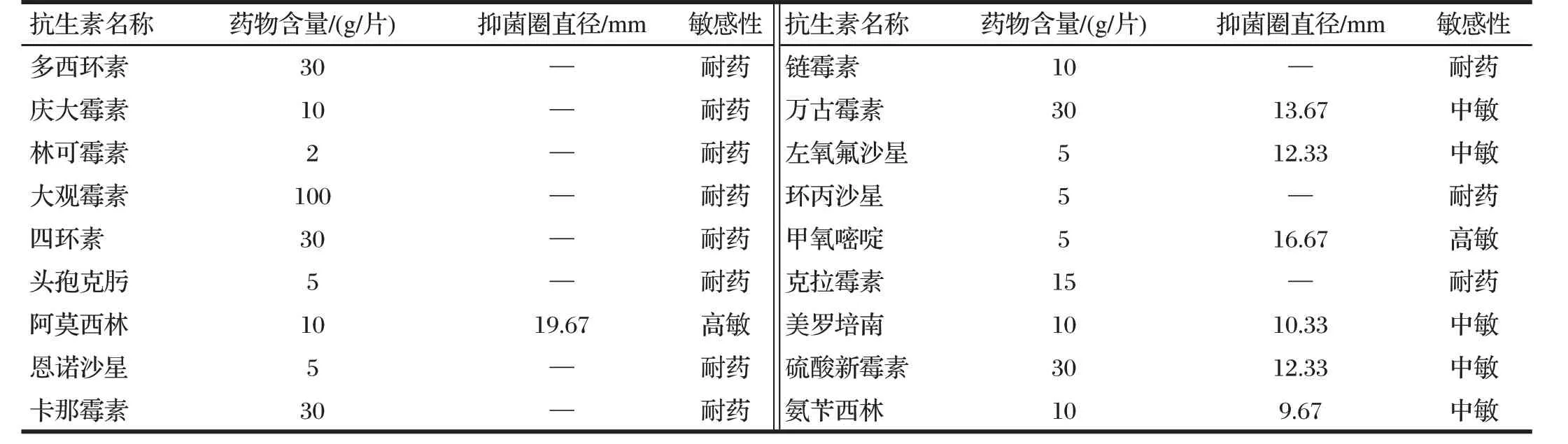
表2 药敏试验结果Tab.2 Results of drug susceptibility test
由表2 可知,绝大多数抗生素存在严重的耐药性。中敏抗生素有4 种,分别为:万古霉素、左氧氟沙星、美罗培南、硫酸新霉素。仅筛选到2种高敏抗生素,分别为阿莫西林和甲氧嘧啶,其中阿莫西林抑菌圈直径高达19.67 mm,因此选取抗生素阿莫西林进行后续试验。
2.3 益生菌筛选结果(见表3)
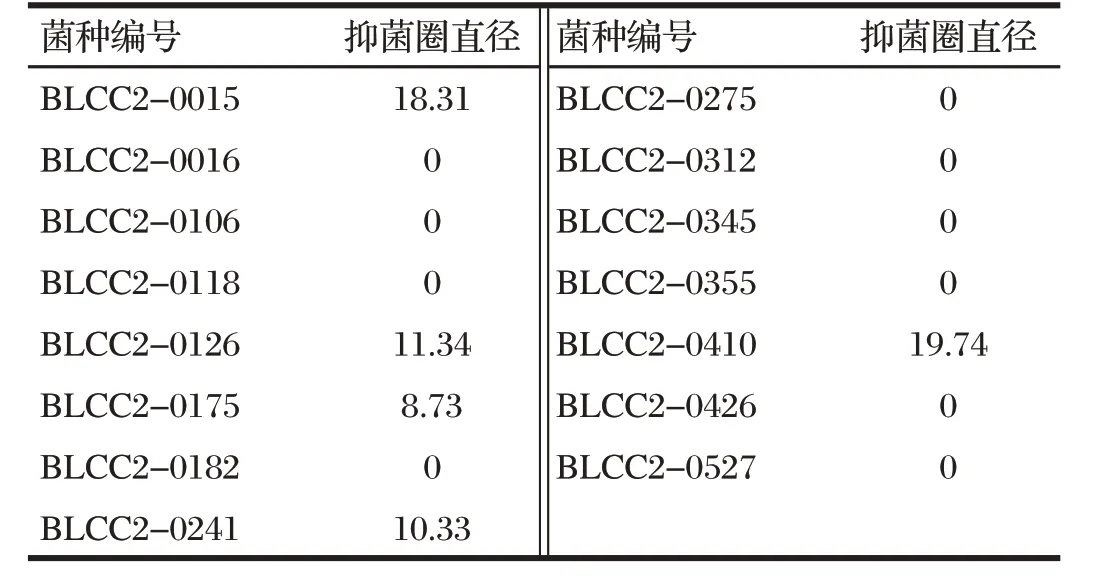
表3 益生菌筛选结果Tab.3 Results of probiotic screening 单位:mm
由表3 可知,5 株益生菌对SA 分离株具有抑制效果,其余9 株益生菌的抑菌圈直径为0,对SA 无抑菌性;BLCC2-0410抑菌圈直径最高,可达19.74 mm,对SA具有较强的抑菌性,因此选择BLCC2-0410进行后续试验。
2.4 敏感抗生素与益生菌抑制SA感染效果比较
2.4.1 鸡葡萄球菌性关节炎模型的构建
整个观察期内,对照组鸡饮水、采食正常、精神状态良好。感染SA 后第7 d,试验组大群鸡表现喜卧或常站立、不愿走现象,采食、饮水不积极;第10 d,试验组鸡有轻微跛行,行动迟缓、关节肿胀不明显,饮水量,采食量出现下降;第14 d,试验组鸡精神倦怠,卧地不起、严重者出现行走障碍腿部关节出现明显肿胀,饮水量采食量下降明显,部分鸡消瘦严重,严重者出现死亡。试验组鸡剖检后,腿部跗关节腔内大多有微量透明脓液。因此,综合临床鸡剖检病变,可判定SA关节炎模型构建成功。
2.4.2 抗生素与益生菌对鸡葡萄球菌性关节炎的预防效果比较
2.4.2.1 益生菌对鸡血清IgG抗体水平的影响(见表4)

表4 益生菌对鸡血清IgG抗体水平的影响Tab.4 Effect of probiotics on serum IgG antibody level of chicken 单位:μg/L
由表4可知,攻菌当天,各组鸡血清IgG抗体水平差异不显著(P>0.05);攻菌后第7 d,攻菌对照组、抗生素组和益生菌组鸡血清IgG 抗体水平与空白对照组相比均有所下降,攻菌对照组与抗生素组鸡血清IgG抗体水平显著低于益生菌组和空白对照组(P<0.05);攻菌后第14 d,攻菌对照组与抗生素组鸡血清IgG抗体水平显著低于益生菌组和空白对照组(P<0.05)。益生菌组鸡血清IgG抗体水平较空白对照组略有上升,但差异不显著(P>0.05)。
2.4.2.2 益生菌对鸡血清IL-6含量的影响(见表5)

表5 益生菌对鸡血清IL-6含量的影响Tab.5 Effect of probiotics on serum IL-6 content of chicken 单位:ng/L
由表5 可知,攻菌当天,各组鸡血清IL-6 含量差异均不显著(P>0.05);攻菌后第7 d,攻菌对照组、抗生素组和益生菌组鸡血清IL-6含量较空白对照组均出现激增的情况,攻菌对照组与抗生素组鸡血清IL-6含量显著高于益生菌组和空白对照组(P<0.05);攻菌后第14 d,攻菌对照组、抗生素组和益生菌组鸡血清IL-6含量均高于空白对照组,其中攻菌对照组与抗生素组鸡血清IL-6含量显著高于空白对照组(P<0.05)。
2.4.2.3 益生菌对鸡血清IL-10含量的影响(见表6)

表6 益生菌对鸡血清IL-10含量的影响Tab.6 Effect of probiotics on serum IL-10 content of chicken 单位:ng/L
由表6可知,攻菌当天,各组鸡血清IL-10含量差异均不显著(P>0.05);攻菌后第7 d,攻菌对照组、抗生素组和益生菌组鸡血清IL-10 含量均显著高于空白对照组(P<0.05),益生菌组鸡血清IL-10 含量显著高于其余3 组(P<0.05);攻菌后14 d,攻菌对照组、抗生素组和益生菌组鸡血清IL-10含量均高于空白对照组,其中益生菌组鸡血清IL-10含量显著高于其余3组(P<0.05)。
2.4.2.4 益生菌对鸡SA感染率的影响(见表7)

表7 益生菌对鸡SA感染率的影响Tab.7 Effect of probiotics on SA infection rate in chickens
由表7 可知,空白对照组SA 感染率为0;攻菌对照组最高,达到36.67%;其次为抗生素组,达到23.33%;益生菌组SA 感染率最低,为13.33%。由此可见,益生菌对鸡葡萄球菌性关节炎感染率的降低作用较抗生素高。
3 讨论
鸡葡萄球菌性关节炎一般可经血源性传播或由外伤感染引起。饲养管理不当造成的皮肤破损或足垫皮肤开裂和溃疡、接种、蚊虫叮咬是葡萄球菌关节炎发生的常见原因。目前鸡葡萄球菌性关节炎防控以投喂抗生素为主,而耐药性可通过质粒进行转移[12-13],因此造成了SA 耐药性不断强化,对各种抗生素的敏感性越来越差。而且,使用抗生素很难治愈鸡葡萄球菌性关节炎,这可能是因为关节部位为肢端,血管相对较少,且病灶局部形成无效腔、软组织瘢痕化,从而导致局部供血贫乏,投喂药物较难以进入该部位,导致关节腔内很难达到有效治疗浓度。而疫苗只能降低鸡葡萄球菌性关节炎的流行性和发病的严重程度,但不能根除该病[14],因此寻找有效预防鸡葡萄球菌性关节炎的方法具有显著重要意义。
益生菌可对一些病原微生物产生拮抗作用,使机体对疾病具有一定的抵抗力。彭红艳等[14]研究发现,益生菌对大肠杆菌和SA 的生长均具有一定的抑制作用。王二柱等[15]研究发现,复合益生菌与金霉素配伍可抑制SA生长。郑佳奇等[16]研究发现,乳酸杆菌菌株对耐药性SA 的抑制能力强。林松泉等[17]研究发现,益生菌植物乳杆菌、干酪乳杆菌与鼠李糖乳杆菌对大肠杆菌和鸡葡萄球菌均具有明显的抑制效果。姜林娟等[18]研究发现,益生菌植物乳杆菌、鼠李糖乳杆菌、罗伊乳杆菌对白色念珠菌、福氏志贺菌、铜绿假单胞菌、大肠埃希菌、SA 的抑菌效果明显。本研究结果与上述研究结论一致。
李万军[19]研究发现,采用基础日粮+0.3%益生菌饲喂大骨鸡,大骨鸡外周血IgG含量显著高于对照组。刘凤美等[20]研究表明,益生菌对提高大型肉鸡的免疫器官指数具有显著作用,肉鸡血清IgG含量明显提升。上述研究结论与本研究结果一致。虽然益生菌应用于SA感染的研究很多,但以治疗肠道性疾病为主,使用益生菌预防、治疗SA感染关节部位的应用研究较少。Vaghef-Mehrabany 等[21]研究发现,副干酪乳杆菌能够显著降低类风湿关节炎患者血清中炎症因子水平,显著增加抗炎因子的分泌,延缓类风湿关节炎的发展。Alipour等[22]研究表明,类风湿关节炎患者口服补充干酪乳杆菌,疾病活跃度显著下降,细胞因子IL-10、白细胞介素-12(IL-12)和肿瘤坏死因子-α(TNF-α)水平显著降低。Amdekar 等[23]研究发现,干酪乳杆菌能够辅助吲哚美辛治疗的关节炎大鼠,缓解血管翳的形成以及滑膜湿润、骨破坏等症状的发展。崔鹏月等[24]试验筛选出4株具有改善机体炎症反应的潜力的益生菌,其中2 株能够显著降低炎症模型细胞白细胞介素-1β(IL-1β)的分泌,1株能够显著降低炎症模型细胞的IL-6分泌。上述研究结论与本研究结果一致。
益生菌不产生耐药性,可为解决养禽业耐药性问题提供新途径。益生菌可提高饲料的转化率,改善动物肠道健康,降低腹泻,也可作为一种有效的免疫增强剂,能够增强多种免疫细胞的功能,从而使机体建立起有效的免疫屏障,清除入侵的病原菌。虽然益生菌预防葡萄球菌性关节炎的具体作用机制尚未明确,但益生菌是值得进一步研究预防葡萄球菌性关节炎的有效方法。
4 结论
本研究结果表明,益生菌可以明显提高机体免疫力,降低感染金黄色葡萄球菌导致的炎症反应,对鸡葡萄球菌性关节炎具有一定的预防作用。

