铅卤钙钛矿泄漏对垂穗披碱草幼苗生长的影响
李庭伦,李一亨,余慧,江再莉,唐立涛,王长庭,胡雷*
(1. 西南民族大学青藏高原研究院,四川 成都 610225;2. 小金县林业和草原局,四川 阿坝藏族羌族自治州 624099)
铅卤钙钛矿作为钙钛矿电池中使用最多的材料,是由有机阳离子与卤化铅八面体形成的三维结构材料,其光电转化效率已达25%,超过了目前商业主流的光伏器件(多晶硅)的光电效率,并有望完全替代多晶硅,在新能源开发中具有巨大的发展潜力和应用前景[1-2],但其本身具有离子性质,它的重金属离子对环境变化十分敏感[3],长时间紫外线照射、氧气和温度的升高等都会显著影响钙钛矿材料中重金属的泄漏[4-5],而由此导致的生态效应知之甚少。一旦钙钛矿材料导致重金属泄漏至土壤中,这些重金属会在生物体内不断累积,并转变为毒性甲基化合物,这种化合物将会随着食物链而最终进入人体,严重影响人体健康。目前有关钙钛矿材料导致重金属泄漏的生态影响效应研究,其关注对象多为人体细胞[6]、土壤微生物或大型动物。Zhai 等[7]研究了铅基钙钛矿纳米粒子对土壤细菌群落的影响,发现Pb2+的存在通过为钙钛矿纳米粒子与土壤细菌相互作用提供阳离子桥,从而增加了钙钛矿纳米粒子对土壤细菌群落的毒性效应。Danae 等[8]评估了5 种钙钛矿型纳米粒子[碘化铅(PbI2)和溴化铅(PbBr2)基材料]对斑马鱼幼虫和成鱼的生物毒性,钙钛矿材料中的可溶性Pb 对斑马鱼死亡率和基因表达方面产生显著影响。然而,目前对食物链的第一营养级—植物影响的研究则十分缺乏,且主要集中在经济作物上,如辣椒(Capsicum annuum)、卷心菜(Brassica campestris)和薄荷(Mentha spicata)等[9]。
Pb 作为最严重的重金属污染元素之一,不易分解,对生物体能够产生显著毒性且持久的物质[10]。环境中的Pb 主要通过叶片的吸附和根系的吸收两个途径进入植物体内[11],一旦进入植物体内,轻度Pb 胁迫影响植物生长,重度则导致其死亡[12]。然而,不同植物Pb 耐受能力存在显著差异。对于自然界中的超富集植物而言,如牧草剪股颖(Agrostis matsumurae)和羊茅草(Festuca ovina),其对Pb 的耐受能力分别达到13488 和11750 mg·kg-1[13-14],而盐生草(Halogeton glomeratus)对Pb 的耐受范围则为207~621 mg·kg-1[15]。不同的Pb 耐受能力决定了其对Pb 胁迫的响应程度。但也有研究表明,低浓度Pb 胁迫可能对植物生长具有积极的刺激作用。如,低浓度Pb 处理下印度芥菜(Brassica jouncea)根系生长更好[16],但高浓度Pb 则会导致根系体积和生物量的降低[17]。因此,明确植物的Pb 耐受范围,是科学研究Pb 胁迫下植物生长响应的关键。
尽管不同植物Pb 耐受能力不同,但只要Pb2+被植物吸收,其在植物体内富集能力和迁移能力就会变强,将会对植物生长产生更为严重的危害。研究指出,向土壤中添加Pb 后,土壤中有效Pb 浓度仅提高了10%,而Pb 富集能力较强的植物,如薄荷组织内的铅浓度则提高100%,高浓度的铅污染(250 mg·kg-1)将导致大多数薄荷由于铅中毒而变黑腐烂[9]。而对Pb 富集能力较弱的植物来说,轻度Pb 污染都将对其产生严重的影响。如辣椒和卷心菜,一旦受到Pb 污染,两种植物富集在体内的Pb 的迁移性将增加10 倍以上[9]。因此,研究植物生长对Pb 胁迫的响应不仅需要关注其Pb 耐受能力,更需要关注其Pb 富集能力[18-20]。
铅卤钙钛矿材料在太阳能资源丰富的青藏高原具有广阔的应用前景,披碱草属植物是青藏高原高寒草甸植物群落优势物种,植株生长茂盛,粗蛋白含量高、适口性好,是良好的牧草品种[21-22]。然而,目前鲜有研究关注铅卤钙钛矿材料泄漏对披碱草植物生长发育的影响,尤其是对其耐受能力和富集能力影响的研究极少。这极大限制了研究者对铅卤钙钛矿材料广泛应用背景下披碱草属植物富集能力和耐受范围的认知。因此,本研究通过盆栽方法,模拟不同铅卤钙钛矿材料泄漏导致Pb 胁迫梯度下,垂穗披碱草(Elymus nutans)幼苗生长、Pb 富集能力和耐受范围,充分了解钙钛矿泄漏引起的生态效应,为高寒草甸土壤铅污染治理和草场健康管理提供数据和理论支撑。
1 材料与方法
1.1 试验样地
试验样地位于四川省西南民族大学青藏高原研究院温室大棚内(102°57′53″ E,30°33′45″ N),该地区是亚热带湿润季风气候,年平均气温16 ℃,年降水量1000 mm 左右,海拔499 m。试验于2022 年5-7 月进行。
1.2 试验材料
植物材料是“康北”垂穗披碱草,由西南民族大学青藏高原研究院提供。供试土壤为无农药残留的田园土(保持土壤性质基本一致,该土壤不含种子、土壤动物、侵入体和新生体,可以保证种植一致性)。
尽管铅卤钙钛矿泄漏的影响主要是Pb 胁迫引起的生态效应,但铅卤钙钛矿材料中主要是碘化铅(PbI2),为了更为真实模拟铅卤钙钛矿泄漏引起的生态效应,本研究选择PbI2。该材料购买自麦克林(https://www.macklin.cn/)。
1.3 试验方法
1.3.1 试验设计 采用盆栽试验,设置1 个不添加碘化铅的处理为对照组,5 个不同铅离子浓度处理,共计6个处理,每个处理3 个重复。
铅卤钙钛矿太阳能电池中的甲基胺碘化铅(CH3NH3PbI3)层厚度约为600 nm,CH3NH3PbI3中的Pb 含量为33.4%(质量比)。由于中国土壤平均Pb 含量在36 mg·kg-1左右,所以第1 组钙钛矿泄漏梯度为36 mg·kg-1Pb,第2 组增加到72 mg·kg-1Pb,第3 组增加到130 mg·kg-1Pb。我国《土壤环境质量农用地土壤污染风险管控标准(试行)》[23]规定农业用地铅含量上限为170 mg·kg-1Pb,因此第4 组处理铅含量升高至170 mg·kg-1Pb。为了充分确定钙钛矿铅泄漏导致的生态效应,本研究增设了一个最高钙钛矿泄漏梯度260 mg·kg-1Pb。
1.3.2 种植方法 播种前用蒸馏水浸泡种子10 min。土壤过8 mm 筛,拣去石块和根系,混合均匀。取一部分进行土壤理化性质的测定。
称取一定量混合均匀的土壤,倒入花盆(2 L)中,再按照铅离子浓度梯度称取碘化铅固体粉末倒入花盆,与土壤混合均匀。取大小相对一致的种子50 颗,均匀地撒播在土壤表面,再轻轻将其覆盖。
播种开始于2022 年5 月31 日,对照组、第1 组(36 mg·kg-1Pb)、第2 组(72 mg·kg-1Pb)、第3 组(130 mg·kg-1Pb)和第4 组(170 mg·kg-1Pb)分别于6 月3 日、6 月4 日、6 月3 日、6 月4 日和6 月3 日出苗,最大组(260 mg·kg-1Pb)于6 月3 日出苗,但迅速死亡。之后15 d 记录出苗数量,连续3 d 出苗数量均无变化后,于6 月17 日开始每2 d 测量幼苗高度。
1.4 测定指标
1.4.1 植物数据采集和指标计算 从播种(记为试验开始第1 天,T1)直到出苗数达到最大值N,即试验结束,当天记为Tn,每日记录每盆种子出苗数(Ni),当天记为Ti。其中,第一次出苗的前一天记为Tj。由于在260 mg·kg-1Pb 浓度下,所有幼苗均已死亡,因此以下分析均不包含该梯度的数据。
在出苗后期Tn,测量每株幼苗高度(cm)。之后拔出所有幼苗,小心扫去附着的泥土,测量鲜重;然后108 ℃杀青后,60 ℃烘干48 h 至恒重,测量其干重。
1.4.2 土壤理化性质的测定 将每个花盆内土壤取样,采用电位法[24]测定土壤pH,采用氯化钾浸提法[25]测定土壤铵态氮和硝态氮含量,使用碳氮分析仪(TOC-L CPH, 日本)测定土壤全碳含量。
1.4.3 铅含量测定 植物收获后洗净沙土,105 ℃杀青30 min,80 ℃烘干8 h 后磨碎。用四酸电热板消解土壤,用硝酸-高氯酸消解植物样品。土壤和植物样品消解后用电感耦合等离子体质谱仪(ICAP 6300, 美国)测定Pb 含量。植物Pb 富集指数=植物铅含量/土壤铅含量[26-27]。
1.4.4 植物铅耐受能力 计算不同铅胁迫梯度下垂穗披碱草幼苗高度(HPb)和生物量(BPb)分别与对照组幼苗高度(HCK)和生物量(BCK)的比值,即为高度耐受指数(height tolerance index, HTI)和生物量耐受指数(biomass tolerance index, BTI)。耐受指数反映了植物对重金属胁迫的耐受程度,当该指数大于1 时,表示该胁迫梯度对植物生物量具有促进作用,当耐受指数等于1 时,该胁迫梯度为测试植物的耐性下限;当高于某个胁迫梯度测试植物无法存活时,即耐受指数为0,此胁迫梯度为测试植物的耐性上限[28-29]。
1.5 统计分析
使用Excel 2019 进行作图,SPSS 19.0 进行单因素方差分析和Duncan 显著性检验。数据使用“平均值±标准差”表示。采用Pearson 分析土壤理化性质和垂穗披碱草幼苗性状之间的相关性,使用R 3.6.1 的corrplot 包作相关性热图。为了进一步确定钙钛矿泄漏对垂穗披碱草幼苗的影响,本研究使用结构方程模型(structural equation model, SEM)分析不同Pb 胁迫梯度如何通过影响幼苗生长进而改变其Pb 富集和耐受能力。
2 结果与分析
2.1 垂穗披碱草幼苗生长情况
不同铅浓度没有显著影响垂穗披碱草的出苗率(P=0.426),但36 和72 mg·kg-1铅浓度处理下,出苗率表现出增加的趋势。垂穗披碱草第一次出苗时间,即出苗时滞受到铅浓度的显著抑制(P=0.024),尤其是170 mg·kg-1铅浓度处理使垂穗披碱草第一次出苗时间比对照平均晚了1 d。垂穗披碱草出苗速率(P=0.050)表现为随铅浓度增加而显著降低的趋势,尤其是在170 mg·kg-1铅浓度处理下,其出苗速率下降了50.47%,但低浓度铅处理对出苗速率无显著影响。垂穗披碱草出苗持续时间(P=0.002)也随铅浓度的增加显著缩短,在170 mg·kg-1铅浓度处理下,其出苗持续时间平均缩短了4.4 d(表1)。

表1 不同铅浓度对垂穗披碱草出苗情况的影响Table 1 The effects of Pb gradients on the seedlings emergence of E. nutans
2.2 垂穗披碱草幼苗高度和生物量及耐受指数
垂穗披碱草幼苗平均高度对铅浓度具有极显著响应(P<0.001)(图1),对照组(14.26 cm)显著高于铅处理组。但不同铅处理之间无显著差异,随铅浓度增加而降低。36 和72 mg·kg-1浓度下单株生物量与对照差异不显著,但130 和170 mg·kg-1浓度下则分别显著降低37.2%和64.2%。

图1 不同铅浓度梯度处理下垂穗披碱草幼苗高度和生物量的变化Fig.1 Changes in height and biomass of E. nutans seedling with Pb concentration gradients
垂穗披碱草高度耐受指数(HTI)在所有铅浓度处理下均小于1。生物量耐受指数(BTI)在铅浓度为36 mg·kg-1时小于1,在72 mg·kg-1时与1 接近且大于1,当超过72 mg·kg-1时,显著小于1,说明垂穗披碱草幼苗对铅的耐性下限位于36~72 mg·kg-1范围内。由于垂穗披碱草幼苗在170 mg·kg-1铅胁迫下可以存活,但在本研究最大梯度260 mg·kg-1铅胁迫下种子无法萌发,因此其耐性上限位于170~260 mg·kg-1范围内(图2)。为了进一步确定BTI 耐性下限和上限,本研究将BTI 与铅浓度(Pb)进行二项式回归,结果显示BTI=0.970+0.003Pb-3.744×10-5Pb2(r2=0.827,P<0.001),因此,耐性下限为68.42 mg·kg-1,上限为205.94 mg·kg-1。
2.3 不同铅浓度处理下植物铅富集指数
随着铅浓度的增加,垂穗披碱草幼苗铅含量逐渐增加,在低铅浓度处理间(36~72 mg·kg-1)具有增加趋势,但不显著;当铅浓度超过72 mg·kg-1时,幼苗铅含量显著增加(图3)。铅胁迫显著抑制了垂穗披碱草的铅富集能力,但抑制程度与铅浓度无关。

图3 不同铅浓度梯度处理下植物铅含量和富集指数Fig. 3 The Pb concentrations of plant and the Pb accumulation index with Pb concentration gradients
2.4 不同铅浓度处理下土壤理化性质
不同铅浓度处理下土壤pH 呈降低趋势,但不显著(P=0.114),仅在最高铅浓度处理下(170 mg·kg-1)显著低于对照;土壤铵态氮(NH4+-N)含量在不同铅浓度处理下差异不显著(P=0.610),而土壤硝态氮(NO3--N)含量则随铅浓度增加呈增加趋势(P=0.204),仅在最高铅浓度处理下(170 mg·kg-1)显著高于对照;土壤总碳含量在72 mg·kg-1铅浓度处理下最低,在170 mg·kg-1铅浓度处理下最高,但与对照均无显著差异(P=0.185)(表2)。
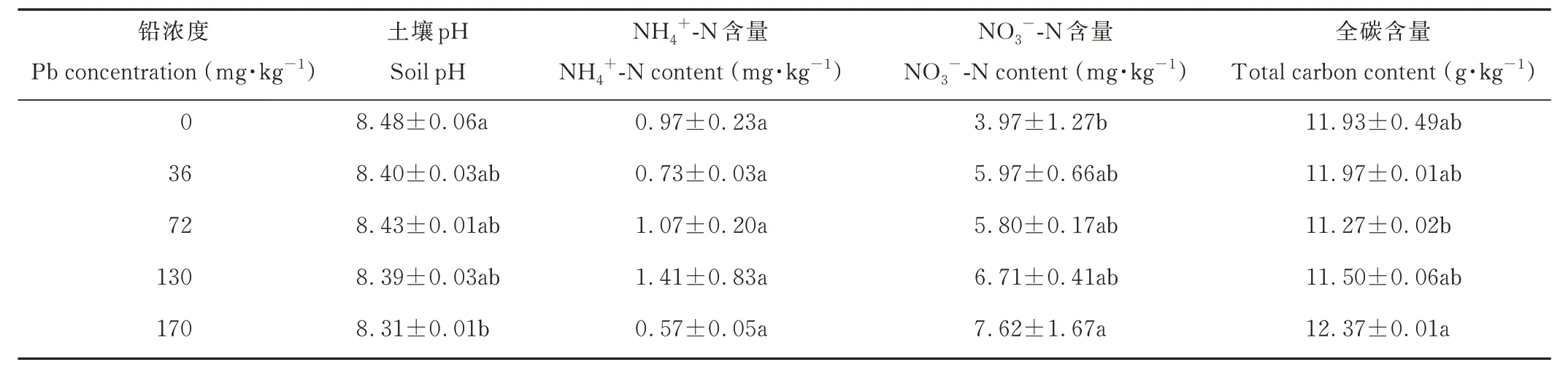
表2 不同铅浓度梯度土壤理化性质Table 2 Soil physicochemical properties with different Pb concentration gradients
2.5 不同铅浓度处理下土壤理化性质和垂穗披碱草幼苗性状的相关性分析
相关性分析表明,垂穗披碱草幼苗相关性状与土壤pH 和硝态氮(NO3--N)显著相关(图4),尤其是土壤pH与出苗率(emergence ratio)、出苗速率(emergence rate)及生物量耐受指数(BTI)显著正相关,土壤硝态氮则分别与出苗率和出苗速率显著负相关。土壤铵态氮(NH4+-N)和全碳(TC)与幼苗指标无显著相关性。
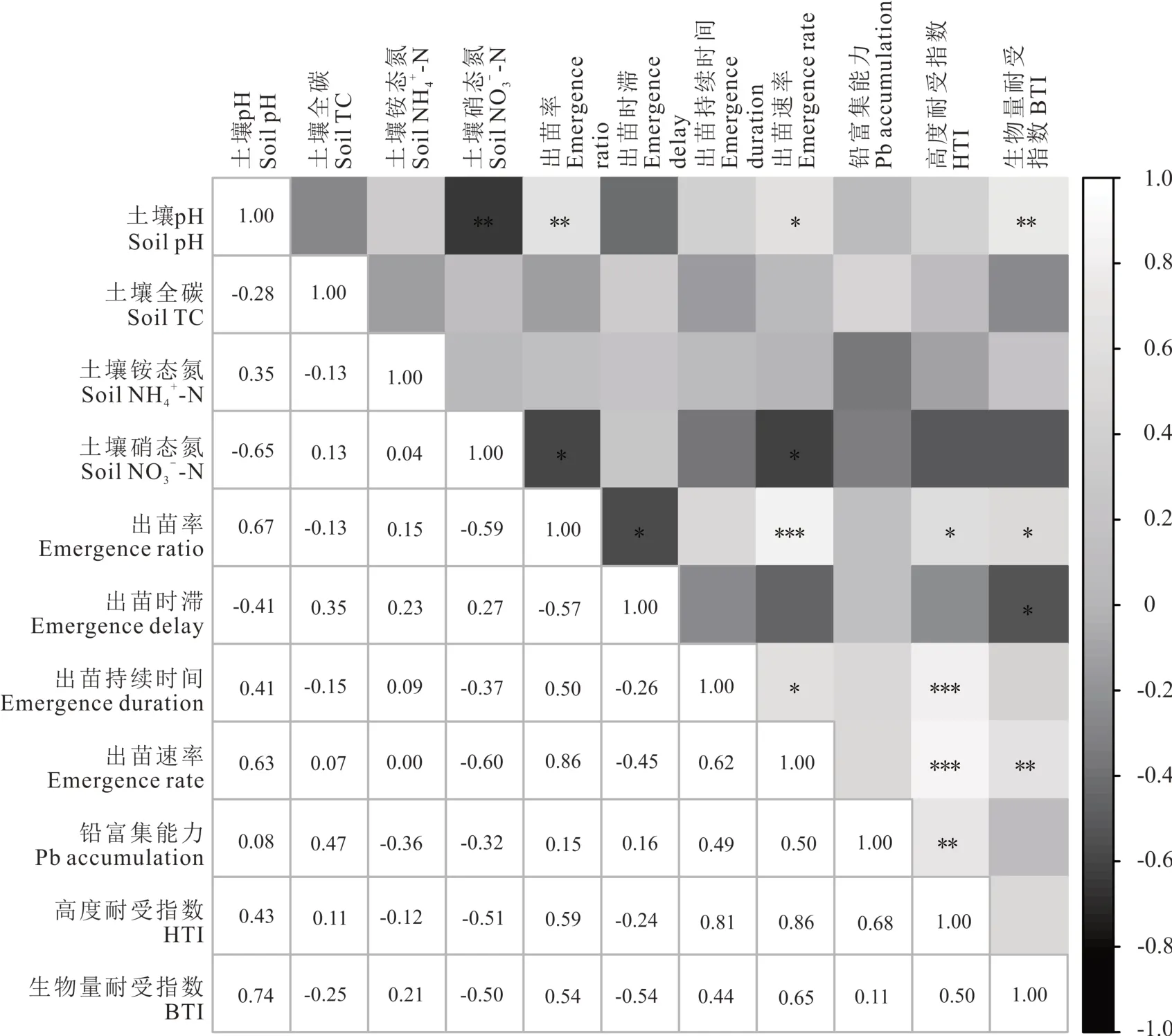
图4 土壤理化性质和垂穗披碱草幼苗性状的Pearson 相关性分析Fig.4 The Pearson correlation analysis among soil physicochemical properties and seedling characteristics of E. nutans
2.6 铅胁迫梯度下垂穗披碱草幼苗的结构方程模型分析
由土壤理化性质和垂穗披碱草幼苗的相关性分析可知(图4),土壤pH 和硝态氮是主要因子,因此,将两个因子纳入结构方程模型(SEM),探讨铅胁迫对生长情况(seedling growth)的影响。出苗率受铅胁迫影响不显著(表1),且出苗速率具有高度共线性(图4),因此,在SEM 分析中选择出苗速率、出苗时滞和出苗持续时间共同表示生长情况(图5)。此外,本研究将生物量耐受指数和高度耐受指数合并指示Pb 耐受能力(图5),纳入SEM 中进行分析。
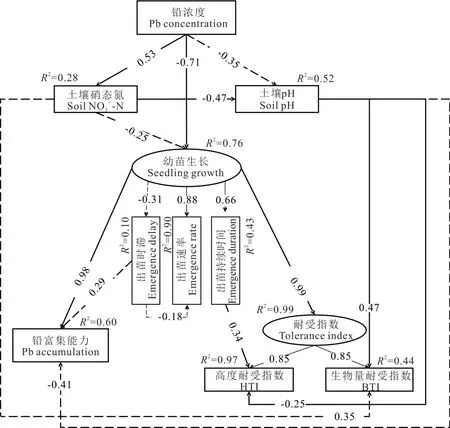
图5 铅浓度对垂穗披碱草幼苗生长情况的SEM 分析Fig.5 The SEM analysis for the seedling growth of E. nutans affected by Pb concentration gradients
SEM 分析结果表明,铅胁迫直接显著抑制垂穗披碱草幼苗生长情况(P<0.001),尤其是出苗速率和出苗持续时间,进而影响幼苗Pb 富集能力和Pb 耐受能力。铅胁迫也通过显著增加土壤硝态氮含量(P=0.020),导致土壤pH 显著降低(P=0.032),进而影响生物量耐受指数(P=0.004)和高度耐受指数(P=0.017)。生长情况则直接影响植物铅富集能力(P<0.001)和铅耐受能力(P<0.001),其中出苗持续时间显著影响高度耐受指数(P=0.001)(图5)。
综合来看,铅胁迫直接或通过土壤理化性质间接影响了垂穗披碱草幼苗生长情况、铅富集能力和铅耐受能力(表3)。其中,铅胁迫对幼苗生长情况的抑制作用最大(0.847),其次为土壤硝态氮(0.255)。对幼苗高度和生物量耐受能力影响最大的均为幼苗生长情况;其次为土壤pH。但土壤pH 主要提高生物量耐受能力,降低高度耐受能力。对幼苗铅富集能力具有最大积极影响的仍然为幼苗生长情况,达到0.889,具有最大抑制作用的为铅胁迫,达到了0.510。

表3 不同变量的综合影响系数Table 3 The standardized total effects of the variables
3 讨论
3.1 铅胁迫对垂穗披碱草出苗生长情况的影响
重金属胁迫下,植物种子萌发和出苗情况能够反映该植物种子活力和芽苗生长能力[30]。植物种子萌发和出苗情况对重金属的胁迫通常表现为浓度效应,即低浓度促进而高浓度抑制[31]。不同植物种子对同一重金属浓度的响应不同[19],铅浓度小于200 mg·L-1时可促进草地早熟禾(Poa pratensis)种子萌发,大于300 mg·L-1则表现为显著抑制作用[32];而白羊草(Bothriochloa ischaemum)种子对低浓度的铅胁迫(<100 mg·L-1)反应不敏感,在大于300 mg·L-1铅胁迫时则表现为促进作用[33]。因此,植物在重金属胁迫下存在一个积极响应和逐渐受损的过程[34]。本研究中垂穗披碱草出苗情况同样表现为浓度效应。不同的是,垂穗披碱草出苗率对铅浓度的响应较弱,仅在36 和72 mg·kg-1铅处理下表现为增加趋势,且出苗时滞少于对照处理;而随着铅浓度的增加,垂穗披碱草出苗速率逐渐降低,出苗持续时间逐渐缩短。这表明72 mg·kg-1铅浓度可能是影响垂穗披碱草出苗情况的关键浓度,该浓度处理下,一些与种子萌发相关的酶活性可能被促进[31],从而导致了其具有较高的出苗率和更快的出苗时间。
3.2 铅胁迫对垂穗披碱草耐受能力的影响
垂穗披碱草幼苗高度和生物量对铅胁迫梯度响应不同,单株幼苗生物量对小于72 mg·kg-1的铅胁迫响应不显著,对大于该铅浓度的处理表现为显著降低。这可能与植物的浓度效应有关[31],超出一定重金属胁迫浓度,植物体内重金属敏感基因表达将会受到显著抑制,导致植物营养元素吸收平衡紊乱,阻碍植物生物量的积累[35]。垂穗披碱草幼苗高度在铅胁迫时显著降低,与李慧芳等[36]的研究结果一致。但本研究同时表明,在不同铅浓度处理之间垂穗披碱草幼苗高度不存在显著差异,没有表现出浓度效应。可见,垂穗披碱草幼苗高度和生物量对铅胁迫的显著响应,可能与垂穗披碱草自身出苗情况有关[37-38]。出苗情况是影响垂穗披碱草高度和生物量耐受能力最重要的因子,如出苗持续时间一定程度上促进了植物的高度耐受能力。
通过对高度耐受指数和生物量耐受指数研究发现,本研究中测试的垂穗披碱草Pb 耐受范围为68.42~205.94 mg·kg-1,这远小于其他研究中的耐受范围。如刘秀梅等[28]研究认为披碱草(Elymus dahuricus)Pb 耐受范围为332.32~1315.94 mg·kg-1,徐雅梅等[39]研究认为野生垂穗披碱草的铅耐受上限达到800 mg·kg-1。这可能是由于植物物种差异[40-41]、Pb 胁迫处理时间不同[42]或评价指标不同[22]导致的。刘秀梅等[28]使用的披碱草与本研究中的不同,且Pb 胁迫处理时间为幼苗长出第一片真叶后的第20 天。尽管本研究和徐雅梅等[39]使用的为同一物种,但本研究使用材料为西南民族大学垂穗披碱草“康北”品种,徐雅梅等[39]使用的为野生垂穗披碱草,且耐性指标主要为叶绿素含量、细胞质膜透性等。
3.3 铅胁迫对垂穗披碱草幼苗铅含量和富集指数的影响
面对单一重金属胁迫时,植物体内重金属含量随胁迫程度增加而增加,但重金属富集能力逐渐降低[35-36]。本研究中垂穗披碱草铅含量随铅浓度增加而显著增加,但铅含量始终低于铅胁迫水平。这是由于本研究中垂穗披碱草只在四叶期进行取样,因此铅含量较低。随着植物生长期的延长,铅富集能力将逐渐增加到一个最大值,这个时期通常是植物从营养生长向生殖生长的过渡期,此时植物铅含量和富集能力开始下降[35]。在一项关于同属披碱草对铅胁迫响应的研究中显示,成体时的该披碱草铅含量显著高于铅胁迫浓度[43]。本研究中垂穗披碱草铅富集能力在受到铅胁迫时显著低于对照,且在72 mg·kg-1铅浓度处理下最低。植物对Pb 的富集能力不仅与自身有关,而且随土壤理化性质的改变而发生变化[44],如土壤Pb 含量[26]、土壤pH 值[45]等。本研究发现,铅胁迫梯度对幼苗铅富集能力具有最大的直接抑制作用,其次为土壤pH。
4 结论
Pb 胁迫并未改变垂穗披碱草的出苗率,但显著抑制其出苗速率、出苗持续时间、幼苗高度、富集系数和耐受系数等(P<0.05)。单株幼苗生物量则表现为浓度效应,铅浓度小于72 mg·kg-1无显著作用,大于72 mg·kg-1时表现为抑制作用。垂穗披碱草幼苗对Pb 胁迫的耐受范围为68.42~205.94 mg·kg-1。
Pb 胁迫主要通过两个途径影响垂穗披碱草幼苗的富集能力和耐受能力:1)直接影响幼苗生长情况,进而抑制其富集能力和耐受能力,尤其是出苗持续时间对高度的影响;2)直接增加土壤硝态氮含量,降低pH 值,显著抑制幼苗高度和增加幼苗生物量(P<0.05)。
综上所述,在一定Pb 胁迫梯度下,可以通过提高土壤pH 值,增加垂穗披碱草生物量,同时降低其生长高度和Pb 富集能力。

