铝胁迫对西藏野生垂穗披碱草种子萌发及幼苗生长的影响
蔺永和,吴景,方江平,张卫红,苗彦军*,李勇胜
(1.西藏农牧学院,西藏 林芝 860000;2.兰州大学草地农业科技学院,甘肃 兰州 730020;3.扬州大学动物科学与技术学院,江苏 扬州225009)
目前,酸性土壤约占世界可耕地面积的40%,是影响作物生产的一个重要因素[1]。除自然因素外,一些人为因素也会导致土壤酸化,例如过度使用化肥、氮浸出、有机质累积及各种酸性污染物的排放等[2]。铝属于轻金属,在地壳中的含量仅次于氧和硅,是含量最高的金属元素[3]。在中性土壤环境中,铝主要以铝硅酸盐和氧化物的形式存在于地壳中,当土壤pH<5时,铝会由对植物无毒性的铝硅酸盐或氧化物,溶解形成对植物具有毒性的铝离子(Al3+)形式,从而影响植物生长[4],因此,铝毒是酸性土壤中造成作物减产的主要因素。铝毒可以快速抑制植物根系生长[5],阻碍细胞伸长和分裂[6],降低植物对水分的吸收和养分的摄取[7],最终导致作物减产。所以解决土壤酸铝毒害问题,揭示酸铝毒害植物的机理,对提高作物产出具有重要意义。
垂穗披碱草(Elymusnutans)是多年生冷季型禾本科牧草,主要分布在我国青藏高原西北和西南地区,能在海拔5200 m以上的喜马拉雅山地区良好生长,作为青藏高原草地中的建群种,是草原和草甸的重要组成部分[8-9]。垂穗披碱草长期在恶劣的环境条件下生长,经过漫长的自然选择,逐渐形成了具有高度抗寒、抗旱等珍贵的遗传基因[10]。目前,就垂穗披碱草抗寒[11-12]、抗旱[13]及耐盐碱[14]等方面的研究较多,但对耐酸铝方面的报道较为少见。有研究报道,在酸性环境下,即使微摩尔浓度的Al3+,也会对植物造成毒害[15-16]。至今,人们对植物耐铝机制的认识仍不是很清楚,但有许多研究表明铝对植物细胞的毒害影响首先表现在细胞膜上[17],导致细胞膜脂过氧化,丙二醛含量升高,质膜透性增加,破坏细胞成分并扰乱细胞代谢过程,干扰植物生长发育,甚至导致植物死亡[18]。但有些植物物种逐渐进化形成了降低铝毒影响的策略,可以在酸铝土壤中生长良好,并在植物组织中富集大量的铝,且不表现出毒性症状。
种子萌发和幼苗生长是植物能否在酸铝环境中成功建植的先决条件。目前,酸铝胁迫对西藏野生垂穗披碱草种子萌发和幼苗生长的研究尚未见报道。本试验以采自西藏不同区域的野生垂穗披碱草种子为材料,研究酸铝胁迫对垂穗披碱草种子萌发、幼苗生长、MDA含量、可溶性糖含量、铝富集及磷含量的影响,以期为酸铝污染土壤的改良提供一定的科学依据和宝贵的植物资源。
1 材料与方法
1.1 试验材料
青藏高原自然环境的主要特点是海拔高、降水少、寒冷、紫外线辐射强烈等。本试验供试材料为采自西藏自治区那曲县、申扎县及浪卡子县的野生垂穗披碱草种子,具体采集地点、采集年份及生长环境如表1所示。

表1 试验材料Table 1 The sources of the test materials
1.2 试验设计
试验于2016年5-6月在西藏农牧学院高寒草地教学实验室进行。种子萌发试验及铝富集试验均在条件为光照14 h/25 ℃,黑暗10 h/20 ℃的人工气候箱中进行。
萌发试验设计:选取籽粒均匀一致且饱满的垂穗披碱草种子,用2%的次氯酸钠消毒10 min,然后用蒸馏水充分冲洗,接着将消毒后的种子分别用浓度为0(CK)、0.5、1.0、1.5 mmol·L-1的AlCl3(pH 4.5)溶液浸泡2 h。将消毒且浸泡后的种子均匀摆放到垫有两层滤纸的培养皿(d=9 cm)中,每个培养皿中添加5 mL不同浓度的Al3+溶液(pH 4.5),同时摆放30粒种子,每个处理设5个重复。每天定时添加蒸馏水,以保持滤纸湿润。发芽试验结束后计算发芽势、发芽率、幼苗根长、株高、根重、茎叶重、丙二醛及可溶性糖含量。
铝富集试验设计:将消毒且通过蒸馏水浸泡后的垂穗披碱草种子置于垫有两层滤纸且含有蒸馏水的培养皿中催芽7 d后,挑选出生长均一的幼苗转移至盛有蛭石的塑料篮中并置于含有1/2 Hoagland营养液(pH 4.5)的塑料盆中培养,1/2 Hoagland 营养液中大量元素包括KNO3(2.5 mmol·L-1),Ca(NO3)2(2.5 mmol·L-1),MgSO4(1 mmol·L-1)和NH4H2PO4(0.5 mmol·L-1),微量元素包括 NaFeEDTA(50 μmol·L-1),H3BO3(7.5 μmol·L-1),MnCl2(1.25 μmol·L-1),CuSO4(0.5 μmol·L-1),ZnSO4(1 μmol·L-1),持续培养一周。接着将1/2 Hoagland营养液换为含有不同浓度Al3+(0、1.5 mmol·L-1)的1/2 Hoagland营养液(pH 4.5),每隔一天换一次处理液,连续处理10 d,各处理设置5个重复。Al3+处理10 d后,计算根系及地上部含水量、磷含量及铝富集量。
1.3 试验方法
1.3.1发芽参数的测定 每天定时观察并记录发芽的种子数,发芽试验在第7天时计算发芽势,第14天时计算发芽率。1)发芽势=(前7 d正常的种苗数/供试种子数)×100%;2)发芽率=(前14 d正常的种苗数/供试种子数)×100%。
1.3.2生长指标的测定 发芽试验结束后,从每个培养皿中取出均匀一致的10株幼苗,用直尺(0.1 cm)测量幼苗的根长和株高,再把幼苗分为地上和地下两部分,用万分之一的天平(0.0001 g)称量幼苗的根重和茎叶重。
1.3.3生理指标的测定 发芽试验结束后,取植株幼苗,采用硫代巴比妥酸法[19]测定丙二醛(MDA)含量,蒽酮法测定可溶性糖含量[19]。
1.3.4含水量测定 含水量=[(组织鲜重-组织干重)/组织鲜重]×100%
1.3.5铝富集及磷含量的测定 称取0.2 g研磨均匀的植物样品,置于消化管中,加入10 mL的硝酸、高氯酸和硫酸(8∶1∶1)混合液,然后置于消化炉上消化,当消化液呈现无色透明状时,将其转移并定容至100 mL容量瓶中。采用铬天青S分光光度法测定植物组织中的铝含量[20];采用钼锑抗比色法测定植物组织中磷含量。
1.3.6抗铝毒的评价方法 抗铝毒的评价采用隶属函数法[21],以3个不同区域野生垂穗披碱草在不同浓度Al3+处理下的发芽势、发芽率、根长、株高、根重、茎叶重、MDA含量、可溶性糖含量作为指标进行综合评价。计算公式如下:
D1(Xi)=(Xi-Xmin)/(Xmax-Xmin)
式中:Xi代表第i个指标值,Xmax代表所有品种第i个指标的最大值,Xmin代表所有品种第i个指标的最小值。若所测指标与植物的耐铝性呈负相关,则用反隶属函数计算其抗铝隶属函数值。
D2(Xi)=1-(Xi-Xmin)/(Xmax-Xmin)
根据3个不同区域野生垂穗披碱草各指标的具体隶属函数值,计算出平均值后进行比较,平均值越大说明该牧草的抗铝毒能力越强。
1.4 数据处理与分析
采用Microsoft Excel 2010进行数据的初步整理及图表的绘制,采用SPSS 19.0软件One-way ANOVA进行方差分析,样本间差异显著性用Duncan检测法分析。
2 结果与分析
2.1 Al3+对垂穗披碱草种子发芽势和发芽率的影响
2.1.1Al3+对垂穗披碱草种子发芽势的影响 发芽势是评估种子发芽整齐度及发芽速率的重要指标之一。由图1可知,随Al3+浓度升高,那曲垂穗披碱草种子发芽势呈先升高后降低的趋势,这说明低浓度的Al3+(0.5 mmol·L-1)对种子发芽势具有促进作用,且与对照相比,升高了2.2%,但差异水平不显著(P>0.05),当Al3+浓度为1.5 mmol·L-1时,发芽势为25.3%,较对照显著降低了57.8%(P<0.05);申扎垂穗披碱草种子的发芽势与Al3+浓度呈负相关关系,1.5 mmol·L-1Al3+处理时,其发芽势降到最低,为40.0%,较对照显著降低了31.8%(P<0.05);浪卡子垂穗披碱草种子的发芽势随Al3+浓度的升高而显著降低,各处理组与对照间差异水平均显著(P<0.05),当培养液中Al3+浓度为0.5、1.0和1.5 mmol·L-1时,其发芽势分别为42.7%、37.3%和20.0%,与对照相比,分别被显著抑制了27.3%、36.4%和65.9%。
2.1.2Al3+对垂穗披碱草种子发芽率的影响 随Al3+浓度升高,3种野生垂穗披碱草种子的发芽率均表现出降低的变化规律(图2)。Al3+浓度≤1.0 mmol·L-1时,那曲和浪卡子垂穗披碱草种子发芽率与对照间无显著性差异(P>0.05),但1.5 mmol·L-1Al3+处理时,这两种垂穗披碱草种子发芽率分别较对照显著降低了52.6%和32.1%(P<0.05);通过显著性分析,发现申扎垂穗披碱草种子发芽率在各处理组间差异水平均不显著(P>0.05)。这表明,在本研究范围内,Al3+对申扎垂穗披碱草种子的发芽率没有明显影响(P>0.05),与之相反,高浓度的Al3+(1.5 mmol·L-1)显著抑制那曲和浪卡子垂穗披碱草种子发芽率(P<0.05)。

图1 Al3+胁迫对垂穗披碱草种子发芽势的影响Fig.1 Effect of Al3+stress on germination vigor in E. nutans

图2 Al3+胁迫对垂穗披碱草种子发芽率的影响Fig.2 Effect of Al3+stress on germination rate in E. nutans
不同小写字母代表不同处理之间差异显著(P<0.05)。那曲、申扎、浪卡子分别代表采自那曲、申扎、浪卡子的披碱草种子。下同。Different small letters represent the significant differences of different treatments (P<0.05). Naqu represent NaquE.nutans, Shenza represent ShenzaE.nutans, Nagarzê represent NagarzêE.nutans. The same below.
2.2 Al3+对垂穗披碱草幼苗生长指标的影响
2.2.1Al3+对垂穗披碱草幼苗根长和株高的影响 在不同浓度的Al3+胁迫下,3种垂穗披碱草幼苗的根长和株高均随Al3+浓度的升高而降低(图3A,B)。那曲和申扎垂穗披碱草幼苗根长在各处理组间差异水平显著(P<0.05);浪卡子垂穗披碱草幼苗根长在Al3+浓度为1.0和1.5 mmol·L-1之间不存在显著性差异(P>0.05),但与对照相比,差异水平显著(P<0.05)。当Al3+浓度为1.5 mmol·L-1时,3种垂穗披碱草幼苗根长均降到最低,分别为0.12、0.48和0.45 cm,其抑制率分别达到97%、90%和86%,这表明,在高浓度Al3+(1.5 mmol·L-1) 处理下,那曲垂穗披碱草根长受抑制程度最为明显,其次为申扎垂穗披碱草,而浪卡子垂穗披碱草根长受抑制程度最小。

图3 Al3+胁迫对垂穗披碱草根长、株高、根重及茎叶重的影响Fig.3 Effects of Al3+ stress on root length, plant height, root weight and shoot weight in E. nutans
与对照相比,Al3+胁迫显著抑制了3种垂穗披碱草的株高(P<0.05) ,当Al3+浓度为0.5和1.0 mmol·L-1时,那曲和浪卡子垂穗披碱草幼苗株高间差异水平均不显著(P>0.05),而申扎垂穗披碱草相反;当Al3+浓度为1.0和1.5 mmol·L-1时,申扎和浪卡子垂穗披碱草幼苗株高间均无显著性差异(P>0.05),而那曲垂穗披碱草却相反。1.5 mmol·L-1的Al3+对3种垂穗披碱草幼苗的株高抑制最为明显,那曲、申扎及浪卡子垂穗披碱草幼苗株高抑制率分为46.6%、40.9%和29.9%。这与根长受抑制程度具有相似的变化规律,同时,根长受抑制程度远远大于株高,这表明Al3+胁迫主要影响垂穗披碱草的根系伸长。
2.2.2Al3+对垂穗披碱草幼苗根重和茎叶重的影响 由图3C,D可知,3种垂穗披碱草幼苗根重和茎叶重均与Al3+浓度呈负相关关系,即随Al3+浓度的升高,垂穗披碱草根重和茎叶重降低。当Al3+浓度从0.5 mmol·L-1上升到1.5 mmol·L-1,与对照相比,那曲垂穗披碱草幼苗根重分别较对照显著降低了52.2%、72.8%和85.5%(P<0.05),申扎分别降低了30.1%、71.0%和88.0%,浪卡子分别降低了22.7%、51.4%和78.0%;那曲垂穗披碱草幼苗茎叶重抑制率分别为21.2%、31.7%和44.6%,申扎分别11.2%、33.8%和43.3%,浪卡子分别为16.2%、30.9%和42.4%。那曲和浪卡子垂穗披碱草幼苗根重和茎叶重在各处理组间均存在显著性差异(P<0.05);低浓度的Al3+(0.5 mmol·L-1) 处理,申扎垂穗披碱草根重和茎叶重与对照间差异水平均不显著(P>0.05),同时,其根重和茎叶重在两个高浓度Al3+(1.0和1.5 mmol·L-1)处理组间也不存在显著性差异(P>0.05),但当Al3+浓度≥1.0 mmol·L-1时,与对照相比,差异水平显著(P<0.05)。同时,结果还表明,Al3+对3种垂穗披碱草幼苗根重的影响大于对茎叶重的影响,这与Al3+对根长和株高的影响结果是一致的。
2.2.3Al3+对垂穗披碱草幼苗含水量的影响 由图4可知,Al3+胁迫条件下,3种垂穗披碱草幼苗地上部和根系含水量呈现出不同的变化趋势。与对照相比,处理组中3种垂穗披碱草根系含水量降低较为缓慢,但地上部含水量急剧降低。1.5 mmol·L-1Al3+处理时,那曲、申扎和浪卡子垂穗披碱草根系含水量分别较对照降低了1.6%、0.8%和0.1%,地上部含水量分别较对照降低了2.4%、3.7%和2.1%。这表明Al3+胁迫抑制了植物对水分的吸收,且主要降低了植物地上部分的含水量,而根系含水量降低不明显可能与根系直接与培养液接触有关。
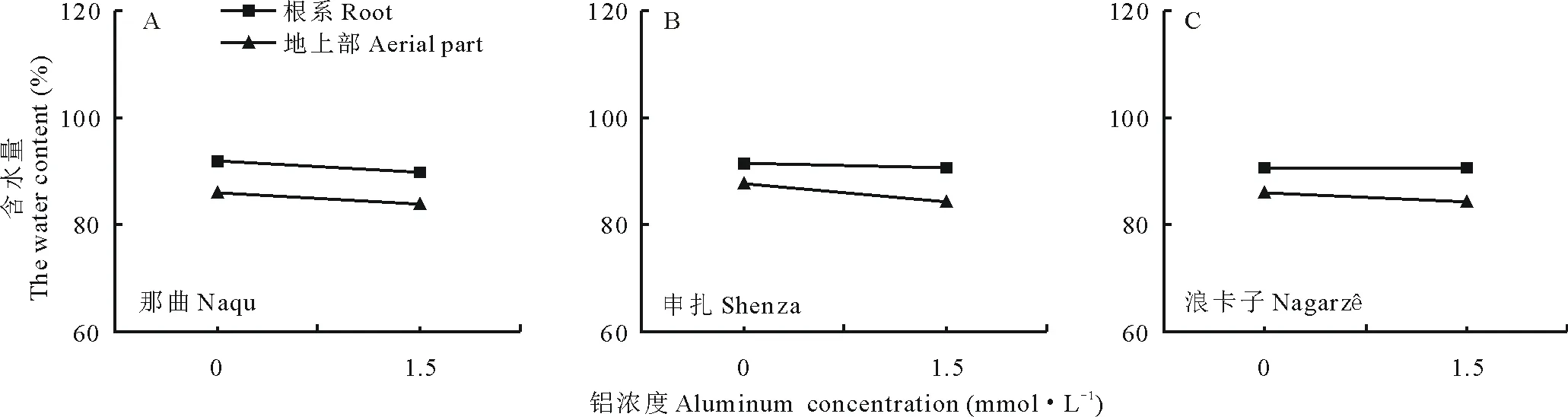
图4 Al3+对垂穗披碱草幼苗含水量的影响Fig.4 Effect of Al3+ stress on water content in E. nutans seedlings
2.3 Al3+对垂穗披碱草幼苗生理指标的影响
2.3.1Al3+对垂穗披碱草幼苗MDA的影响 丙二醛(MDA)是评估植物在逆境环境中膜脂过氧化水平的指标,MDA在植物机体内的富集会对细胞造成毒害作用,它能够导致细胞膜功能降低,从而使膜整体性受到破坏,表现为膜透性增大和离子泄漏。由图5可知,Al3+胁迫显著提高了3种垂穗披碱草幼苗中的MDA含量(P<0.05),1.0和1.5 mmol·L-1Al3+处理时,那曲垂穗披碱草幼苗MDA含量间差异水平不显著(P>0.05),但与低浓度(0,0.5 mmol·L-1)相比,达到显著差异水平(P<0.05);申扎和浪卡子垂穗披碱草幼苗MDA含量在各处理组间均达到显著性差异水平(P<0.05)。Al3+浓度为1.5 mmol·L-1时,那曲、申扎和浪卡子垂穗披碱草幼苗MDA含量均达到最高值,分别是对照的2.48、2.98和2.76倍。说明高浓度Al3+处理时,申扎垂穗披碱草幼苗膜质过氧化水平最高,其次是浪卡子垂穗披碱草,而那曲垂穗披碱草最低。
2.3.2Al3+对垂穗披碱草幼苗可溶性糖含量的影响 有机物在植物不同组织和细胞间的贮存及消耗需要一定的运输过程,如果植物某组织中积累可溶性糖,表明可溶性糖在该组织中大量合成或运输受到阻碍。有机物只有在植物体内井然有序地合成、运输及贮存,才能确保植物各种生理生化过程有条不紊地进行。3种垂穗披碱草幼苗可溶性糖含量随着Al3+的添加而增加,那曲垂穗披碱草增加幅度最小,当Al3+浓度≥1.0 mmol·L-1时,与对照组间差异水平显著(P<0.05),而申扎和浪卡子垂穗披碱草均在Al3+浓度≥0.5 mmol·L-1时与对照组间达到显著性差异(P<0.05)。1.5 mmol·L-1Al3+处理时,那曲、申扎和浪卡子垂穗披碱草幼苗可溶性糖含量分别是对照的1.14、2.17和1.79倍(图6)。
2.4 Al3+胁迫对垂穗披碱草幼苗铝富集的影响
为了研究Al3+胁迫对3种野生垂穗披碱草不同组织铝富集的影响,本研究测定了植物根系和地上部铝含量。研究发现3种野生垂穗披碱草幼苗受到1.5 mmol·L-1Al3+胁迫时,不同组织中的铝富集量均升高(图7),且根系中均高于地上部。在Al3+处理条件下,那曲垂穗披碱草根系和地上部铝含量分别为136.42和11.15 μg·g-1,分别为对照的2.00和1.86倍(图7A);申扎垂穗披碱草分别为185.53和12.12 μg·g-1,分别是对照的2.27和1.64倍(图7B);浪卡子垂穗披碱草分别为172.66和9.86 μg·g-1,分别是对照的2.38和2.77倍(图7C),且3种野生垂穗披碱草幼苗没有表现出中毒症状。

图5 Al3+对垂穗披碱草幼苗丙二醛含量的影响Fig.5 Effect of Al3+ stress on the content of MDA in E. nutans

图6 Al3+对垂穗披碱草幼苗可溶性糖含量的影响Fig.6 Effect of Al3+ stress on the content of soluble sugar in E. nutans

图7 Al3+对垂穗披碱草幼苗铝富集的影响Fig.7 Effect of Al3+ stress on the aluminum accumulation in E. nutans

图8 Al3+对垂穗披碱草幼苗磷含量的影响Fig.8 Effect of Al3+ stress on the phosphorus content in E. nutans
2.5 Al3+胁迫对垂穗披碱草幼苗磷含量的影响
磷是核蛋白、核酸磷脂等的重要组成部分,同时也在糖、蛋白质和脂肪代谢中起着重要作用。由图8可知,在Al3+胁迫下,3种垂穗披碱草幼苗的地上部和根系中的磷含量均呈现出降低的趋势,且根系磷含量高于地上部。在Al3+胁迫条件下,那曲垂穗披碱草根系和地上部磷含量较对照分别降低了48.4%和69.9%(图8A),申扎垂穗披碱草分别较对照降低了33.3%和60.7%(图8B),而浪卡子垂穗披碱草分别较对照降低了5.9%和34.7%(图8C)。这表明铝胁迫抑制了植物对磷的吸收及运输。
2.6 不同区域垂穗披碱草抗铝毒能力评价
不同野生垂穗披碱草在不同浓度Al3+胁迫下,萌发期及幼苗期各指标对Al3+胁迫的响应各不相同,因此采用隶属函数法对3个不同区域野生垂穗披碱草萌发期在Al3+胁迫下的8个指标进行综合分析。由表2得知,申扎垂穗披碱草的隶属函数平均值最大,为0.58,是3个野生垂穗披碱草中抗Al3+胁迫能力最强的。浪卡子垂穗披碱草的隶属函数平均值最小,为0.42,抗Al3+胁迫能力最弱。
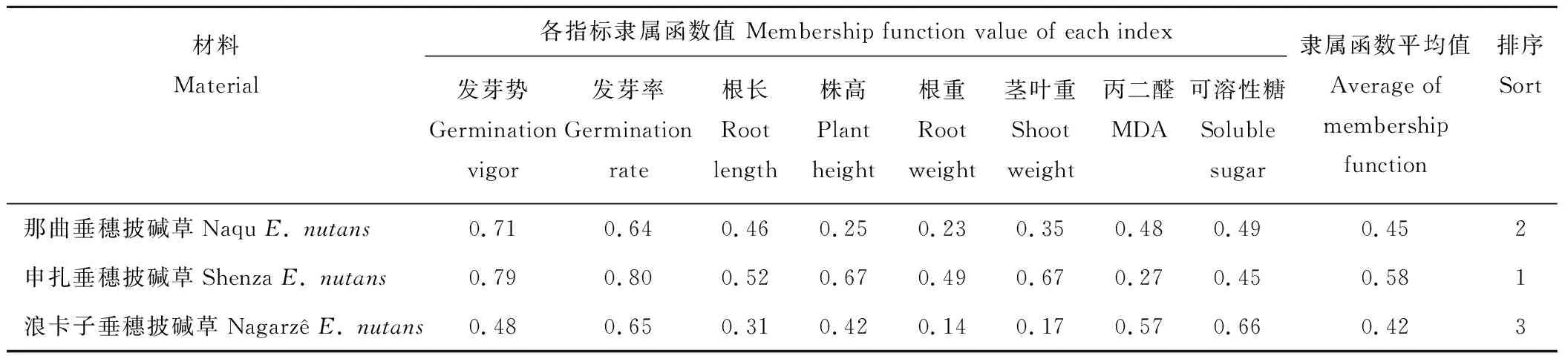
表2 各野生垂穗披碱草抗Al3+胁迫隶属函数比较Table 2 Comparison of the Al3+ stress subordinate function of 3 species of wild E. nutans
3 讨论
筛选适合酸铝胁迫土壤条件下的具有高产性能的植物是植物修复土壤中酸铝毒害的关键,而植物种子的萌发和幼苗的生长是植物能否成功繁殖的决定性条件,也是植物能否进行酸铝环境中植被恢复和修复污染土壤的前提。
发芽势及发芽率是衡量种子萌发的重要指标。不同浓度Al3+对发芽势的影响大于发芽率,只有1.5 mmol·L-1Al3+对那曲和浪卡子垂穗披碱草种子的发芽率有显著性抑制作用(P<0.05),而Al3+对申扎垂穗披碱草种子的发芽率没有明显影响(P>0.05),这表明Al3+降低了垂穗披碱草种子的发芽时间,有研究发现Al3+可以降低水稻(Oryzasativa)和小麦(Triticumaestivum)的发芽率和发芽时间[22-23],本研究结果与其一致。
本研究还发现,Al3+胁迫下,3种垂穗披碱草的根长、株高、根重及茎叶重均受到不同程度的抑制,相对植物地上部而言,几乎所有研究都表明植物根系是对铝毒最敏感的部位之一。据报道,植物根系伸长在微摩尔的Al3+胁迫几个小时甚至几分钟后就能被观察到[24]。本研究发现不同浓度的Al3+处理下,3种野生垂穗披碱草根长均达到显著性差异水平(P<0.05)。Al3+胁迫下根系伸长受抑制的机制是涉及生理学、形态学、解剖学及分子学等的复杂过程[16]。铝毒主要影响植物根尖[25],抑制根尖细胞分裂和伸长[26],从而抑制水分的吸收和养分的摄取[27]。
铝毒影响植物的主要症状之一是脂质过氧化,膜被损伤且形成丙二醛,因此MDA被认为是膜质过氧化程度的主要指标之一[28]。比较3种野生垂穗披碱草幼苗MDA变化时发现,与对照组相比,处理组中幼苗MDA含量均显著升高(P<0.05),这表明自由基诱导的膜脂过氧化程度随Al3+浓度的升高而增强,植物细胞也受到越来越严重的损伤。当植物细胞膜的完整性受到破坏后,使得细胞膜透性增大,可溶性物质发生外渗,细胞内酶及蛋白代谢紊乱,为了缓解这种损伤,植物通常会主动积累可溶性糖等渗透调节物质来维持组织内部渗透平衡[29]。可溶性糖不但能够维持膜结构的完整性,还能为其他渗透调节物质合成碳源[30]。本试验中,随着Al3+的添加,申扎垂穗披碱草幼苗中可溶性糖含量显著升高(P<0.05),而当Al3+浓度≥1.0 mmol·L-1时,那曲和浪卡子垂穗披碱草幼苗可溶性糖含量也显著升高(P<0.05)。高浓度的Al3+导致可溶性糖含量升高可能是因为垂穗披碱草启动应急渗透调节机制,分解大分子碳水化合物,合成大量可溶性糖,以应对Al3+胁迫诱导的渗透失衡。
本研究表明,3种野生垂穗披碱草根系和茎叶中的铝富集量随铝浓度升高而升高,另外,植物根系中的铝富集量总是高于茎叶中,这表明较少的铝从根系转移到植物地上部,这种低的转移可能是由铝与有机酸阴离子在细胞壁中结合并保留在根系中的原因引起的。本研究与在马铃薯(Solanumtuberosum)幼苗中的研究结果是一致的[31]。Al-Qahtani[32]指出一些植物具有富集大量金属的能力,且根系与茎叶中富集量之比小于1时,该植物被称作该金属的超富集植物,例如绣球花属植物、荞麦(Fagopyrumesculentum)及茶叶等[33-34]。根据目前的研究结果,垂穗披碱草不能被认为是铝超富集植物。
铝毒毒害植物是多方面的,例如它可以影响植物对矿质元素的吸收。P是植物生长发育所需要的大量元素之一,铝敏感的植物对P的利用效率很低,铝抑制了P的吸收,但铝耐受植物与P利用效率呈正相关[35]。陈文荣等[36]对荞麦进行铝处理时发现地下和地上部分P含量均降低;但Mugwira等[37]研究发现铝促进了小黑麦(Secalesylvestre)和黑麦(Secalecereale)根系对P的吸收;而董晓英等[38]研究表明0.1 mmol·L-1Al3+处理胡枝子(Lespedezabicolor)时,植物组织中的P含量无显著变化。本试验结果表明,Al3+抑制了3种野生垂穗披碱草对P的吸收及转运,这与陈文荣等[36]的研究结果一致。
本研究发现,Al3+胁迫对来自不同地区的垂穗披碱草种子的萌发及幼苗生长的影响各不相同,由隶属函数法评估3种垂穗披碱草对Al3+的抗性得知,申扎垂穗披碱草抗铝性最优,其次是那曲垂穗披碱草,最后是浪卡子垂穗披碱草。有趣的是,本研究发现3种垂穗披碱草抗铝性与采集地海拔呈负相关,这可能是由于野生垂穗披碱草在长期适应生境的过程中产生变异或者由于生境的不同而使遗传背景不同所导致的,具体原因尚待进一步研究。
4 结论
通过对西藏3种野生垂穗披碱草响应Al3+胁迫的研究表明,Al3+降低了3种野生垂穗披碱草种子的发芽率及发芽时间,抑制了根系及地上部分的生长,且对根系的抑制强于对地上部分;随Al3+浓度的升高,3种野生垂穗披碱草幼苗MDA和可溶性糖含量也随之升高;Al3+处理后,3种垂穗披碱草幼苗组织中的铝富集量升高,且根系中的高于地上部;Al3+抑制了野生垂穗披碱草对P的吸收及转运。通过隶属函数法评估3种野生垂穗披碱草抗铝性得知,采自申扎县雄梅镇的垂穗披碱草对铝的抗性最强,可驯化育种,为酸铝土壤的改良提供宝贵的种质资源。

