PEAR1 基因多态性与缺血性脑卒中的相关性研究
张云芳,庄杉杉,余 艳,李 铮,吴晓明,聂晓改
(昆明医科大学附属延安医院医学检验科,云南 昆明 650051)
缺血性脑卒中是由于多种因素引起的脑血管病变,发生缺血缺氧并产生组织坏死,最终导致神经功能障碍的一组疾病,约占脑卒中的60%~80%[1]。在全球,脑卒中患病率均处于较高水平,随之而来的死亡率也逐渐引起关注,在欧美国家中,脑卒中是排在冠心病和癌症之后的第3 位死亡原因。在我国,脑卒中严重威胁国民健康,已成为成人致残甚至死亡的首位病因[2]。缺血性脑卒中致病因素多样,具体病因尚未明确,发病机制较为复杂,基因多态性与疾病相关性成为新的研究热点,近年来以血小板内皮聚集受体1(platelet endothelial aggregation receptor-1,PEAR1)基因多态性位点研究颇受关注。既往有研究发现,检测冠心病和缺血性脑卒中患者的血清PEAR1水平,两类患者的PEAR1水平均升高,进一步研究发现PEAR1基因多态性可影响冠心病患者血小板黏附聚集,导致凝血系统发生变化,有引发血栓风险,发生脑卒中或再次心梗,PEAR1基因多态性与脑卒中患者用药及疾病预后相关[3]。然而,有研究者将PEAR1不同基因型与脑梗死发生复发不同周期比较,发现PEAR1基因多态性与脑梗死的发生及复发无相关性[4]。PEAR1基因多态性与缺血性脑卒中患者疾病发生的相关性尚存争议。
PEAR1是血小板之间相互作用的一种跨膜受体,在血小板和内皮细胞中均有表达,其基因由23 个外显子和22 个内含子组成,在血小板活化中起很重要的作用,参与多种血管相关疾病的发生[5-6]。在缺血性脑卒中患者血清中PEAR1水平升高,提示其与脑卒中发生可能存在关联,PEAR1可能是脑卒中发生的一个危险因子。本研究通过分析缺血性脑卒中患者PEAR1基因位点多态性并探讨其与疾病发生的相关性,为缺血性脑卒中发病机制的进一步研究及疾病治疗靶点提供科学依据及研究方向。
1 资料与方法
1.1 病例资料
收集2022 年6 月至至2023 年6 月昆明医科大学附属延安医院就诊的150 例缺血性脑卒中患者的临床资料,其中男性95 例,女性55 例,年龄45~80 岁,平均(63.75±9.67)岁。另外收集同期健康人群150 例作为对照组,其中男性88 例,女性62 例,年龄45~80 岁,平均(63.66±8.81)岁。
纳入标准:经核磁共振弥散成像或者CT 灌注成像(computed tomography perfusion imaging,CTP)检查确诊为缺血性脑卒中。入组患者诊断标准符合中国急性缺血性脑卒中诊治指南[7]。排除标准:患有心源性栓塞、心脏疾病、癫痫、脑部创伤、血管畸形、脑肿瘤,脑出血或先天性脑部疾病的患者。该研究经昆明医科大学附属延安医院医学伦理委员会批准(2022-127-01),且患者签署知情同意书。
1.2 仪器和试剂
1.2.1 主要仪器核酸提取仪(西安天隆科技有限公司)、PCR 扩增仪(上海宏石)、电泳仪(美国Bio-rad 公司)、凝胶成像系统(美国Bio-rad 公司)、荧光显微镜(德国Leica 公司)。
1.2.2 主要试剂人全血基因DNA 提取试剂盒(西安天隆科技有限公司)、内切酶BCCI(美国NEB 公司)、2×TaqPCRMasterMix(北京博迈德生物技术有限公司)、琼脂糖(北京博迈德生物技术有限公司)、DNA MarkerI(北京博迈德生物技术有限公司)、核酸染料(上海爱必梦生物科技有限公司)。
1.3 方法
1.3.1 基因组DNA 提取采集入组人群EDTA 抗凝静脉血2mL。用人全血基因DNA 提取试剂盒提取缺血性脑卒中患者及健康体检者外周血基因组DNA,方法严格按照试剂盒的说明书进行,提取产物-20℃保存。
1.3.2 PEAR1 目的基因扩增使用PCR 方法进行目的片段基因扩增,引物片段Forward: 5'-CAC TAATCTTATCCCCATTTTCTAGGTG-3',Reverse:5'-GCCCTCTCAGCCTCCGAGC-3',扩增反应总体积为25 µL,反应体系包括上下游引物各0.5 µL、DNA 模 板5 µL、2 × TaqPCRMasterMix 12.5 µL,ddH2O 6.5 µL。扩增条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,重复35 个循环后72 ℃延伸5 min。用2%琼脂糖凝胶电泳,紫外灯下观察PCR 扩增产物,扩增产物片段大小为408 bp。
1.3.3 PEAR1 基因分型PCR-RFLP 方法进行基因分型,取上述扩增成功的产物2 µL,内切酶BCCI 1 µL,10×NEBuffer 5 µL,ddH2O 42 µL。放置于37 ℃恒温箱进行至少1 h 的酶切反应然后终止。酶切产物用2%琼脂糖凝胶电泳检测,120 V电压、300 mA 电流稳压电泳40 min,紫外灯下观察酶切产物并根据条带数分型。酶切后的GG 型纯合子片段大小为408 bp 单个条带,AA 型纯合子大小为178 bp、230 bp 2 个条带,GA 型杂合子大小为408 bp、178 bp、230 bp 3 个条带,见图1。PCR 扩增产物经电泳进行初步检测后,取部分样本的PCR 扩增产物和相应引物送北京博迈德生物技术有限公司进行正反2 个方向的测序分析,以进一步验证目的片段,见图2~图3。
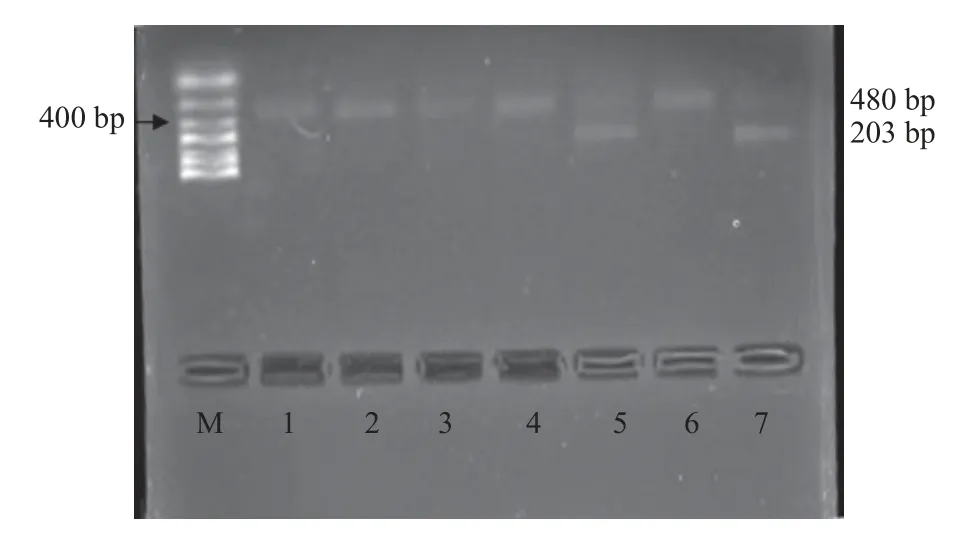
图1 PEAR1 基因凝胶电泳条带图Fig.1 PEAR1 gene gel electrophoresis band

图2 PEAR1 基因AA 基因型测序图Fig.2 PEAR1 gene AA genotype sequencing
图3 PEAR1 基因GA 基因型测序图Fig.3 PEAR1 gene AA genotype sequencing
1.4 统计学处理
数据采用SPSS19.0 软件进行分析。计量资料满足正态分布时以()表示,2 组间比较采用独立样本t检验,计数资料以例数或率表示,组间比较采用χ2检验。用卡方检验对研究对象的基因型和等位基因频率进行Hardy-Weinberg 遗传平衡检验。影响因素的筛选采用单因素方差分析(ANOVA)或独立样本t检验,用Logistic 回归分析有差异的因素,以P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料比较
缺血性脑卒中组的糖尿病、高血压比例和同型半胱氨酸(HCY)水平、高同型半胱氨酸水平比例较正常对照组高,差异有统计学意义(P<0.05)2 组的性别、年龄、血脂间差异无统计学意义(P>0.05),见表1。
表1 缺血性脑卒中组和正常对照组一般资料比较[n(%)/ ]Tab.1 Comparison of general data between ischemic stroke group and normal control group[n(%)/ ]
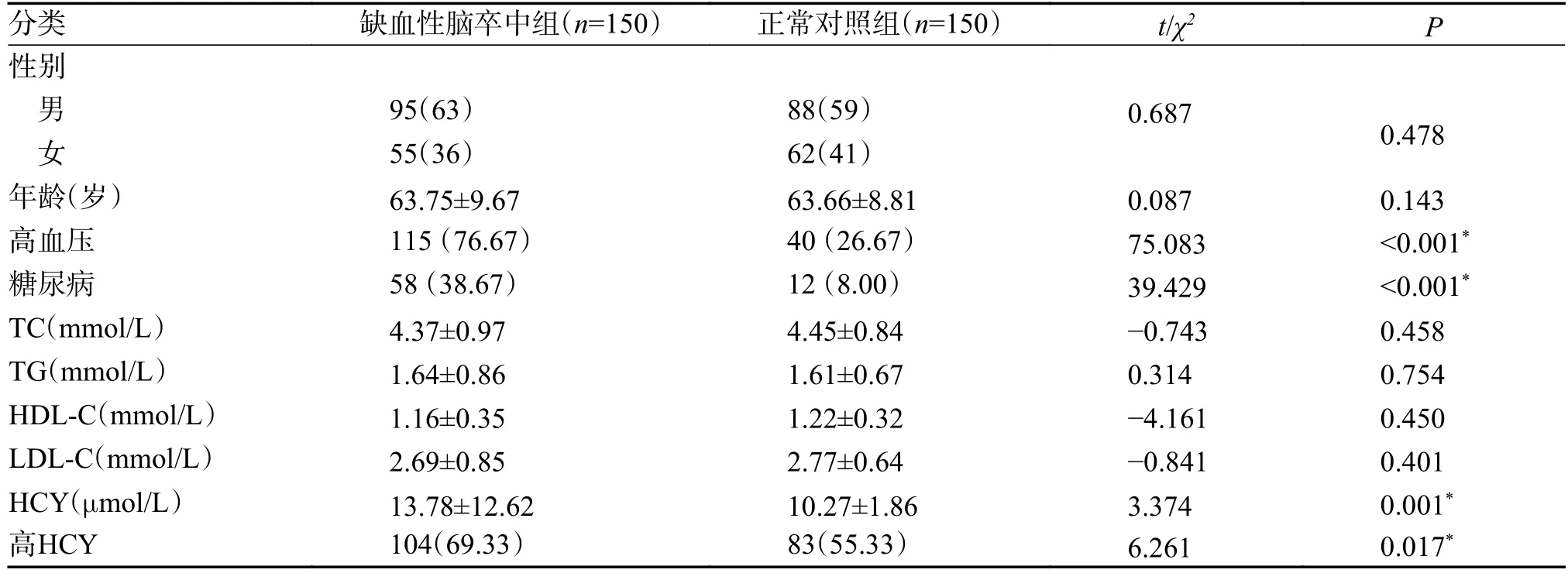
表1 缺血性脑卒中组和正常对照组一般资料比较[n(%)/ ]Tab.1 Comparison of general data between ischemic stroke group and normal control group[n(%)/ ]
*P<0.05。
2.2 基因型与等位基因频率分布
统计缺血性脑卒中组和正常对照组的基因型例数,缺血性脑卒中组和正常对照组等位基因分布符合Hardy-Weinberg 平衡(P> 0.05),基因型在各组间具有群体代表性,见表2。
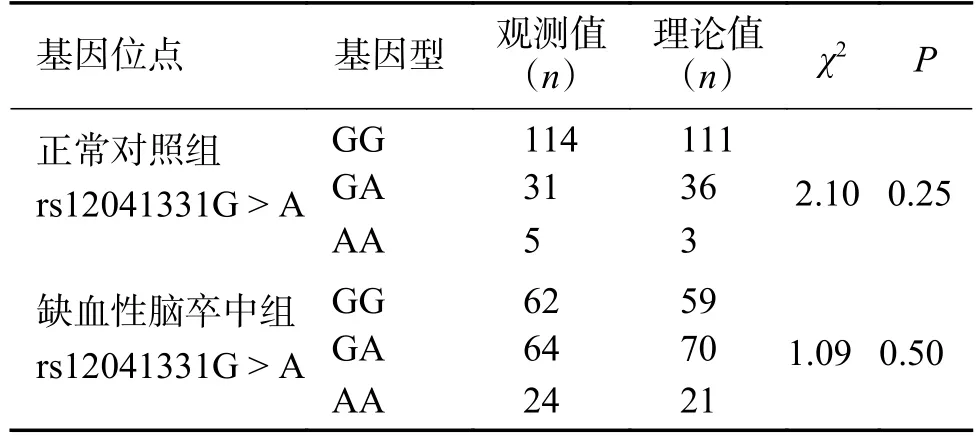
表2 缺血性脑卒中组和正常对照组的Hardy-Weinberg遗传平衡检验(n)Tab.2 Hardy-weinberg genetic balance test in ischemic stroke group and normal control group(n)
2.3 PEAR1 基因rs12041331 位点多态性分析
缺血性脑卒中组和正常对照组PEAR1基因rs12041331G > A 位点基因型分布以及G、A 等位基因频率,见表3。经卡方检验显示,缺血性脑卒中组和正常对照组PEAR1基因rs12041331G >A 位点GG、GA、AA 基因型分布以及 G、A 等位基因频率的差异有统计学意义(P<0.05)。

表3 缺血性脑卒中组和正常对照组PEAR1 基因rs12041331G >A 位点基因型分布和等位基因频率的比较[n(%)]Tab.3 Comparison of genotype distribution and allele frequency of PEAR1 gene rs12041331G>A between ischemic stroke group and normal control group[n(%)]
2.4 缺血性脑卒中发生影响因素的Logistic 回归分析
将缺血性脑卒中组和正常对照组组间差异有统计学意义的糖尿病、高血压、HCY、rs12041331位点GG、GA 和AA 基因型作为自变量,是否发生缺血性脑卒中(发生=1,不发生=0)作为因变量,进行Logistic 回归分析,结果显示:糖尿病、高血压、HCY、rs12041331 位点GA、AA 基因型与缺血性脑卒中相关(P<0.05),均是危险因素,见表4。
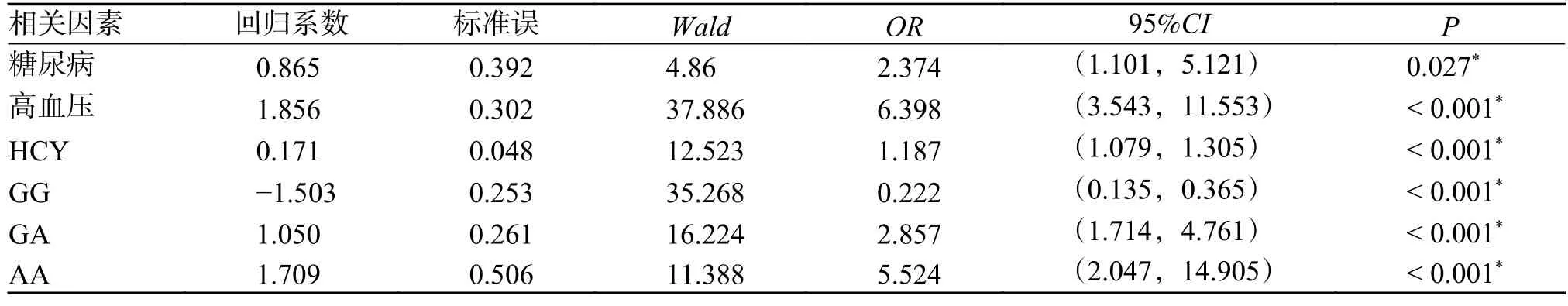
表4 缺血性脑卒中发生影响因素的Logistic 回归分析Tab.4 Logistic regression analysis of influencing factors of ischemic stroke
3 讨论
我国脑卒中患者随着人口老龄化的到来逐日增多,其中以缺血性脑卒中最为常见,每年新增人数达200 万人,其中150 万患者因脑卒中死亡,而存活患者也不同程度丧失行动能力[8]。由此给家庭带来巨大的精神和经济压力,给社会带来沉重负担。因此,脑卒中的早期预防和患病后及时治疗尤为重要,是我国亟待解决的医学问题。目前的防治主要从危险因素进行干预以及进行抗血栓治疗,明确缺血性脑卒中发生发展过程中的可能机制,并进行有效的干预,是防治缺血性脑卒中的重要措施之一。
本研究用PCR-RFLP 方法对研究对象PEAR1基因rs12041331G > A 等位基因多态性进行检测和分析。结果显示,缺血性脑卒中组的糖尿病、高血压比例较正常对照组高,HCY 水平2 组均升高(HCY 实验室正常参考范围0~10 µmol/L),缺血性脑卒中组的HCY 水平高于正常对照组(P<0.05)。缺血性脑卒中发生的病因不明确,饮食习惯、吸烟、患有糖尿病、高血压等疾病以及血清高HCY 水平是目前公认的缺血性脑卒中发生的危险因素[9-10],本研究PEAR1基因rs12041331G >A 位点GG、GA、AA 基因型分布以及G、A 等位基因频率在缺血性脑卒中组和正常对照组间差异有统计学意义(P<0.05),缺血性脑卒中组的突变基因型和A 等位基因频率比正常对照组高。Logistic 回归分析结果显示糖尿病、高血压、HCY、PEAR1基因rs12041331 位点GA、AA 基因型与缺血性脑卒中相关,A 等位基因突变是缺血性脑卒中发生的危险因素(P<0.05)。PEAR1基因rs12041331 属于内含子,不参与编码氨基酸序列,但内含子附近区域变异可影响相关蛋白的表达,从而改变蛋白的功能,相关蛋白可触发多种激动剂,使血小板发生聚集,PEAR1基因多态性与脑卒中的发生相关,与脑梗死认知功能障碍密切相关,影响脑卒中患者的预后[11]。PEAR1可通过介导PI3K/AKT 和PI3K/PTEN 信号通路影响血管内皮细胞增生、新生血管生成和血栓形成,A 等位基因突变可能通过改变激动蛋白的表达影响PEAR1介导的PI3K/AKT 信号通路,进而调节血小板的活化和聚集功能[12]。A 等位基因也可能通过影响内皮细胞的迁移而影响血栓的形成[13]。PEAR1基因rs12041331 位点SNP 与患者血小板活性增强有关,引起血小板之间发生聚集,突变型AA 纯合子血小板聚集率高于野生型GG 纯合子,且突变位点数越多,相应的血小板聚集率就越高;脑卒中病人使用抗血小板聚集药物治疗后的一段时间,杂合突变型GA 心血管事件发生率增高[14]。首次发生缺血性脑卒中后,长期服用阿司匹林的患者中,PEAR1基因纯合突变的患者相较于另外2 种基因型患者发生脑卒中复发的风险更高,影响患者预后,带来的危害更为严重[15]。PEAR1通过不同的路径引发血小板改变、血栓形成,进而导致缺血性脑卒中发生。
本研究就PEAR1基因与缺血性脑卒中进一步研究提供了依据。PEAR1基因多态性与缺血性脑卒中的发生相关,缺血性脑卒中具有遗传易感性,为缺血性脑卒中易感人群的筛选、患病风险评估、早期防治干预等提供科学依据,为疾病的综合防治提供思路。

