清热利湿除痹方治疗急性痛风性关节炎患者的疗效及对炎症因子的影响*
庞利君 黄传兵 李 明 束龙武 李云飞 汤忠富 朱雅文
(1.安徽中医药大学,安徽 合肥 230031;2.安徽中医药大学第一附属医院,安徽 合肥 230601)
急性痛风性关节炎(AGA)是由嘌呤代谢紊乱、尿酸排泄障碍导致尿酸增加,引起单钠尿酸盐晶体(MSU)沉积在关节腔组织中,诱发反复发作的急性炎症反应[1]。痛风全球患病率为1%~4%,我国的患病率为0.03%~10.47%,随着社会经济的快速发展和饮食生活方式的改变,我国痛风的发病率呈年轻化,并显著上升[2]。目前现代医学多采用抑制尿酸生成和炎症发生的药物治疗,如别嘌醇、秋水仙碱、激素类和非甾体消炎药(NSAIDs)等[3]。但是别嘌醇需在痛风性关节炎急性发作后两周左右使用,并不能控制疾病的急性炎症症状,NSAIDs 可有效缓解关节红肿热痛症状,但并不能阻止病情的进展,而服用秋水仙碱、激素类药物受肾功能不全和心血管等诸多合并症的限制,长期服用上述药物可能会出现贫血、消化不良、皮疹等不良反应[4-5]。中医药治疗AGA 有其特色和优势,从中药中分离出的部分化学成分具有多靶点、作用持久、副作用少等特点,另外中医药治疗AGA 有效性和安全性已得到循证医学的验证[6-7]。清热利湿除痹方是黄传兵教授基于临床浊瘀痹病机认识,取《玉案》之加味八正散化裁为基本方,根据多年临证经验随证加减而成,具有清热利湿、化瘀利浊、消肿止痛之功,常应用于湿热痹阻所致之急性痛风性关节炎。课题组在临床实践中发现清热利湿除痹方充分发挥对AGA 的控制、复发率低、减轻西药的毒副作用,且患者满意度较高[8-9]。为进一步明确清热利湿除痹方的临床疗效,同时了解其对患者血清炎症因子表达的影响,本研究进行全方位综合分析,探讨其作用机制,以期为中医药干预AGA炎症因子提供新思路。
1 资料与方法
1.1 病例选择 西医诊断标准参照2015 年美国风湿病协会(ACR)、欧洲抗风湿病联盟(EULAR)颁布的AGA 标准[10]。中医诊断标准参照《实用中医风湿病学》[11]中痛风风湿热痹证辨证标准。纳入标准:符合上述中西医诊断标准;年龄18~60岁;发病时未用其他中药、激素、生物制剂治疗;患者依从性较好,知情同意并签署同意书。排除标准:具有严重基础疾病,如合并心、肝、肺、肾和血液系统疾病者;既往疾病史具有其他风湿病病史者,如系统性红斑狼疮、银屑病关节炎、炎风湿关节炎、骨关节炎等;精神障碍者;妊娠、哺乳期或备孕期者;易过敏体质或对本研究中包含的治疗药物过敏者。
1.2 临床资料 选取2021 年10 月至2022 年10 月在安徽中医药大学第一附属医院门诊和住院部就诊的70例AGA 风湿热痹证患者,以随机数字表法分为观察组与对照组各35 例。治疗组男性30 例(85.71%),女性5 例(14.29%);平均年龄(43.40±9.41)岁;急性发作平均病程(40.48±10.46)h;首次发病6 例,复发29 例。对照组脱落1例(自行退出),最终统计有效病例34例,男性31 例(91.18%),女性3 例(8.82%);平均年龄(49.03±8.74)岁;急性发作平均病程(41.18±10.89)h;首次发病3 例,复发31 例。两组临床资料比较差异无统计学意义(P>0.05)。本研究经安徽中医药大学第一附属医院伦理委员会审批(2022AH-07),所有患者自愿签署知情同意书。
1.3 治疗方法 对两组患者进行非药物指导治疗,包括饮食(禁食含嘌呤较高的食物,合理膳食)和生活方式(健康作息、适当锻炼、戒烟戒酒、充足饮水)的健康宣教。对照组予非布司他(杭州朱养心药业有限公司,国药准字H20130009),口服,40 mg/d;塞来昔布胶囊(青岛百洋制药有限公司,国药准字H20203325),口服,0.2 g/d。观察组在对照组治疗基础上加用清热利湿除痹方(大黄、黄柏各6 g,六月雪、玉米须、车前草、白茅根、丹参各10 g,垂盆草12 g,金钱草15 g),每日1 剂,水煎取汁,早晚各200 mL。上述药物均为餐后30 min口服,中药西药间隔30 min服用,7 d为1个疗程。
1.4 观察指标 中医证候积分参照《实用中医风湿病学》[11]进行评估;采用11 点疼痛程度数字等级量表(PINRS)[12]、视觉模拟评分(VAS 评分)[13]对患者疼痛程度进行评估记录。采用全自动生化分析仪检测两组治疗前后血尿酸(BUA)、24 h尿酸排出量(24 h UUA)、C 反应蛋白(CRP)、血沉(ESR)含量;酶联免疫吸附法(ELISA 法)检测治疗前后血清肿瘤坏死因子-α(TNFα)、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、转化生长因子-β(TGF-β)、白细胞介素-4(IL-4)水平。统计两组治疗前后的不良反应。
1.5 疗效标准 分为临床控制、显效、有效、无效[11]。总有效率(%)=(临床控制+显效+有效)÷总例数×100%。
1.6 统计学处理 将数据纳入SPSS22.0 统计软件中进行分析。符合正态性描述的计量资料以(±s)表示,组内检验若治疗前后差值符合正态分布则采用配对样本t检验,组间检验若符合正态分布和方差齐则使用两独立样本t检验,若不符合上述条件则采用秩和检验,计数资料以“n、%”表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床疗效比较 见表1。因治疗时间较短,两组均未达到临床控制效果。观察组总有效率高于对照组(Z=-2.438,P<0.05)。
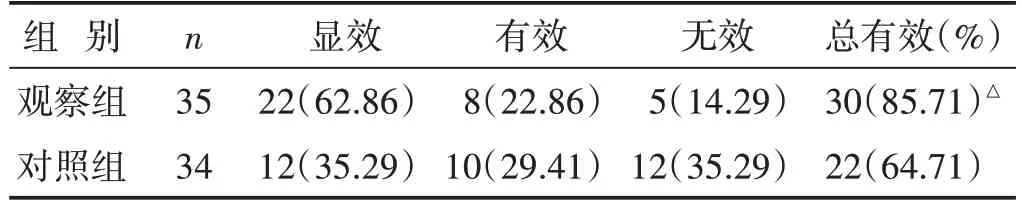
表1 两组临床疗效比较[n(%)]
2.2 两组治疗前后中医证候积分、VAS、PINRS评分比较 见表2。两组治疗后风湿热痹证候总积分、VAS、PINRS 评分降低(P<0.01),与对照组比较,观察组治疗后改善明显优于对照组(P<0.01)。
表2 两组治疗前后VAS、PINRS评分及中医证候积分比较(分,±s)

表2 两组治疗前后VAS、PINRS评分及中医证候积分比较(分,±s)
注:与本组治疗前比较,*P <0.05,**P <0.01;与对照组治疗后比较,△P <0.05,△△P <0.01。下同。
组 别观察组(n=35)对照组(n=34)时间治疗前治疗后治疗前治疗后VAS 6.78±1.34 1.78±0.45**△△6.81±1.42 3.20±0.63**PINRS 6.78±1.51 1.87±0.65**△△6.82±1.63 3.02±1.01**中医证候总积分20.94±4.30 9.46±2.98**△△21.56±4.05 12.85±3.26**
2.3 两组治疗前后血清炎症因子水平比较 见表3。两组治疗后TNF-α、IL-1、IL-6 指标下降(P<0.01),TGF-β、IL-4 水平升高(P<0.01),与对照组比较,观察组治疗后TNF-α、IL-1、IL-6 指标明显降低(P<0.01),TGF-β、IL-4水平明显升高(P<0.01)。
表3 两组治疗前后血清炎症因子水平比较(ng/L,±s)

表3 两组治疗前后血清炎症因子水平比较(ng/L,±s)
组别观察组(n=35)对照组(n=34)时间治疗前治疗后治疗前治疗后TNF-α 60.57±9.45 30.61±6.13**△△61.14±11.27 39.17±8.12**IL-1 106.62±19.57 36.82±11.61**△△105.66±17.56 49.23±13.42**IL-6 36.27±6.83 13.95±5.30**△△33.52±7.73 18.89±5.62**TGF-β 26.58±5.59 34.16±3.49**△△26.94±4.97 31.45±3.08**IL-4 33.28±5.49 59.27±6.50**△△32.82±4.97 45.18±3.56**
2.4 两组治疗前后BUA、24 h UUA、CRP、ESR 水平比较 见表4。两组治疗后BUA、CRP、ESR 指标下降(P<0.01),24 h UUA 水平升高(P<0.01),与对照组比较,观察组治疗后BUA 指标降低(P<0.05),CRP、ESR指标明显降低(P<0.01),24 h UUA 水平明显升高(P<0.01)。
表4 两组治疗前后BUA、24 h UUA、CRP、ESR水平比较(±s)
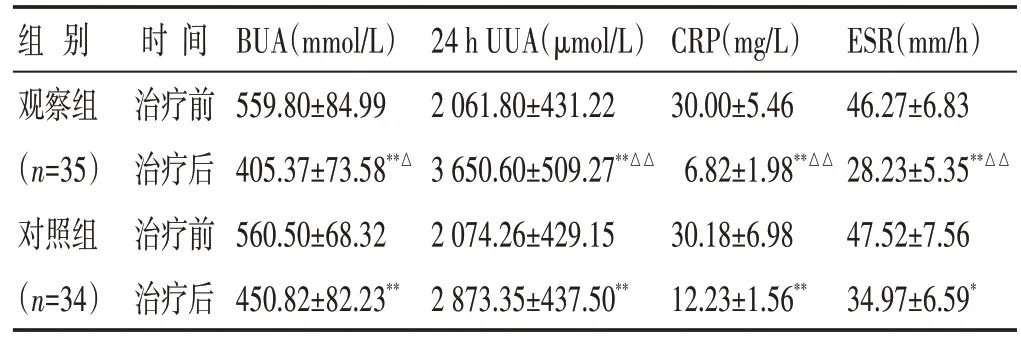
表4 两组治疗前后BUA、24 h UUA、CRP、ESR水平比较(±s)
组别观察组(n=35)对照组(n=34)时间治疗前治疗后治疗前治疗后BUA(mmol/L)559.80±84.99 405.37±73.58**△560.50±68.32 450.82±82.23**24 h UUA(μmol/L)2 061.80±431.22 3 650.60±509.27**△△2 074.26±429.15 2 873.35±437.50**CRP(mg/L)30.00±5.46 6.82±1.98**△△30.18±6.98 12.23±1.56**ESR(mm/h)46.27±6.83 28.23±5.35**△△47.52±7.56 34.97±6.59*
2.5 两组复发率比较 见表5。治疗后,进一步随访两组(临床控制+显效+有效)患者1 个月、2 个月、3 个月内痛风再发情况,治疗组各时间段复发率均低于对照组,治疗后3 个月复发率的差异有统计学意义(P<0.05)。

表5 两组复发率比较[n(%)]
2.6 两组不良反应比较 本次临床试验期间未发生任何严重不良事件,安全性指标未见异常,未有头晕、恶心呕吐、胃痛、腹痛腹泻、心慌胸闷、皮疹等严重不良反应。
3 讨 论
AGA 属中医“痛风、痹证、骨痹、白虎历节、血浊、浊瘀痹”之列。王焘在《外台秘要·白虎方》指出“白虎病者,大都是风寒暑湿之毒……经脉结滞,血气不行,蓄于骨节之间”,阐述了外邪侵袭痹阻筋脉骨节可成白虎病。《温病条辨》认为“湿聚热蒸,蕴于经络,寒战热炽,骨骱烦疼”,提出湿热毒邪是形成骨痹的重要原因。元代朱丹溪首次提出痛风病名,并在《格致余论》中说道“彼痛风者,大率因血受热已自沸腾,其后或涉冷水,或立湿地,或扇取凉,或卧当风。寒凉外抟,热血得寒,痰浊凝涩,所以作痛”。以上均说明AGA 最主要病机为“湿热内蕴”。本病发生多因恣食膏粱、醇酒炙煿、肥甘厚味之品,中焦脾胃运化受损,脏腑功能失调,浊痰湿腐聚于体内、留滞经络成瘀,尿酸浊毒排泄障碍,滋生伏毒,毒热化郁,浸淫筋脉关节,又因外邪入里,里湿为合后诱发急性发作。目前普遍认为,AGA 风湿热痹证相当于西医活动期痛风性关节炎,姜平[14]回顾性统计330 例痛风患者的临床数据,得出结论中医辨证中湿热蕴结证是痛风最常见的证候,主要出现在痛风发作的急性期。
清热利湿除痹方由大黄、黄柏、车前草、金钱草、白茅根、垂盆草、六月雪、玉米须8味药组成。《本草新编》中记载大黄“推陈致新、导瘀血、止疼痛、消肿胀,俱各如神”。黄柏药性苦寒。二者均可治疗风湿热痹、关节肿痛,既能清热解毒利湿,又能祛瘀消肿止痛,故为君药。臣药车前草、金钱草、白茅根、垂盆草、六月雪均善利水渗湿,与加味八正散之效有异曲同工之妙,可使三焦湿热之邪从小便而出,助君药大黄、黄柏清热解毒,利湿化浊。另外方中玉米须善于利水而消肿,减轻炎症反应,可降低尿蛋白保护肾脏,配伍臣药等增强清热利湿通络之效,味甘性平不易伤正,是治疗痛风的良药。运用中医传承辅助平台分析数据挖掘显示[15],清热利湿除痹方所用中药均在治疗AGA 使用频次中位于前列。
本次研究表明清热利湿除痹方可以调控炎症信号通路,进一步干预减少IL-1、IL-6、TNF-α 炎性因子水平以及CRP、ESR 活动期指标,增加TGF-β、IL-4 抗炎因子水平,平衡促炎和抑炎因子状态,限制炎症引起的过度组织破坏,改善机体炎症微环境中更优,可避免因炎症因子增加引起巨噬细胞、中性粒细胞的聚集和激活。其中TNF-α[16]不单单是痛风急性发作促进骨侵蚀的重要炎性因子之一,也是诱导其他炎症细胞释放的物质,可通过直接促进或NF-κB 途径、Caspase-1 途径促进下游炎症因子的分泌。IL-1 家族的细胞因子和受体广泛影响着疾病免疫和炎症反应,促进骨细胞活力的丧失抑制破骨细胞生成作用[17]。IL-1 和TNFα 可刺激软骨细胞产生一氧化氮、聚集酶、基质金属蛋白酶等软骨降解产物并抑制聚集糖和胶原蛋白的合成,最终导致关节损伤[18]。另外IL-1β 的释放可趋化作为下游的IL-6 迁移与局部聚集,通过血流移动到肝脏,随后快速诱导合成大量CRP、血清淀粉样蛋白A,纤维蛋白原,结合珠蛋白等急性期蛋白,最后诱发炎症反应,使得关节滑膜通透性增加[19]。TGF-β 是细胞分化、迁移、增殖和基因表达的主要调节因子之一,可促使T 细胞转化为免疫抑制Treg 细胞,发挥免疫抑制特性以及从多个水平上拮抗炎性因子进行机体免疫调节,减轻关节局部炎性反应[18,20]。IL-4 具有重要的免疫调节活性,拮抗Th1驱动的促炎性免疫反应,参与下调促炎细胞因子、抑制促炎趋化因子和炎症的其他介质,也是巨噬细胞极化导向抗炎谱的关键参与者,另一方面也可上调参与炎症抑制的IL-1 受体拮抗剂和IL-1Ⅱ型受体[21]。因此,专注于降尿酸治疗及抑制炎症因子表达可能是预防AGA发作的成功策略。
另外本次研究结果表明,观察组中医证候积分、VAS、PINRS 评分改善均优于对照组,说明清热利湿除痹方在改善患者急性期红、肿、热、痛的临床症状方面更具有优势,避免导致不可逆转的关节损伤;观察组BUA 指标明显降低,24 h UUA 水平明显升高,说明观察组尿酸的排出量更多,在改善血管内皮损害、减少间质炎症浸润、保护肾脏、减轻关节软骨破坏方面更优。观察组治疗总有效率明显高于对照组,说明其治疗AGA 的疗效较优。观察组在3个月内的复发率和不良反应发生率均明显低于对照组,表明清热利湿除痹方在增效减毒、延缓骨关节侵蚀进程、防止复发和提高日常活动功能等方面的作用更为持久。
综上,炎症细胞因子分泌失衡与AGA 的急性发生直接相关,因此以炎症因子作为研究方向无疑是治疗AGA 的可靠方法。清热利湿除痹方可调控炎症因子,有效减轻风湿热痹型AGA 急性发作的主要临床症状,且安全性优、复发率较低。

