香蕉园草铵膦降解菌的分离鉴定及其生长特性研究
林金钩 林蓉
摘要:采集受草铵膦污染的香蕉园土壤,通过富集培养技术获得以草铵膦为唯一碳源生长的微生物C6菌株。结果表明,C6菌株对草铵膦降解率高达69.01%;通过观察C6菌株的形态学特征结合16S rRNA序列分析,初步鉴定C6菌株为戴尔福特菌属(Delftiasp.);进一步探讨培养基体积、氮源、草铵膦初始浓度、培养基初始pH 值、培养温度、菌悬液接种量、Na+浓度和Mg2+浓度等因素对C6菌株生长的影响。结果显示,C6菌株最适宜的培养条件是培养基体积为 75 mL、氮源为硫酸铵、草铵膦初始浓度 200 mg·L-1、初始 pH 值8.5、培养温度 25℃、接种量 15%、 Na+浓度20 g·L -1、Mg2+浓度100 mg·L-1。本研究结果为利用微生物对草铵膦污染土壤进行原位生物修复提供理论依据。
关键词:草铵膦;降解菌;戴尔福特菌菌株;生长特性
中图分类号:S482.4 文献标识码:A 文章编号:2095-5774(2023)01-0030-07
Isolation,Identification and Growth Characteristics of a Glufosinate
Ammonium-degrading Bacterial Strain
Lin Jingou,Lin Rong
(Xiamen Environmental Monitoring Central Station,Xiamen,Fujian 361000,China)
Abstract: The microbial strain C6 growing with glyphosate as the only carbon source was obtained from soil of banana orchard contaminated by glyphosate through enrichment culture technology. The results showed that the degradation rate of glyphosate by strain C6 reached 69.01%. Combined with the morphological characteristics of strain C6 and 16SrRNA sequence analysis,strain C6 was preliminarily identified as Delftia sp. The effects of medium volume,nitrogen source,initial concentration of glyphosate,initial pH value of medium,culture temperature,inoculation amount of bacterial suspension,sodium and magnesium ion concentration on the growth of strain C6 were further discussed. The results showed that the optimum growth conditions were 75 mL medium,ammonium nitrate as nitrogen source,200 mg·L-1 as initial concentration of glyphosate,medium at pH 8.5,temperature at 25 ℃,15% bacterial suspension for inoculation,20 g·L -1 sodium ion,and 100 mg·L -1 magnesium ion. The results provide a theoretical basis for the in situ bioremediation of the soil contaminated by glyphosate using microorganism.
Key words: Glyphosate;Degrading bacteria;Delftia sp. Strain;Growth characteristics
草銨膦(Glufosinate ammonium)又称草丁膦,化学名为4-[羟基(甲基)膦酰基]-DL-高丙氨酸,化学式为C5H15N2O4P,是一种广谱型除草剂,具低毒、活性高和环境相容性好等特点[1]。草铵膦通过与植物体中的ATP相结合并占据谷氨酰胺合成酶(glutamine aynthetase,GS)的反应位点,在植物氮代谢过程中阻碍谷氨酸与铵离子合成谷氨酰胺的途径并随之破坏其后的代谢过程[2]。主要剂型为溶液剂(水剂),由于其杀草谱广、发挥活性作用速度较快,广泛应用于果园、马铃薯以及非耕地等田间杂草的治理。
目前因一系列高毒性除草剂(百草枯、草甘膦等)的禁用,以及农用除草剂的市场高需求,草铵膦作为低毒、高活性的广谱除草剂,其生产量和使用量均居世界前列[3]。随着使用量的增加,且具有较强的水溶性,容易污染水源并进一步在食物链中富集,对环境和人体健康产生潜在威胁[4],有效降低这些威胁成为目前迫切需要解决的问题。微生物降解是农药残留被降解转换的主要途径之一[5],具有适用范围广泛、代谢方式多样且相较于物理、化学降解更安全、绿色和有效,因此研究和应用的前景十分广阔。现阶段国内外关于草铵膦的研究主要集中在作用机理[2]以及在不同环境中的行为[1,6,7]、毒性[8,9]等方面,而对草铵膦的降解菌株及相关降解菌株的生长特性方面的研究尚少。本研究旨在从受草铵膦污染的香蕉果园土壤中分离、筛选可降解草铵膦的微生物菌株,并对草铵膦降解菌株的生长特性进行研究,以期为草铵膦微生物降解的深入研究和草铵膦降解菌的产业化利用提供理论依据。
1材料与方法
1.1试验材料
1.1.1供试土壤
福建省漳州市长泰县常年施用草铵膦的香蕉园,拔除土壤表层杂草和其它杂物后取0~15 cm土样,迅速取回,置于4℃冰箱保存。
1.1.2培养基
以草铵膦为唯一碳源的基础盐培养基,每1 L蒸馏水中组分构成为MgSO4·7H2O 0.5 g、K2HPO4·3H2O 1.31 g、FeSO4·7H2O 0.018 g、NaNO3 3.0 g 。外加草铵膦用于培养和分离草铵膦降解菌株。LB培养基为10.0 g蛋白胨、5.0 g酵母粉、NaCl 5.0 g。牛肉膏蛋白胨琼脂培养基为牛肉膏3.0 g、蛋白胨5.0 g、琼脂18.0 g、蒸馏水1 L,pH值 7.0~7.2。
1.1.3草铵膦
草铵膦标准品(阿拉丁/G114499-100 mg),购自阿拉丁官网。
1.1.4主要仪器
电子天平(奥豪斯/AR224CN)、超净工作台(苏州安泰/SW-CJ-2FD)、台式高速离心机(上海安亭/TGL-16C)、立式高压蒸汽灭菌器(上海申安/LDZM-80L)、基础型超纯水系统(上海泽拉布/Dura 12FV)、振荡培养箱(上海知楚/ZQZY-75CN)、生化培养箱(宁波赛福/SPX-250)、pH计(上海仪电/PHS-3C)、超高效液相色谱-四级杆飞行时间质谱仪(安捷伦/1290-6545)、光学显微镜(Ci-L,日本)。
1.2 草铵膦降解菌株的富集和分离纯化
降解菌株的分离纯化在参考吴红萍等[10]方法的基础上进行适当改良。取10 g土壤加入含有100 mL基础盐培养基的250 mL锥形瓶中,外加草铵膦50 mg·mL-1,在生化培养箱中以30℃恒温、150 r·min-1的培养条件培养3 d。取10 mL上层悬浮液加入到100 mL基础盐培养基中,相同条件继续培养,重复上述培养操作至草铵膦浓度为300 mg·mL-1,在相同的培养条件下培养3个周期。待培养周期结束后,梯度稀释样液,并吸取100μg稀释液涂布于改良高氏一号培养基、马铃薯葡萄糖琼脂培养基和牛肉膏蛋白胨固体培养基平板上,分别在30℃和37℃生化培养箱中恒温培养1~7 d。待菌落长出后,进行观察,用接种环在分离较好且菌落形态不同的单一菌落上沾取少量菌体放入液体培养基进行培养,培养结束后进行平板划线,恒温培养结束后放入冰箱保存备用。
1.3高效降解菌株的筛选
菌株接种到液体培养基中制备悬浮菌液,于振荡培养箱中培养3 d后,以10%接菌量接种到100 mL含300 mg·L-1草铵膦基础盐培养基中,再于振荡培养箱中培养1个周期。培养结束后,吸取2 mL于2.5 mL具塞离心管中,置于台式高速离心机中,以10 000 r·min-1离心10 min,通过0.22μm超滤膜过滤上清液1~1.5 mL到样品管中,用超高效液相色谱-四级杆飞行时间质谱仪测定,另设置未添加微生物降解菌株的草铵膦标准品溶液作为对照组,计算菌株的降解率(%)=(C0- Ct)/C0×100%,式中C0为草铵膦初始浓度,Ct为不同菌株降解作用下草铵膦的浓度。
1.4草铵膦降解菌株的形态与分子鉴定
采用平板涂布法将筛选后的草铵膦降解菌株,在生化培养箱中 30 ℃培养 12~48 h。参照《常见细菌鉴定手册》等[11,12]对降解菌株的形态学特征进行观察。
进一步采用通用引物27F(5-AGAGTTTGATCCTGGCTCAG-3)和 1492R(5-GGTTACCTTGTTACGACCCTT-3)[13]扩增菌株序列,并送至北京擎科新业生物技术有限公司进行测序。将所得基因序列在 NBCI 数据库进行 BLAST 同源性比对分析,选取同源性较高的菌株序列,采用 MEGA7.0 软件的邻接法 (Neighbor-Joining method)构建菌株系统发育树。
1.5草铵膦降解菌株的生长因素优化
草铵膦降解菌株生长因子优化采用Liu等[14]方法。将降解菌株接种在 50 mL的LB 液体培养基(pH 值7.0)中,在30℃、150 r·min-1的振荡培养箱中振荡培养 18~24 h(OD600=0.30),再按 5%(V/V)的量接种于基础盐培养基中,初始 pH值为 7.0,初始草铵膦浓度为 50 mg·L-1、温度为 30 ℃、150 r·min-1振荡培养箱恒温培养,分别进行以下几组处理测定生长量的变化,每种因素设 3 个重复试验,以接种灭活的菌株为对照组,24 h 后取样测定菌株生长量变化。
设培養基体积分别为 25、50、75、100、150、200 mL;设氮源分别为 硝酸铵、氯化铵、硫酸铵、硝酸钠;设草铵膦初始浓度分别为10、50、100、200、300、400、500 mg·L-1;用 NaOH 或 HCl 调节初始 pH 值分别至 4.0、5.0、6.0、7.0、7.5、 8.0、8.5、9.0、10.0;设培养温度分别为 20、25、30、35、40、45℃;设接种量分别为 5%、10%、15%、20%、25%;将菌悬液按 5%接种量接入含有草铵膦降解培养基的锥形瓶中,调节初始 pH值7.0、7.5,在 30℃、150 r·min-1 条件下分别加入5、10、20、30、50、100 g·L-1氯化钠培养 1 d 后测定草铵膦降解率,重复3 次,确定最适 Na+浓度。同样设置 Mg2+浓度分别为50、100、200、300、400 mg·L-1。
2 结果与分析
2.1降解菌株的筛选与分离鉴定
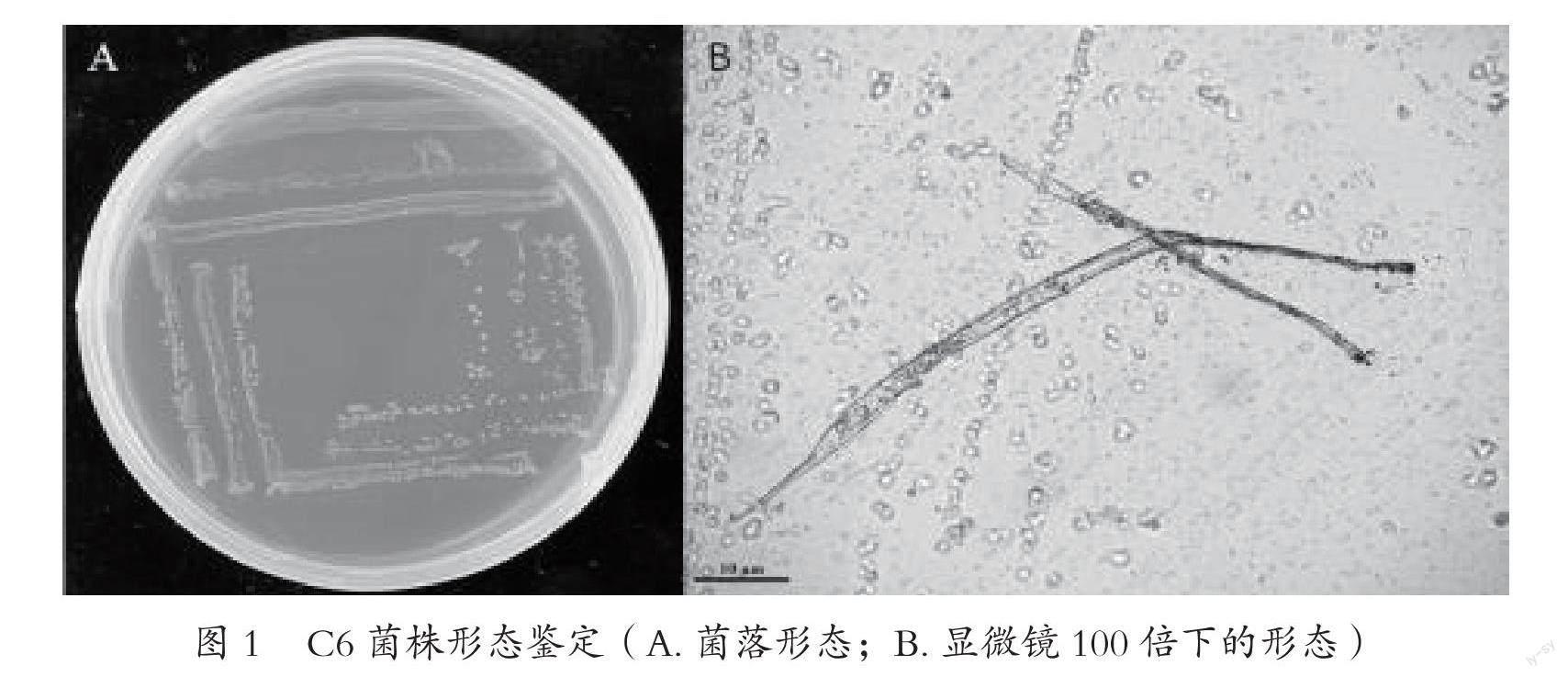
从草铵膦污染的土壤中取样,经过两次稀释涂布和初步的富集培养,分离纯化得到1个草铵膦降解菌株,命名为C6。形态观察结果(图1)显示,C6菌株菌落为光滑圆形,乳白色,直径约为1.0 mm,边缘整齐不透明;在100倍显微镜下观察为透明,长杆状。
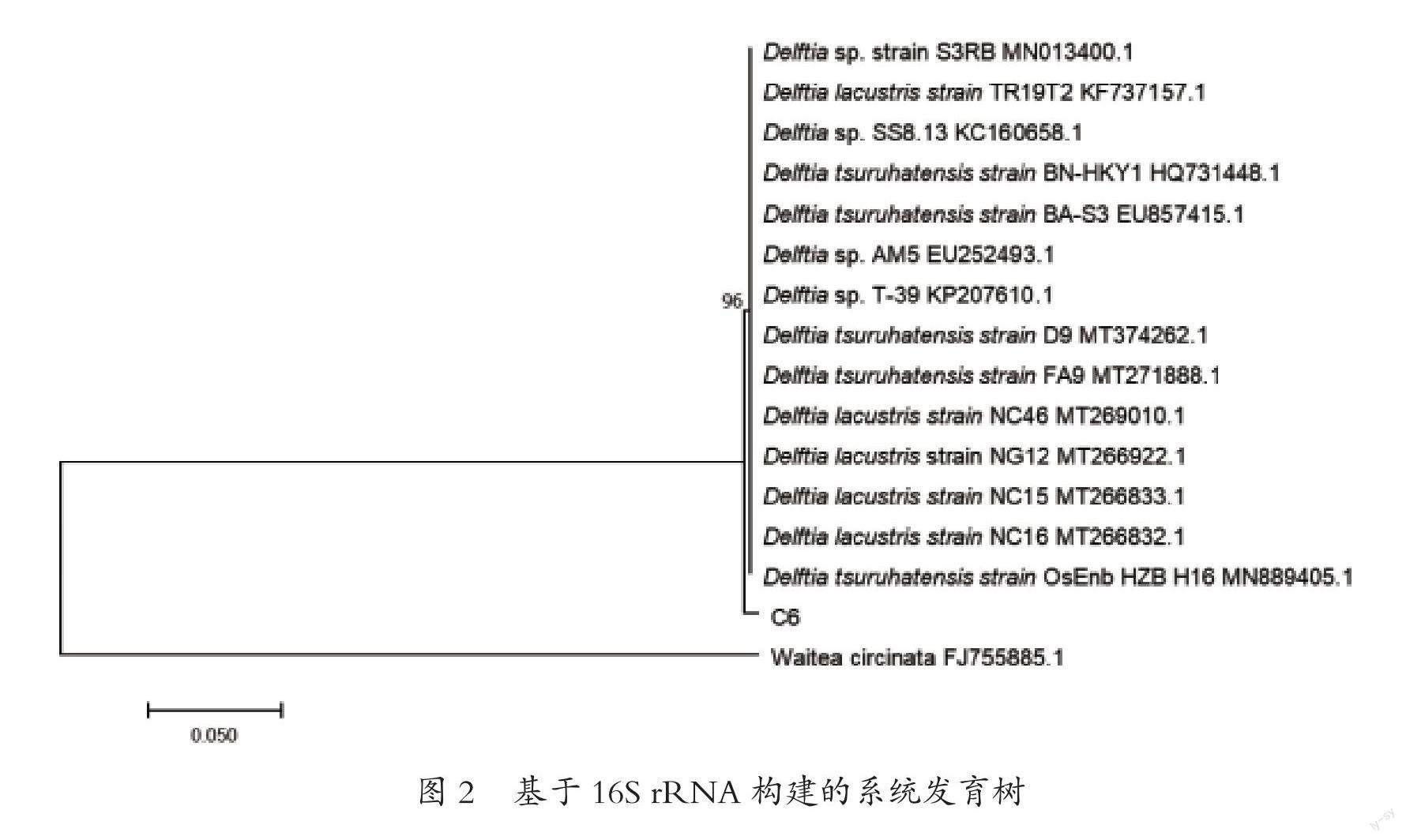
以C6菌株基因组DNA为模板、27F/1492R为引物进行PCR扩增,得到长度约为1.5 kb的扩增产物。测序结果在NCBI数据库进行blast同源比对分析,结果表明C6菌株与Delftiasp.的基因同源性最高,达96%以上。系统发育树分析结果显示,C6与戴尔福特菌属 (Delftiasp.)聚在一起。综合菌落特征与16S rDNA基因序列,初步认定C6菌株为戴尔福特菌属菌株(图2)。
2.2 C6菌株对草铵膦的降解情况
C6菌株在接种量10%、含300 mg·L-1的草铵膦培养基中,30℃、150 r·min-1的条件下振荡3 d,经超高效液相色谱-四级杆飞行时间质谱仪测定,C6菌株对草铵膦的降解率高达69.01%。
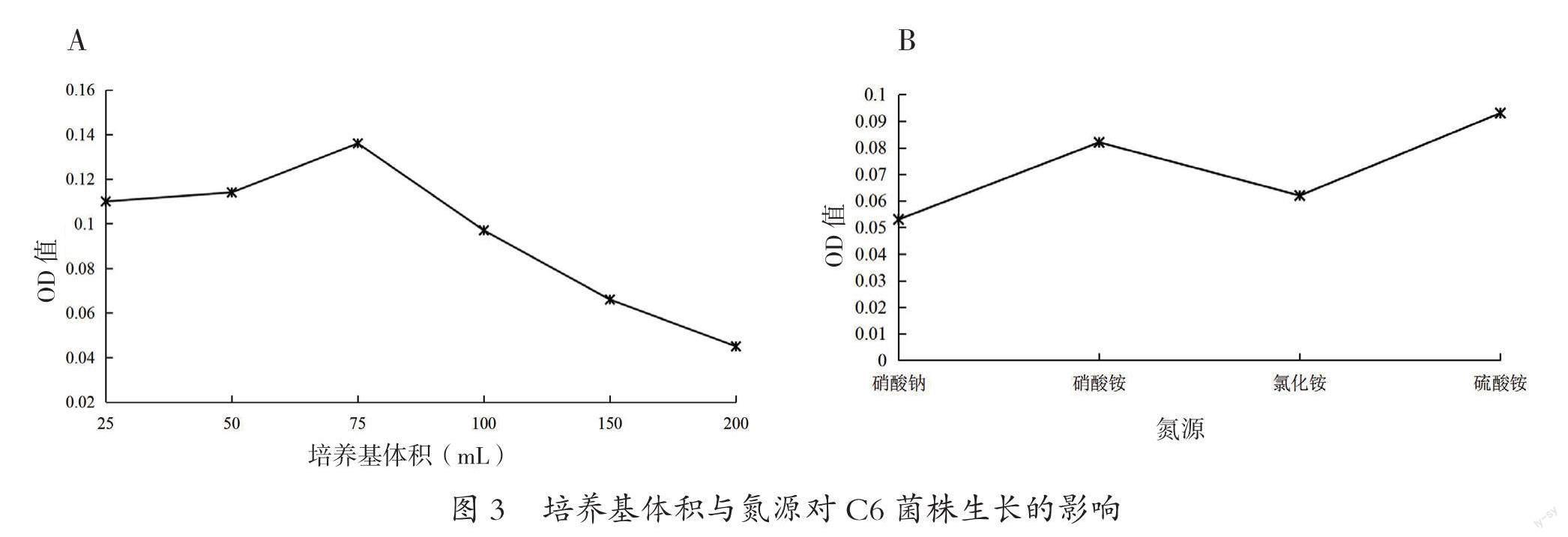
2.3培养基体积与氮源对C6菌株生长的影响
不同培养基体积影响C6菌株的生长,如图3A所示,在25~200 mL的基础盐培养基中,C6菌株均能正常生长;在25~75 mL范围内,C6菌株的生长呈快速上升趋势,且体积为75 mL时,OD值达到最大,为0.136;当体积大于75 mL时,随着基础盐培养基体积的增大,OD值呈下降趋势,至200 mL时降至最低。
不同氮源培养基对C6菌株生长的影响如图3B所示,C6菌株分别在100 mg·L-1的硝酸钠、硝酸铵、氯化铵和硫酸铵为唯一氮源的培养基中均可以生长,但菌株的生长情况因氮源种类的不同而有差异。当氮源是硫酸铵时,C6菌株的生长处于最佳状态,OD值最大;其次是硝酸铵,而在以硝酸钠为氮源的培养基中,生长最差。
2.4草铵膦初始浓度与培养基初始pH值对C6菌株生长的影响
草铵膦初始浓度对C6菌株的影响如图4A所示,培养基中草铵膦浓度在10~200 mg·L-1的范围内,降解菌株C6的生长速度随浓度的增加而提高,在200 mg·L-1时达到最大值;当草铵膦初始浓度大于200 mg·L-1时,C6菌株的生长量随着草铵膦初始浓度的增加而降低。
培养基初始pH值对C6菌株的生长影响如图4B所示,当培养基初始pH值在4.0~8.5间,C6菌株的生长随着pH值的升高而升高;pH值为8.5时最有利于C6菌株的生长;当pH值大于8.5时,C6菌株的生长量快速下降。结果表明,过酸或过碱的培养基不适宜C6菌株的生长。
2.5 培养温度与菌悬液接种量对C6菌株生长的影响
C6菌株在20~45℃的范围内均可生长,但不同温度下生长速度有明显差异(图5A)。培养基温度为20~25℃时,C6菌株的生长随着温度升高而增加,25℃时达到最大值,为 0.155;当温度大于25℃时,C6菌株的生长明显下降,表明C6菌株生长的最适温度为25℃。
在一定范围内,接种量的增加可以加快C6菌株的生长速率,缩短延滞期(图5B)。当接种量超过15%时,C6菌株的生长下降,表明C6菌株的适宜菌株接种量为15%。
2.6 Na+与Mg2+浓度对C6菌株生长的影响
C6菌株在Na+浓度为5~100 g·L-1的培养基中均可以生长,但生长速度有明显不同(图6A)。在50 g·L-1氯化钠培养基中,C6菌株生长最差,在20 g·L-1氯化钠培养基中生长最好。
C6菌株在Mg2+浓度为50~400 mg·L-1的培养基中均可以生长,但稍有差异(图6B)。其中,菌株C6在200 mg·L-1氯化镁培养基中的生长最差,在100 mg·L-1氯化镁培养基中的生长最好。
3讨论
本文从长期喷洒草铵膦的香蕉果园土壤中分离出1株微生物降解菌C6菌株,经過纯化鉴定,确定其属于戴尔福特菌属 。已有研究表明,戴尔福特菌属在生态环境领域的降解优势,如田爽等[15]从长期受农药苯磺隆污染的土壤中筛选鉴定1株降解菌株B2 ,B2 与多株戴尔福特菌属细菌的 16S rDNA 序列同源性达 99%;陈思雨等[16]从白洋淀重金属污染土壤中获得10个戴尔福特菌属菌株,对高浓度Pb2+和Cr(Ⅵ)具有明显抗性;赵晓燕等[17]发现一株辛硫磷降解菌株戴尔福特菌D39,进一步分析机理证明降解活性部位主要是胞内酶。廖家龙等[18]从活性污泥中发现群体感应淬灭高效菌株,其中戴尔福特菌株JL5能够在10 h内完全降解 N-己酰高丝氨酸内酯。
目前尚未见对降解草铵膦菌株的相关报道,本文首次从草铵膦污染土壤中分离出戴尔福特菌,对未来除草剂的生物降解提供了新的微生物资源。同时,试验得出C6菌株培养最适宜条件为:培养基体积为 75 mL、氮源为硫酸铵、草铵膦初始浓度 200 mg·L-1、初始 pH 值8.5、培养温度 25 ℃、菌悬液接种量 15%、Na+浓度 20 g·L-1、Mg2+浓度为 100 mg·L-1。
与此同时,本文所筛选出来的C6菌株是在特定的生长环境(香蕉园)中培养的结果,而根据现代农业的发展,单一品种的农药不再能满足生产的需求,往往在生产中会混合施用不同种类的农药,多种农药的混合施用会导致土壤中农药残留部分的成分逐渐复杂,这也增加了微生物降解工作的挑战性。因此C6菌株在复杂除草剂污染环境中的降解效率等方面需要进一步的研究和探讨。
参考文献:
[1]孟秀柔 ,宋青梅 ,王飞 ,等. 草铵膦和草甘膦在水环境中的行为和毒性效应研究进展[J]. 生态毒理学报,2021,16(3):144-154.
[2]冯明. 浅论草铵膦的作用机理及应用[J]. 中国化工贸易,2018,10(12):107-110.
[3]范立攀 ,史秀肖 ,唐兴敏 ,等. D-草铵膦的除草活性研究[J]. 世界农药,2022,44(3):53-56.
[4]张宏军 ,刘学 ,张佳 ,等. 草铵膦的作用机理及其应用[J]. 农药科学与管理,2004,25(4):23-27.
[5]苏少泉. 草铵膦述评[J]. 农药,2005,44(12):529-532.
[6]牛立志. 除草剂草铵膦在土壤环境中的行为研究[D]. 杭州:浙江大学,2010.
[7]牛立志,桂文君,朱国念.草铵膦在水中的降解特 性及对水生生物的毒性[J]. 浙江农业学报,2010,22(4):485-490.
[8]刘衍忠,刘东霞,高曙光,等.草铵膦的大鼠肝脏毒性[J]. 环境与健康杂志,2006,23(5):416-417.
[9]由宇润 ,王智琴 ,张炫 ,等.草铵膦原药对大鼠致畸试验[J]. 农药,2011,50(10):740-742.
[10]吴红萍,万红艳,王锐萍.戊唑醇农药降解菌的筛选及其降解效能初探[J]. 农药,2013,52(2):102-104.
[11]赵斌,何绍江. 微生物学实验[M]. 北京:科学出版社,2002.
[12]王天廓,温玉娟,杨悦锁,等. 一株草甘膦高效降解菌的筛选和表征研究[J]. 农业环境科学学报,2021,40(3):591-599.
[13]王冰. 草甘膦降解菌的筛选、鉴定及关键物质分析[D]. 吉林:吉林农业大学,2021.
[14]Liu SB,QIAO LP,HE HL. Optimization of fermentation conditions and rheological properties of exopolysaccharide produced by deep-sea bacterium Zunongwangia profunda SM-A87 [J]. PLo S One,2011,6(11): 1-11.
[15]田爽,田方方,王晓萍. 4 株苯磺隆降解菌的分离鉴定及其生长特性[J]. 农业资源与环境学报,2014,31(5):437-445.
[16]陈思雨,王丽娜,杨惠琪,等. 白洋淀抗重金属细菌多样性及其与生态因子相关性[J]. 河北大学学报:自然科学版,2018,38(6): 664-672.
[17]赵晓燕,周方园,吴晓青,等.辛硫磷降解菌 D39 的分离鉴定及评价[J]. 福建农业学报,2020,35(9):997-1003.
[18]廖家龙,郑雪漫,黎双飞,等. 活性污泥中群体感应淬灭菌的分离纯化及功能验证[J]. 微生物学通报,2021,48(10): 3532-3542.
(責任编辑:冯新)

