娇小白掌顶芽组织培养研究
王文平 简丽观 陈海燕 李雪

摘要:【目的】探究娇小白掌的组培快繁体系,为工厂化生产提供技术参考。【方法】以娇小白掌新生顶芽为外植体进行组织培养研究。【结果】娇小白掌适宜的不定芽诱导培养基为MS+2.0 mg/L 6-BA +0.1 mg/L NAA,诱导率100%,诱导丛生芽数量4~5个;适合的继代增殖培养基为MS+1.0 mg/L 6-BA + 0.3 mg/L NAA和MS+0.5 mg/L 6-BA + 0.3 mg/L NAA交替使用,增殖系数达3.5,芽健壮,可直接用于生根培养;最佳生根培养基为MS+1 000 mg/L AC,生根率100%,根数3~4,根长30 mm左右,种植成活率95%以上。 【结论】初步构建了娇小白掌的组培快繁体系,优化了白掌组培技术,能够实现娇小白掌的高效产业化生产。
关键词:娇小白掌;顶芽;组织培养
中图分类号:S682.36 文献标识码:A 文章编号:2095-5774(2023)03-0161-07
Study on Tissue Culture of the Terminal Bud of Spathiphyllum ‘Petite
Wang Wenping,Jian Liguan,Chen Haiyan,Li Xue*
(Sunshine Horticulture company ,Quanzhou,Fujian 362012,China)
Abstract:【Objective】The objective of this study is to explore the tissue culture and rapid propagation system of Spathiphyllum ‘Petite,and to provide references for industrial production. 【Method】 In this paper,the new terminal bud of Spathiphyllum ‘Petite was used as explants for tissue culture. 【Result】 The suitable medium for adventitious bud induction was MS medium+ 2.0 mg/L 6-BA +0.1 mg/L NAA,the induction rate was 100%,and the number of cluster buds was 4~5. The suitable proliferation media were MS medium+1.0 mg/L 6-BA+0.3 mg/L NAA and MS medium+0.5 mg/L 6-BA+0.3 mg/L NAA,which were used alternately in the subculture process,the proliferation coefficient reached 3.5,and the buds were robust which could be directly used for rooting culture. The optimal rooting medium was MS medium+1 000 mg/L AC,the rooting rate was 100%,the number of root was 3-4,the root length was about 30 mm,and the survival rate of rooting seedlings was above 95%. 【Conclusion】 The tissue culture and rapid propagation system of Spathiphyllum ‘Petite was preliminarily established,and its tissue culture technology was optimized. It could realize the efficient industrial production of Spathiphyllum ‘Petite.
Key words:Spathiphyllum ‘Petite;Terminal bud;Tissue culture
園艺花卉随着人们对生活品质要求的提高而逐渐走入大众的视线,白掌因其独特的花叶形态及“一帆风顺”的美好寓意,成为中国花卉市场近30年来依旧热度不减的品种之一[1]。娇小白掌是白掌的一个栽培种(Spathiphyllum‘Petite),其株型小巧,成型植株株高22~30 cm,叶长约17 cm、宽约6 cm;相对于普通大型白掌,该品种更适合摆放在桌台等家具上,不仅美观大方,而且兼具空气净化的效用,能够过滤空气中的有害气体,如苯、三氯乙烯及甲醇等,具有广阔的市场价值[2-4]。针对白掌的组培研究目前有多方报道,如杨舒婷等探究不同外植体建立白掌组培快繁体系,结果表明花序更容易诱导生成完整植株[5];刘静等以白鹤芋‘甜芝‘美酒两个品种蘖芽为外植体,在MS培养基中添加不同种类和浓度的激素,进行组培快繁试验[6];还有大量研究者针对不同激素类型及配比对白掌的组培快繁进行研究[7-10]。但是鲜有娇小白掌组培快繁方面的相关信息。由于不同品种之间存在的性状差异及遗传特性,其组培工艺也存在一定的差异[11-13]。因此,本文旨在通过研究娇小白掌的组织培养,为其工业化快繁生产提供一定的技术支持。
1 材料与方法
1.1材料
测试材料选择长势良好、无病虫害、具有母本性状的盆径12 cm的娇小白掌盆苗,购自广州花卉市场。
1.2方法
1.2.1外植体消毒
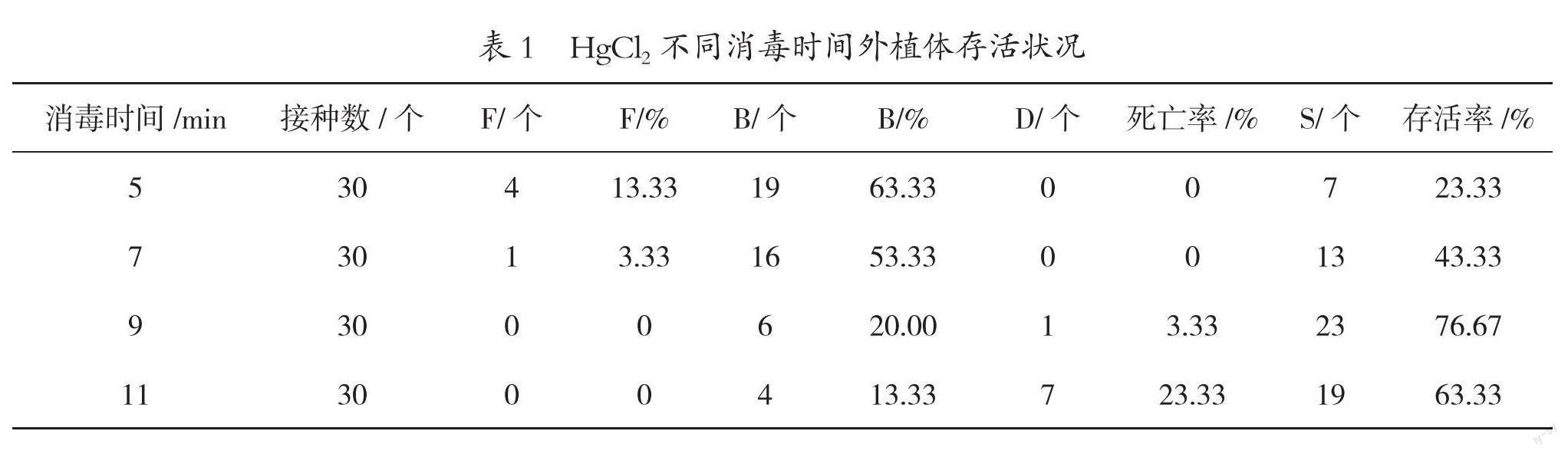
采用的外植体为顶芽,在制种前先将母本至于通风阴凉的环境(温度20~26℃、遮光40%~60%),停止浇水施肥,保持基质自然干燥但母本植株不萎蔫。选取新抽生的嫩芽,用手术刀从根基部切下,剥去外层苞叶至材料直径为5~7 mm,将基部切割平整并切除嫩芽上部多余组织,使材料长15 mm左右。将外植体置于自来水下冲洗30 min后风干,用75%酒精浸泡15~20 s,再用1‰HgCl2消毒,消毒时间设4个梯度(5、7、9、11 min),每个梯度30个外植体,共计120个外植体,消毒后用无菌水清洗3~4次,每次3~5 min,然后接种诱导培养基中,每杯1个外植体。培养21 d后统计外植体的真菌污染数(F)、细菌污染数(B)、死亡个体数(D)及存活个体数(S)并计算相应比率。
1.2.2不定芽诱导
依据消毒试验污染率的结果大量制备原种材料,在获得一定量的无菌材料后,再进行诱导试验。将消毒后的外植体接种于诱导培养基,以MS为基本培养基, 30 g/L蔗糖,5.5 g/L卡拉胶,pH值6.0;设计4个6-BA浓度梯度(0.5 、1.0 、1.5 、2.0 mg/L),3个NAA浓度梯度(0、0.1、0.3 mg/L),并设立空白对照,共计13个处理,每组处理10杯,每杯1个外植体,设立3个重复。培养40 d后调查不定芽的萌发率及丛生芽数。
1.2.3不定芽增殖
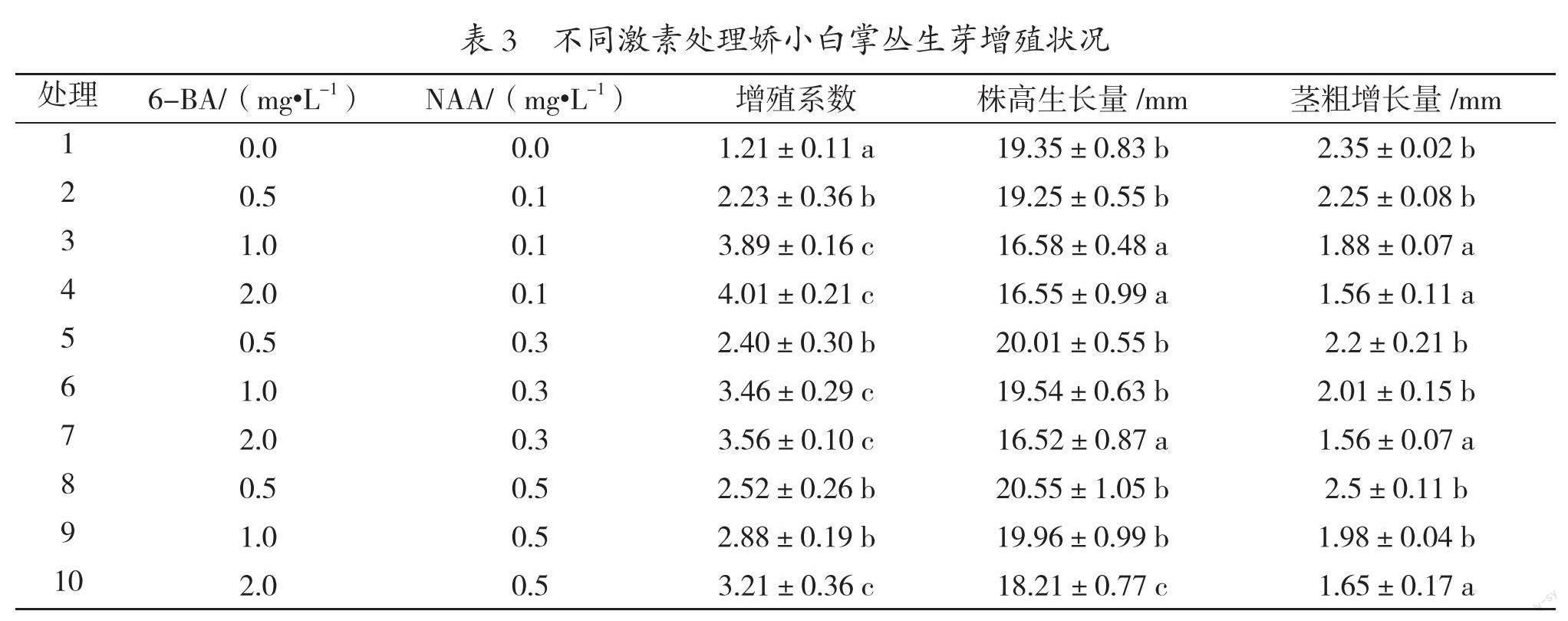
不定芽增殖培养基同样以MS为基本培养基,30 g/L蔗糖,5.5 g/L卡拉胶,pH值6.0;设计3个6-BA浓度梯度(0.5、1.0、2.0 mg/L),3个NAA浓度梯度(0.1、0.3、0.5 mg/L),并设立空白对照,每组处理10杯,3次重复,每杯不定芽放置量为5团,每团2~3个,株高大于20 mm的去顶留15 mm左右。培养30 d后统计丛生芽增殖系数、植株的株高生长量和茎粗增长量,增殖系数=培养后芽总数/接入芽总数,株高生长量(mm)=培养后芽高度-培养前芽高度,茎粗增长量(mm)=培养后芽茎粗-培养前芽茎粗。
1.2.4生根
生根培养基以MS、1/2 MS、2/3 MS为基础培养基,搭配活性炭AC(0、100 、300 、1 000 mg/L),不添加任何激素,其他如糖量、凝胶用量及pH值等均与增殖培养基相同。接入丛生芽为单株,株高大于30 mm、叶片数至少3片。每组处理10杯,3次重复,每杯放置量10株。培养30 d后统计生根数和根长,计算生根率;生根率(%)=生根植株数/接入植株数×100%。
1.2.5培养方法
外植体诱导丛生芽阶段培养条件为光强15 μmol/(m2·s),光照时间12 h/d,温度(25±1) ℃,湿度10%~70%;当材料进入增殖和生根阶段时,调整光照强度为25~45 μmol/(m2·s),光照12 h/d,溫度(21±1)℃;无光照时,温度不得低于19℃,空气湿度为40%~65%。
1.2.6数据分析
数据处理和分析应用EXCEL 2010和SPSS 19软件,采用Duncan's法进行多重检验,数据以平均值±标准误差(SE)进行表示。
2 结果与分析
2.1不同消毒时间处理结果
如表1所示,在娇小白掌外植体直径为5~7 mm,长度约15 mm,HgCl2消毒时间低于7 min时,外植体存活率低于50%,污染是造成存活率低的重要原因;而当消毒时间在9~11 min时,外植体存活率60%~70%,污染率下降,但同时外植体死亡率也随之上升,HgCl2消毒在一定时间范围内起到灭杀细菌真菌的作用,但同时也会对外植体产生毒害作用,因此需要根据外植体的体积大小判断消毒时间。总体而言,该品种在规定的体积限定下,HgCl2消毒时间控制在9~11 min,制种成功率在70%左右,能够为娇小白掌的组培研究提供一定量的无菌材料。
2.2不定芽诱导与分化状况
如表2所示,在诱导培养中,空白对照组的外植体萌发率最低为65%,且大部分并未有丛生芽萌发,整体生长缓慢,表明该品种的诱导需要激素的参与;在不添加NAA的处理中,当6-BA的用量低于1.5 mg/L时,部分外植体未能萌发,在6-BA用量为1.5~2.0 mg/L时,外植体的萌发率达100%,表明6-BA在娇小白掌不定芽诱导方面具有重要影响;当NAA用量在0.1~0.3 mg/L时,外植体萌发率均达到100%,表明娇小白掌外植体在细胞分裂素和生长素的共同作用下能够提高萌发率。在所有处理中,MS+2.0 mg/L 6-BA +0.1 mg/L NAA培养基最能有效诱导外植体萌发,萌发率达100%,并能诱导分化丛生芽,其丛生芽数显著高于其他处理,因此认定其为娇小白掌的最佳诱导培养基。
2.3不同培养基处理增殖状况
在诱导分化培养后,娇小白掌能够以芽长芽的方式进行增殖,有研究表明白掌品种在以2~3个芽为单位进行增殖的处理下能够获得最大的增殖系数[2]。因此本研究接入增殖培养基的丛生芽按2~3个芽为一团,并控制芽团高度为15 mm左右,以便计算生长量。
测试结果如表3所示,空白对照组培养30 d后,培养基中的植株基本没有分化出新的腋芽,但是有明显生长,茎粗2.35±0.02 mm,仅次于第8组处理,株高生长量也有明显增加,且基部有发达的根系生长,表明在没有添加激素的情况下,该品种基本不会增殖,但是能够达到类似生根培养的状态。所有处理中,添加激素的处理材料增殖系数均超过2.0,而6-BA用量超过1.0 mg/L时增殖系数均超过3.0,其中增殖系数最高的为第4组处理,即MS+2.0 mg/L 6-BA +0.1 mg/L NAA,也是本研究中诱导率最高的培养基,但其株高生长量不大,仅为16.55±0.99 mm,同时茎粗增长量也偏低,为1.56±0.11 mm,植株的长势整体偏弱,不利于进行后续生根培养。在植物组织培养中,丛生芽的增殖阶段在保持较高的增殖系数外,还需要一定的植株生长量,过高的增殖系数容易增加组培苗的变异率[9],而过低的增殖系数增加了转代的次数,也就意味着增加了相应的生产成本[14]。本研究在增殖系数较高的处理中,仅6号处理植株的生长量较高,茎粗增长量达2.01±0.15 mm,株高生长量达19.54±0.63 mm,在保持较高的增殖系数外,植株的生长量也相对较高,适合作为娇小白掌的增殖培养基;但是在重复使用该培养基2代后发现材料的生长量有明显的下降趋势,基部的侧芽渐渐形成愈伤团块,分化率下降,之后将材料转接到低激素培养基中,植株生长量有明显增加,这一点与朱飞雪的研究结果类似[15]。因此娇小白掌的增殖培养基以MS为基本培养基,激素搭配0.3 mg/L NAA,6-BA的用量为0.5 mg/L和1.0 mg/L在继代过程中交替使用。
2.4不同培养基的生根状况
增殖阶段时,在不添加任何激素的培养基中,娇小白掌增殖芽能够达到生根的效果,因此生根培养试验也采取不添加任何激素的措施,仅在MS用量和AC用量进行梯度测试。测试结果如表4所示,12组处理中,根长方面不具有显著差异;而植株的生根率与AC用量成正比,当AC用量为1 000 mg/L时,3组不同MS用量培养基生根率均达到100%;其中全量MS培养30 d后生根数量为3.56±0.74条,高于其他2组,达显著差异水平,因此娇小白掌最佳生根培养基为MS+1 000 mg/L AC。生根苗移栽入72目穴盘中,所用基质为泥炭土:珍珠岩:椰糠=311,养护过程中保持基质湿润但不积水(不干不浇),并视天气情况不定期喷雾,遮阳80%,种植30 d后,组培苗存活率在95%以上。
3 结论与讨论
如图1所示,娇小白掌相较于其他品种白掌,其性状表现最大的区别在于株型小巧;市面上常见的白掌品种如‘皇后‘美酒‘甜芝等,株高40~60 cm,冠幅30~50 cm,其中‘绿巨人株高甚至能达到130 cm,培养空间需求较大;而娇小白掌株高22~30 cm,冠幅18~30 cm,培养空间相对小,能够适应当前因人口增加而日益缩减的个人居住生活空间。
在无菌材料获得方面,采用新生嫩芽的顶芽为外植体,在外植体直径和长度统一的情况下,用75%酒精浸泡15~20 s后,再用1‰HgCl2消毒9~11 min,外植体存活率70%左右,这与其他相关研究者的实验结果类似[16,17]。在研究中发现,即使在没有添加任何外源激素的情况下,娇小白掌的外植体依旧能够萌发,只是萌发率偏低,不过在后续的继代过程中,极少有污染发生,表明新生嫩芽的顶芽具有较强的分化能力,且内生菌较少,在不破坏母本的情况下,新生嫩芽是较为优秀的外植体材料。
不定芽诱导方面,由于采用的外植体本身具有较强的分化能力,因此在各诱导处理中均有较好的表现,在少量激素的参与下,外植体能够分化出成形的丛生芽,并且后续能够以芽长芽的方式进行继代增殖,而其中诱导分化丛生芽最多的培养基是以MS为基本培养基,搭配2.0 mg/L 6-BA和0.1 mg/L NAA;这与荣薏等[8]、王颖等[18]的研究结果类似,仅在NAA的用量上存在少许偏差,但是与林加根等[19]、朱根发[20]的研究结果存在较大的差异,判断可能是由于外植体的材料不同导致分生能力不同,在诱导萌发阶段需要的激素水平也存在一定的差异。
有研究表明采用不同激素配比对组培苗的增殖有不同的影响[21],高浓度的BA或者TDZ搭配低浓度IBA(NAA)能够得使白掌的增殖系数高达8、10甚至26以上[10],但是这种高倍率分化得到的组培苗往往非常细弱,需要经历一代甚至几代的壮苗培养才能进入生根阶段,而组培苗在过多的转代过程中必不可少的发生污染,其间容易造成材料和人工的浪费,不利于工业化生产。在以往的报道中,白掌组培苗的增殖系数一般维持在4.0左右较佳[1]。本研究中,娇小白掌的组培苗在增殖阶段能够以芽生芽的方式进行增殖,适合的培养基为MS+1.0 mg/L 6-BA +0.3 mg/L NAA,增殖系数维持在3.5左右,并能获得较健壮的植株(株高大于30 mm、茎粗大于1.5 mm),不需要再进行壮苗可直接进入生根阶段,缩短了组培生产的整体工艺进程,有利于成本的控制。但是继代过程中,该培养基不能连续使用,需要与MS+0.5 mg/L 6-BA +0.3 mg/L NAA交替进行才能在维持3.5左右的增殖系数的同时,得到健壮的预生根组培苗。
在增殖阶段的测试结果可以看出,娇小白掌的组培苗易于生根;因此,本研究在娇小白掌的生根处理中,没有添加任何外源激素,仅在基础MS培养基中添加活性炭;在活性炭用量1 000 mg/L的条件下,植株生根率达100%,且根数达到3条左右,种植30 d后成活率高达95%,适合作为该品种的生根培养基。在多数白掌的组培研究中,生根培养基均有添加少量NAA 或者IAA以达到促进生根的效果[1],但是不同品种其生根能力不同[12],而作为生根能力较强的娇小白掌来说,在不添加激素的情况下也能生根,因此不需要额外添加激素;同时,这样处理有利于娇小白掌工业化生产的推进,一方面减少了激素的使用,降低了生产成本,另一方面提高了培养基的配置效率,优化了娇小白掌工业化生产流程。
综上所述,本研究初步构建了娇小白掌的组培快繁体系(图2),该技术路线能够实现娇小白掌的高效产业化生产,为市场提供优质娇小白掌的组培苗。
参考文献:
[1]刘晓青,朱世东,张克永,等.白掌组培技术研究进展[J].江苏农业科学,2016,44(3):207-210.
[2]吴贤彬,黄明翅,夏晴,等.“美酒”白掌茎尖培养及组培快繁技术[J].江西农业学报,2022(4):53-57.
[3]谢从寿,应薛养,杨福良,等.白掌的组培快繁工艺优化[J].东南园艺,2020,8(5):38-41.
[4]余亚白,陈源,赖呈纯,等.室内空气净化植物的研究与利用现状及应用前景[J].福建农业学报,2006(4): 425-429.
[5]杨舒婷,王华新,李娜,等.白鹤芋外植体材料的初步筛选研究[J].现代农业科技,2011(16):187-187.
[6]刘静,刘春,张黎.白鹤芋试管苗丛芽增殖与生根诱导试验[J].农业科学研究,2014,35(3):20-23.
[7]王慧瑜,张晓申,李晓青,等.白掌组培快繁技术研究[J].农业科技通讯,2015(2):78-80.
[8]荣薏,陈丽文,谢云等.皇后白掌的组培快繁试验研究[J].现代园艺,2012(15):3-4.
[9]陈荣,李庆玲,朱昌叁.TDZ在白掌组织培养中的应用[J].江苏农业科学,2012,40(5): 34-35.
[10]崔锡明,林思诚,柯沛强.两种外源激素在白掌组织培养不同阶段的剂量研究[J]. 广东林业科技,2004(2): 20-22.
[11]梁峥,张晓纲,霍慧敏,等.香水白掌的组培快繁技術研究[J].种子,2021,40(1): 138-144.
[12].陈汉鑫,张连水,万学锋,等.白掌品种‘维克茎尖离体培养及快速繁殖[J].福建农业学报,2013,28(5): 486-489.
[13]吴丽君,神灯白掌组织培养的研究[J].森林与环境学报,2001,2(21): 169-172.
[14]林哲汇.‘美酒白掌工厂化育苗关键技术研究[D].福州:福建农林大学,2017.
[15]朱飞雪,郭丽.白掌的组织培养技术研究[J].河南农业,2014(6):40-42.
[16]朱根发.白鹤芋属观赏植物的组织培养和快速繁殖技术研究[J].中国农学通报,2003(3):75-76,88.
[17] 江金兰,叶炜,罗庆国,等.白掌的组培与快繁技术[J].浙江农业科学,2011(5):1019-1020.
[18]王颖,张晶晶,贾爱平,等.白掌的组织培养与快速繁殖研究[J].中国农业信息,2016(7): 126-128.
[19]林加根,鞠一栋,吴维坚,等.娇小白掌的组培快繁研究[J].现代农业科技,2010(13): 218-221.
[20]朱根发.绿巨人白掌不同外植体组织培养研究[J].亚热带植物科学,2004(1): 53-55.
[21]胡莹,杨柳青.山茶科植物组织培养研究进展[J].江苏农业科学,2008(2): 6-9.
(责任编辑:黄雄峰)

