脂肪酸多重感知受体及其信号传导研究进展
王敏,安 琦,于雪宁,袁 玥,杨会心,2,韩天龙,2*,刘登勇*
(1 渤海大学食品科学与工程学院 辽宁锦州121013 2 辽宁喀左山猪科技小院 辽宁朝阳 122305)
脂肪味也被称为油脂味(Oleogustus),是味蕾感受到的脂肪味道,不归类于“酸、甜、苦、咸、鲜”五味[1-2]。食物进入口腔时,通过味蕾顶端的味觉细胞(Taste-receptor cell,TRC)进行味觉感知。味觉细胞含有化学感受受体,可识别多种味道,传递味觉信号,调节食欲[3]。根据形态可将其分为4 类:Ⅰ型胶质样细胞,与咸味感知有关;Ⅱ型纺锤形细胞,表达甜味、苦味、鲜味、脂肪味味觉受体;Ⅲ型神经元样细胞,表达突触相关蛋白,同时可检测到酸味刺激;Ⅳ型基底细胞,根据机体要求更新味蕾细胞系[4-5]。本文重点介绍脂肪酸感知过程中涉及的受体及其介导的信号通路,阐述脂肪酸的感知机制。
1 脂肪味感知
脂肪在口腔的感知形式是游离脂肪酸。研究表明,游离脂肪酸可以对味觉细胞产生有效的刺激,促进味觉细胞去极化现象的发生[6-7]。根据脂肪酸碳链的长度可分为短链脂肪酸(Short-chain fatty acid,SCFA)、中链脂肪酸(Medium-chain fatty acid,MCFA)和长链脂肪酸(Long-chain fatty acid,LCFA),各类脂肪酸经不同受体传导有不同的反应。其中SCFA 具有与酸味相似的特征,如柠檬酸引起的酸刺激;MCFA 则参与糖代谢、脂代谢和信号转导;LCFA 参与受体的激活传导,对脂肪味的表现最为明显[8]。
脂肪酸的味觉感知发生在Ⅱ型细胞中,其传导机制可借鉴甜味、苦味和鲜味感知途径。脂肪摄入后进入口腔,经舌脂肪酶作用,游离脂肪酸被释放,激活味蕾细胞上的味觉受体[9],如白细胞分化抗原36(Cluster of differentiation 36,CD36)、G蛋白偶 联受体(GPR40、GPR41、GPR43、GPR84、GPR120)和内源性大麻素受体(CB1、CB2)。脂肪味觉信号传导离子通道有延迟整流钾离子(K+)通道和钙离子(Ca2+)通道,包含参与脂肪酸感应的下游机制。相应受体作用使离子通道打开,细胞内外钙信号发生变化,介导细胞发生去极化现象,来促进脂肪酸的感知。同时体内释放神经递质(Neurotransmitter,NT)等相关信息,如5-羟色胺(5-HT)、γ-氨基丁 酸(Gamma-aminobutyric acid,GABA)、三磷酸腺苷(Adenosine triphosphate,ATP)等。NT 通过面神经、舌咽神经和迷走神经传递至脑干中的孤束核(Nucleus of solitary tract,NTS),进一步将味觉信息发送到下丘脑与饮食相关的区域,在中枢神经系统(Central nervous system,CNS)形成味觉感知,并在大脑神经回路中调节食欲,产生接受或拒绝食物的信号[10-11],消费者即表现出对食物消费或回避的特征。
多种味道共同作用时,口腔对味道的感知存在相互干扰或有部分重叠的机制[12],如脂肪味与苦味的共同感知。研究表明,脂肪味和苦味同时对味蕾细胞产生刺激时,下游通道被激活,Ca2+浓度在对脂肪味和苦味的感知过程中发生改变[13-14],脂肪酸传导中钙信号的变化使得通道变化,从而抑制苦味感知。另有研究表明,味觉感知与基因遗传多样性相关,油脂口腔检测的脂肪敏感度也证实了这点[15]。长期高脂饮食会带来脂肪酸口腔味觉检测敏感性降低、感知阈值增加,表明脂肪摄入量和敏感性之间存在负相关。可从嗅觉、触觉等多角度来研究及评价脂肪酸的口腔感知,以更好地引导消费者喜好[16]。
2 味觉受体
2.1 CD36
CD36 是广泛表达的多功能跨膜糖蛋白,属于B 类清道夫受体家族,与脂肪酸的口腔感知密切相关。CD36 存在于味蕾细胞顶端,是多种脂肪酸配体以及转运体的受体[3]。游离脂肪酸激活CD36的信号通路如图1 所示。LCFA 诱导CD36 活化,通过src-蛋白酪氨酸激酶(Protein tyrosine kinase,src-PTK)的磷酸化激活磷脂酶C(Phospholipase C,PLC)介导的下游信号传导,PLC 促进质膜磷脂酰肌醇-4,5-二磷酸(Phosphatidylinositol-4,5-bisphosphate,PIP2)产生肌醇三磷酸(Inositol trisphosphate,IP3)和二酰基甘油(Diacyl glycerol,DAG)。IP3 与其位于内质网(Endoplasmic reticulum,ER)上的IP3R3 受体结合,诱导Ca2+从内部储存中释放。内质网释放的Ca2+从Efflux 通道外流,从而激活SOC 和CALHM1 通道触发胞外Ca2+内流,由基质相互作用分子亚型1(Stromal interaction molecule 1,STIM1)和Ca2+流入因 子(Ca2+influx factor,CIF)协调[17-18]。同时,DAG 打开有利于钙离子内流的TRPC1/3 通道,也受STIM1 调控。Ca2+水平升高使味蕾细胞发生去极化现象,介导味觉信号的检测和传递,并介导丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)级联反应。DAG 还经由蛋白激酶C(Proteinkinase C,PKC)抑制细胞质膜上的钾离子通道[19]。研究发现,细胞外调节蛋白激酶(Extracellular-signal-regulated kinase 1/2,ERK1/2)参与脂肪口腔感知,下调ERK1/2 信号,显著降低了小鼠的脂肪偏好[20-21]。ERK1/2 和MEX 水平可通过src-PTK 介导的钙调蛋白依赖性蛋白激酶2(Calmodulin-dependent protein kinase,CaMK2)激活而增加。
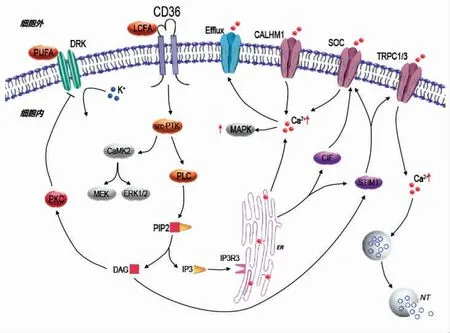
图1 游离脂肪酸激活CD36 的信号通路Fig.1 Signal pathway of CD36 activated by free fatty acids
研究发现,高浓度亚油酸通过CD36 和GPR120 诱导Ca2+信号通路,而低浓度亚油酸仅激活CD36。同时发现肥胖小鼠自发性的脂肪偏好减少,这可能与相关促食欲肽的表达有关[22-23]。对CD36 脂肪酸味觉感知和唾液肽YY(PYY)的研究表明,人类口腔脂肪检测阈值和肥胖与基因的表达有关[24]。人类个体对脂肪酸感受的阈值不同,敏感性也不一致[25-26]。长期的高脂饮食令味觉感受器发生改变,使脂肪感知失调,味觉神经回路改变。某些脂肪酸口服会刺激CD36 来增加胰腺分泌物,这是一种头期反应,为之后肠道消化脂质做准备[27]。味蕾中CD36 的下调引起脂肪敏感性降低,Ca2+信号也在脂肪偏好的调控中有重要作用[28]。除此之外,CD36 在身体各个细胞内均有表达,参与心脏和肌肉中重要生理代谢活动,是全身脂质稳态的关键膜蛋白,能够通过调节脂肪酸代谢来影响疾病的发生率[29]。
2.2 G 蛋白偶联受体
G 蛋白偶联受体家族中的GPR40、GPR41、GPR43、GPR84 和GPR120 已被鉴定为游离脂肪酸的特异性受体。有研究通过使用mRNA 表达、蛋白质印记、不同脂肪酸受体的免疫酶染色,证实GPR120、GPR43、GPR84 以及延迟整流钾离子通道在人类真菌状味蕾细胞中的表达[30-31]。这些G蛋白偶联受体的组织分布、激活配基、信号传导途径和生理功能均存在差异,如表1 所示。GPR40 在胰腺和脑中表达最高,受MCFA 和LCFA 激活,与胰岛素(Insulin,INS)、胰高血糖素(Glucagon,GLU)、CCK、瘦素(Leptin,LEP)等激素分泌密切相 关。GPR41 和GPR43 都可被SCFA 激 活,GPR43 主要表达于淋巴组织,GPR41 则主要表达于脂肪组织。GPR84 主要表达于骨髓、中性粒细胞和肺脏,可被MCFA 激活,而其细胞内信号机制与GPR40 迥然不同,主要调节机体免疫反应。GPR120 在肠内分泌细胞、味觉细胞、脂肪细胞和免疫细胞中表达,可被各类型游离脂肪酸激活,引起细胞内信号转导,发挥能量调节、免疫稳态和神经元功能[32]。

表1 G 蛋白偶联受体分布及功能Table 1 Distribution and function of G protein-coupled receptors
2.2.1 GPR40 游离脂肪酸受体1(Free fatty acid receptor 1,FFAR1)又称GPR40,一类由人类FFAR1 基因编码的受体。GPR40 在小鼠味蕾真菌、叶状乳头中均未发现,在大鼠和人类的味蕾细胞中也未检出[34]。在脂肪酸感知方面起辅助作用。研究表明,GPR40 和GPR120 在配体结合上有重叠[35],需要相互作用来参与诱导。通过味蕾细胞表达的GPR40,激活舌咽神经不足以诱导小鼠的脂肪偏好[30]。也有研究发现,小鼠环状乳头中存在GPR40 的表达,能够通过较短的MCFA 来扩大脂肪酸感知[31]。结合人类数据分析,脂肪酸的味道对适口性没有明显影响[7]。对于高脂饮食培养的小鼠来说,GPR40 和GPR120 共同在下丘脑被激活比单独被激活起到更有效的调节作用。在大脑中表达的GPR40 可以控制疼痛的调节系统,经多不饱和脂肪酸作用对大脑神经系统产生影响[36-37]。
GPR40 主要在胰腺β 细胞中表达,并被MCFA 和LCFA 激活[19]。诱导各类肠胃激素分泌来调节血糖,对治疗糖尿病代谢紊乱方面有重要作用[38-39]。游离脂肪酸激活GPR40 的信号通路如图2 所示。GPR40 除与G-αq 蛋白家族偶联,引发PLC 信号通路外。还可与G-αi 结合通过腺苷酸环化酶(Adenylate cyclase,AC)减少环腺苷酸磷酸(3'-5'-cyclic adenosine monophosphate,cAMP)水平,促进胰高血糖素的分泌;或与G-αs 结合,增 加 cAMP 水 平,刺激腺苷酸(Adenosine monophosphate,AMP)、蛋白激酶A(Proteinkinase A,PKA)和cAMP 反应元件结合蛋白(The cAMP responsive element binding protein,CREB)生成,促进糖原分解、蛋白质合成和食欲调节激素等的分泌[40]。与GPR120 相似,GPR40 也可通过β-arrestin2 通路抑制NFκB 的表达和引起味觉偏好,还可与MAPK 级联,促进细胞增殖和免疫。

图2 游离脂肪酸激活GPR40 的信号通路Fig.2 Signal pathway of GPR40 activated by free fatty acids
2.2.2 GPR41 游离脂肪酸受体3(Free fatty acid receptor 3,FFAR3)又称GPR41,能够被SCFA 激活,通过不同介质触发下游信号传导通路,被认为是治疗炎症和代谢疾病的靶点[41]。SCFA的味觉感知与酸味有部分重叠,其刺激及信号传导机制还需进一步研究。GPR41 在脂肪感知过程中影响味觉信号,有调节脂肪和脂肪酸味觉敏感度的作用,也介导细胞对多种NT 和激素的反应。GPR41 在脂肪细胞中表达最高,其次是单核细胞和嗜中性粒细胞。GPR41 是SCFA 的低亲和力受体,只有当SCFA 水平异常升高时才会被激活。
SCFA 激活GPR41 发挥功能的信号途径如图3 所示。GPR40 可与G-αi 偶联,减少cAMP 水平,促进胰高血糖素的分泌[42]。还可与βγ 偶联,通过PLC 通路激活PKC,促进糖原分解和insulin、PYY、5-HT 的释放。PKC 还可经瘦素(Leptin,LEP)作用于外周AMP 蛋白激酶(AMP-activated protein kinase,AMPK),升高丙二酰辅酶脱羧酶(Malonyl-CoA decarboxylase,MCD)水平,降低丙二酰辅酶A(Malonyl-CoA,MA)和乙酰辅酶A 羧化酶(Acetyl CoA carboxylase,ACC)水平,进而促进脂肪氧化,抑制脂肪合成和泡沫细胞形成。此外,SCFA 可通过激活小鼠结肠上皮细胞的GPR41 来积极响应免疫应答并激活丝裂素活化蛋白激酶p38(p38MAPK,p38)和ERK1/2 通路,从而介导保护性免疫反应[42]。
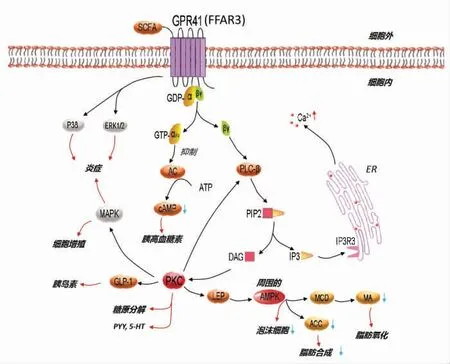
图3 游离脂肪酸激活GPR41 的信号通路Fig.3 Signal pathway of GPR41 activated by free fatty acids
2.2.3 GPR43 游离脂肪酸受体2(Free fatty acid receptor 2,FFAR2)又称GPR43,与GPR41属于同源家族,也是SCFA 受体。GPR43 在免疫细胞中表达最高,其次为脂肪组织、肠内分泌细胞,参与胃肠运动、胃肠肽分泌、脂代谢、肌肉代谢、食欲调节、炎症反应等活动。研究发现,GPR43 在人的真菌状乳头及味蕾组织中也有表达,与脂肪摄入量有关[31]。SCFA 激活GPR43 发挥功能的信号途径如图4 所示。GPR43 与G-αi 结合时,可抑制cAMP 信号通路;与G-αq 结合时,可诱导PLC 通路的激活,促进Ca2+的动员和PKC、外周AMPK 通路的激活。G-αi 和G-αq 通过提高蛋白激酶B(Protein kinase B,PKB/AKt/Rac)和ERK 水平,激活信号转导和转录激活因子(Signal transducer and activator of transcription,STAT3)和维甲酸相关核孤儿受体γt(Retinoid-related orphan receptor γt,RORγt),进而促进白细胞介素-22(Interleukin-22,IL-22)释放。GPR43 还可经β-arrestin2 通路促进NFkB 抑制蛋白(Inhibitor of nuclear factor NFkB,I-κBα)、抑制核因子-kB(Nuclear factor-kappa B,NFkB),参与机体炎症反应[43]。另外,GPR43 可通过提高活性氧(Reactive oxygen species,ROS)水平,激活NLRP3 炎症小体,促进IL-1 释放[44]。
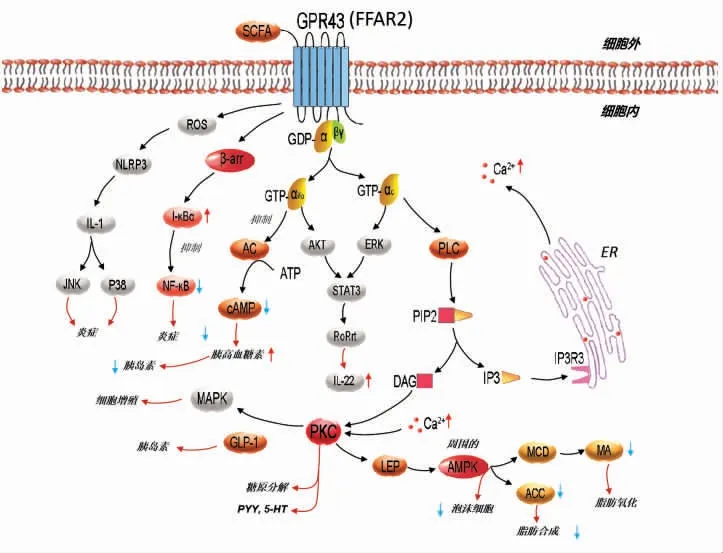
图4 游离脂肪酸激活GPR43 的信号通路Fig.4 Signal pathway of GPR43 activated by free fatty acids
2.2.4 GPR84 GPR84 的激活与脂肪酸代谢和免疫系统有关,多存在于脂肪细胞。GPR84 作为MCFA 的受体,在口腔味蕾细胞中未检测出表达,对于该受体的研究着重于糖脂代谢引起的疾病方面[45]。人体内GPR84 主要在骨髓、外周白细胞和肺表达,其它组织器官中表达量较低,若机体发生炎症反应时,会诱导其高表达[46]。MCFA 激活GPR84发挥功能的信号途径如图5 所示。GPR84 与G-αi结合时,抑制cAMP 信号通路,激活AKT。与Gα15 结合时,激活PLC 通路和ERK,并可经ERK诱导ROS 通路和NFκB 通路。GPR84 还可经白细胞介素12-p40(Interleukin 12-p40,IL-12p40)和单核细胞趋化蛋白-1(Monocyte chemotactic protein-1,MCP-1)提高肿瘤坏死因子α(Tumour necrosis factor-α,TNFα)水平,参与炎症反应;或经脂联素(Adiponectin,ADPN)提高过氧化物酶体增殖物激活受体(Peroxisome proliferators-activated receptor,PPAR)和AMPK 水平,参与机体抗炎反应[45]。
2.2.5 GPR120 游离脂肪酸受体4(Free fatty acid receptor 4,FFAR4)又称GPR120,是一种游离脂肪酸受体,它能够传递过量脂肪酸的信号[22-23]。GPR120 刺激味觉细胞信号传递,从传入神经至中枢神经系统,在Ⅱ型细胞中表达并被LCFA 激活。GPR120 是舌上皮中真正的味觉受体细胞,主要功能为增强脂肪酸的感知能力,即放大感知信号。与CD36 传导机制互补,还可能在下游或者脂肪入口后的相关途径中发挥作用[47]。GPR120 对于脂肪偏好的影响较小,可通过促食欲功能抑制神经元表达并缓解下丘脑炎症。研究发现,通过周期性脂肪干预能够影响脂肪敏感性。CD36 在餐前的高度表达影响膳食脂肪的短期反应,而GPR120 参与影响膳食脂肪的长期反应[48]。
对大鼠的研究表明,GPR120 不仅对LCFA 有反应,还能与MCFA 和SCFA 相互作用[49-50]。TUG891 是一种新型的GPR120 激动剂,可与舌侧GPR120 结合,激活小鼠舌-脑-肠轴并调节脂肪偏好[51-52]。各类脂肪酸激活GPR120 发挥功能的信号途径如图6 所示。GPR120 与G-αq 蛋白家族偶联,通过PLC 信号通路,促进内质网Ca2+释放和DAG 生成。Ca2+通过刺激GLP-1 和PKC,促进胰岛素分泌、糖原分解和细胞增殖;DAG 除了作用于PKC 外,还可通过ERK1/2 抑制NFkB 的表达,进而调节炎性因子的分泌。GPR120 可通过βγ 基团刺激磷脂酰肌醇-3-激酶(Phosphatidylin-ositol-3-kinase,PI-3K)、PKB 表达和K+外流,促进细胞增殖,抑制细胞凋亡。在G 蛋白偶联受体激酶(G protein-coupled receptor kinases,GRKs)的作用下,β-arrestin2 可作为支架蛋白将GPR120 与结合蛋白1(Binding protein 1,TAB1)、转化生长因子激活激酶1(Transforming growth factor activated kinase 1,TAK1)信号通路级联,通过MAPK 激酶(MAP kinase kinase,MKK)抑制c-Jun N 端激酶(c-Jun N-terminal kinase JNK)的表达,通过κB 抑制因子激酶(Inhibitor of kappa B kinase,IKK)抑制NFκB 的表达,从而抑制下游炎性信号传导[53]。此外,GPR120 还可经β-arrestin2 途径引起味觉偏好。

图6 游离脂肪酸激活GPR120 的信号通路Fig.6 Signal pathway of GPR120 activated by free fatty acids
2.3 内源性大麻素受体
内源性大麻素系统(Endocannabinoid system,ECs)通过控制食物摄入及能量消耗达到对食欲的调节,主要机制是内源性大麻素激活相关受体反应并通过神经传导得到反馈[54-55],如N-花生四烯酸乙醇胺(Anandamide,AEA)和2-花生四烯酸甘油(2-Arachidonoylglycerol,2-AG),二者都有通过激活内源性大麻素1 型受体(Cannabinoid receptor 1,CB1)来增强食欲,增加食物摄入的特性[56]。内源性大麻素受体存在于CNS 及外周系统,对神经信号等进行调节[57]。研究发现,口腔中脂肪的摄入与唾液中内源性大麻素水平的变化相关,脂肪以此来调节从神经传出至脑干的味觉信号,在大脑相应区域促进食欲相关激素的产生[58-59]。内源性大麻素是脂肪酸衍生物,通过相应受体调节进食行为。与脂肪酸感知相关的受体主要有内源性大麻素受体CB1 和CB2[41]。CB1 在小鼠舌头的菌状乳头及外周乳头细胞中的表达得到证实,被激活后引发神经传导,起到调节甜味、脂肪味的作用,同时影响大脑控制食物摄入[60]。小鼠偏好研究表明,CB1 通过调节钙信号来影响脂肪味觉感知。LCFA 的口腔味觉感知与舌GLP-1 分泌有关,CB1激活刺激GLP-1 的产生,从而调节LCFA 的感知阈值,改变食物的适口性[61]。
内源性大麻素激活受体发挥功能的信号途径如图7 所示。2-AG 和AEA 激活突触前膜CB1/2受体,受体通过G-αi 抑制cAMP 信号通路,减少基因表达和NT 分泌。被激活的CB1/2 受体还可促进K+外流,抑制Ca2+内流和MAPK 通路,同时通过这些途径抑制NT 分泌和信号传导[62]。NT 激活突触后膜相应受体,通过PLC 途径增加胞内Ca2+和DAG 水平,从而引发动作电位和信息传递。2-AG 和AEA 进入细胞后可被内质网上的脂肪酸酰胺水解酶(Fatty acid amide hydrolase,FAAH)、含α-β 水解酶结构域6(Alpha-beta hydrolase domain-containing,ABHD6)和单酰基甘油脂肪酸酶(Monoacylglycerol lipase,MAGL)等酶水解为花生四烯酸(Arachidnic acid,AA)和乙醇 胺(Ethanolamine,EA),或被p21 蛋白激活激酶1(p21-actived kinase 1,PAK1)激活的环氧合酶2(Cyclooxygenase 2,COX2)氧化[63]。

图7 内源性大麻素激活CB1/2 的信号通路Fig.7 Signal pathway of CB1/2 activated by endocannabinoids
3 脂肪味传导
脂肪酸味觉传导是化学感受的一种,它触发受体或离子通道,使味蕾细胞去极化,细胞质钙浓度增加,引起的细胞信号级联对健康有重要影响[19]。脂肪酸溶液的味觉诱发电位(Gustatory evoked potential,GEP)试验,描述了GEP 对脂肪酸的反应,并证明口腔中脂肪酸的存在会触发味觉皮层的激活。钠、钙与人体营养及食物摄入密不可分,因此需要研究感知过程中的钠离子与钙离子的信号传导机制,达到调节饮食的目的。
脂肪摄入过度会引发一些代谢性疾病。脂质组学、生物学功能等研究在对抗代谢疾病的新治疗方法领域有很大发展潜力。脂肪摄入对食欲影响的深入研究,也离不开神经相关通路的作用。有研究证明,脂肪在体内进行代谢时,大脑所拥有和传递的信息至关重要。大脑的小胶质细胞,富含多种脂肪酸,能够作为免疫细胞抵抗肥胖所引起的慢性炎症[64-65]。
3.1 延迟整流钾离子通道
延迟整流钾离子通道(Delayed-rectifier K+channel,DRK)与大鼠的脂肪味觉感知相关[4]。DRK 通道嵌入舌味蕾细胞的顶膜部分,允许钾离子流入细胞外空间[31]。正常细胞中电压门控型钾通道shaker 亚族成员5(Voltage-gated potassium channel shaker -related subfamily member 5,KCNA5)即Kvl.5 受到激活打开,细胞内钾离子外流形成电流,味觉细胞接受脂肪酸后被改变。如LCFA 与CD36 结合并改变其活性,使得Kvl.5 离子通道关闭,钾离子无法外流,使得味觉细胞发生去极化现象,伴有神经递质的释放。Kvl.5 是在大鼠菌状乳头TBC 中发现的主要通道,且有3 个主要亚型KCNA、KCNB 和KCNC。目前DRK 通道在人类味蕾中的表达与具体作用机制尚未确定[66]。
基因和蛋白表达结果分析表明,CD36、GPR43、GPR84、GPR120 和某些 类型的DRK 通道,如KCNA2,存在于人真菌状乳头样本中。进一步定量分析表明,各种脂肪酸受体之间具有相关性,它们在感知脂肪酸的过程中发挥着不同的作用。与啮齿动物相比,人类的脂肪味觉受体表达有所不同,在大鼠中主要的离子通道是KCNA5,而人是KCNA2[31]。
3.2 钙信号
钙信号是区分Ⅱ型和Ⅲ型味觉细胞的关键特征,脂肪酸与CD36 或GPR120 结合,激活PLC 通路,使得细胞器膜上的Ca2+通道打开,细胞质内Ca2+浓度上升,同时引起Na+通过瞬时电位M 亚型5 通 道(Transient receptor potential melastatin channels 5,TRPM5)流入细胞内,导致味觉细胞去极化和神经递质的释放[67]。在小鼠味蕾细胞中,发现由LCFA 激活的钙池调控离子通道(Storeoperated channels,SOC)由Orai1 和Orai1/3 蛋白组成[19]。TRPM5 是Ca2+触发的单价非选择性阳离子可渗透通道,在TRC 中充分表达,对于苦味、鲜味和甜味的传导至关重要,也可能是脂肪味道信号的一个关键通道[19]。有研究发现,Cav3.2 是一种t 型低电压激活的钙通道,在神经元的兴奋性和各种生理功能中至关重要。通过研究下丘脑神经元的表达在小鼠食物摄入量和体重调节中的作用,表明Cav3.2 是治疗肥胖和糖尿病的一个靶点[68]。对缺陷及野生小鼠实验表明,TRPM5 在脂质味道感知中有重要作用,TRPM5 小鼠会在脂肪作用下产生强烈偏好,而敲除后小鼠的脂肪偏好消除[69-70]。此外发现,TRPM5 在下丘脑和脑干的表达情况会因为肥胖而降低[71-72]。
3.3 神经信号
化学感觉基于触觉,由三叉神经感知。化学物质进入口腔时,位于口腔表面的味觉细胞中的味觉感受器被激活,向大脑皮层发送信号。脂肪也通过三叉神经被感知,三叉神经向大脑发送在口腔中产生的信号。从分支到达眼睛、鼻子、牙齿和舌头,负责下一步的感知刺激,同时有疼痛和温度的影响。然而,因味道和质地比较难区分,故在具体位置品尝或感觉到脂肪的问题仍未明确。从Ⅱ型细胞到神经系统之间的具体机制还不够明确[66]。味蕾细胞内钙信号的改变促进了神经递质的释放,许多神经递质被用于TRC 和初级感觉传入神经之间的突触,其中包括去甲肾上腺素、乙酰胆碱、多巴胺、5-HT、降钙素基因相关肽和氨基酸(GABA 和谷氨酸),而5-HT 是关键的味蕾神经递质。从稳态及享乐系统的内部调节,包括饥饿诱导的味觉修饰,相关促食欲神经元的表达等,在调节食欲与味觉感知中发挥着关键作用[73-74]。
3.4 其它通路
MAPK 级联通路的激活通过ERK1/2 信号通路响应脂肪酸味觉检测。研究表明,CALHM1 离子通道发生变化,调节人与小鼠味蕾细胞中ERK1/2-MAPK 的激活和5-HT 的释放[21]。MAPK 通路和CALHM1 通道是LCFA 口腔味觉感知所需的额外参与者,通过CD36 来触发MAPK 的磷酸化,与味蕾细胞中Fyn 进行磷酸化偶联。表明脂肪酸诱导的Ca2+信号通路,需要激活CD36 以及味蕾细胞中的Fyn 激酶[35]。膳食脂肪酸通过钙通道调节味蕾细胞的激活,与CD36 结合在脂质筏,诱导Fyn 磷酸化,产生IP3 使Ca2+外排,通过开放的SOC 通道进入细胞,产生电信号经神经传导至细胞外[21]。将基因缺陷型小鼠维持在高脂肪饮食的培养实验中,进一步探讨ERK1/2 信号传导对肥胖的影响,发现二者发挥不同的作用,并且在缺乏ERK1 的情况下,ERK2 与饮食诱导的肥胖症中的胰岛素抵抗和高血糖有关[35]。基因敲除实验证实了细胞中脂肪酸诱发的Ca2+信号和ERK1/2 磷酸化水平均降低。ERK1/2-MAPK 级联通过味蕾细胞中CALHM1 通道打开,而关于该通路在肥胖患者体内的作用还需进一步考证。
4 结语
脂肪的味觉感知涉及多个受体结合以及离子通道的作用,还有多重味道之间的串扰模型,是一个非常复杂的感知传导系统。目前,关于CD36 和GPR120 等舌脂传感器耦合的第二信使级联已被广泛研究,而其具体机制仍未完全明确。在脂肪味觉感知过程中是否有其它脂肪酸受体的参与,以及脂肪味从口腔到大脑的传导途径等还需进一步研究证实。GPR41、GPR43、GPR84 等受体对游离脂肪酸有高亲和力及增强感知的作用,然而它们在味蕾细胞上的表达和定位仍不清楚。脂肪味的神经传导可能还涉及大脑的相关奖励机制、能量感知系统以及食物摄入调节系统等调节。对于脂肪味觉感知机制,还应注重神经内分泌学的研究,因脂肪味觉感知不仅是一种中枢调节反应,还涉及激素分泌影响。味蕾分泌的激素可能与脂肪酸味受体一起放大或降低味觉信号,然后传入中枢神经。因此,脂肪口腔感知的自分泌/旁分泌信号对于进一步明确脂肪酸感知和传导机制也是十分必要的。对于脂肪味觉信号转导机制及其在健康和疾病中的生理相关调控,还有很长的路要走。脂肪酸及其代谢物和衍生物分布于机体各部位,与相应受体结合后参与细胞增殖、免疫应答、糖脂代谢和机体内环境稳态等生理活动。脂肪酸受体及其介导的信号途径和功能研究,对指导健康饮食,改善肥胖和糖尿病等代谢性疾病具有重要意义。

