豌豆抗性淀粉对磷酸化肌原纤维蛋白基乳液体外消化率及凝胶特性的影响
胡方洋,陈金玉,郭晋廷,李若涵,张 萱,张颖璐,张坤生
(1 天津市食品生物技术重点实验室 天津商业大学生物技术与食品科学学院 天津300134 2 百色学院 农业与食品工程学院 广西百色533000 3 天津二商迎宾肉类食品有限公司 天津 300385)
在肉制品生产中,大多数的加工肉制品(如肉糜类)实际上是一种乳液胶体系,脂肪被斩拌成小球状并被肌肉蛋白稳定在体系中[1]。肌原纤维蛋白(Myofibrillar protein,MP)是肌肉蛋白的主要成分,由肌球蛋白、肌动蛋白和肌动球蛋白等组成,占肌肉总蛋白的50%~60%。MP 的乳化性和热诱导凝胶特性是肉糜类产品加工的基础,直接关系肉制品的嫩度和保水性[2]。目前,国内外学者采取各种手段对蛋白质进行改性以提升其功能。本课题组在前期研究中也发现,对MP 进行化学磷酸化修饰,可以改善蛋白的乳化和凝胶特性[3-4]。
抗性淀粉(Resistant starch,RS)又称难消化淀粉、抗酶解淀粉,是指那些不能在人体健康小肠内消化吸收的一类淀粉及其降解物的总称。RS 具有控制血糖、调节肠道和防止脂肪堆积等重要的生理功能,是一种新型膳食纤维,可通过酶解、压热、微波及复合处理等方法制备[5]。有研究发现,RS 在受热时可与蛋白发生作用而增加肉制品的保水性[6]。成昕等[7]运用核磁共振技术研究发现,抗性淀粉添加量在4%时,对肉糜的保水效果要比6%的普通淀粉好。Felisberto 等[8]研究发现,抗性淀粉与其它功能性成分如菊粉、低聚果糖等结合能提高肉蛋白凝胶的温度,增强低盐低脂肉制品的乳化稳定性。本课题组之前的研究也发现添加适量的玉米抗性淀粉,可增强MP 的凝胶强度和持水性[9]。考虑到单独添加抗性淀粉或仅使用磷酸化技术对MP 凝胶特性的改善效果有限,本文在前期研究的基础上,进一步探讨抗性淀粉协同磷酸化修饰对MP 凝胶特性的影响。
此外,肉蛋白的消化性是评价其营养价值的重要指标。与植物蛋白相比,肉蛋白的氨基酸组成均衡,更易消化,营养利用率高[10]。蛋白质的消化率很大程度上受其结构和理化特性的影响[11]。目前,关于磷酸化修饰对MP 体外消化的影响研究还较少。本课题组之前的研究发现,豌豆抗性淀粉不仅能很好地维持香肠的营养成分和品质,还使香肠的估计血糖生成指数(eGI)明显降低[12]。然而,豌豆抗性淀粉与磷酸化修饰复配使用对MP体外消化率的影响尚不明确,值得进一步研究。
本试验通过建立磷酸化MP 基乳化液体系,将豌豆抗性淀粉按照0%,2%,4%,6%的比例添加至乳液体系中,研究豌豆抗性淀粉对磷酸化MP基乳液消化率及其凝胶特性等性质的影响。研究结果可为抗性淀粉在肉制品加工中的进一步应用,以及维持蛋白的营养特性和改善肉制品的品质提供理论参考。
1 材料与方法
1.1 材料与试剂
豌豆抗性淀粉(Pea resistant starch,PRS),实验室自制;鸡胸肉,天津市西青区58 号华润万家超市;牛血清蛋白(Bovine serum albumin,BSA),Sigma 试剂公司;NaCl(分析纯),天津渤化化学试剂有限公司;MgCl2(分析纯),天津市天大化工实验厂;EDTA(分析纯),天津市赢达稀贵化学试剂厂;Na2HPO4、NaH2PO4(分析纯),天津市光复科技发展有限公司;焦磷酸钠(分析纯),天津石英钟厂霸州市化工分厂;食用植物调和油,益海嘉里食品营销有限公司;人工唾液(pH 6.8)、人工胃液(无菌)、人工小肠液,福州飞净生物科技有限公司;蛋白试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
ME2002/02 电子天平,梅特勒-托利多仪器(上海)有限公司;HH·SY21-Ni 电热恒温水浴锅,北京市长风仪器有限公司;CE-9600 便携式超声仪,东莞市洁康超声波设备有限公司;LTDBX120F 精密可编程热风循环烘箱,立德泰勀(上海)科学仪器有限公司;800Y 多功能粉碎机,铂欧五金厂;GB6003-88 标准100 目筛,浙江上虞市华康化验仪器厂;H1850R 台式高速冷冻离心机,湘仪离心机仪器有限公司;FA25 均质机,上海弗鲁克流体机械制造有限公司;YCD-EL260 医用冷藏冷冻箱,中科美菱低温科技股份有限公司;SMSTA TA.XT plus 物性测定仪,英国Stable Micro Systems 公 司;Physica MCR 301 高级旋转流变仪,奥地利安东帕公司;Spark 10M 酶标仪,帝肯(上海)贸易有限公司;Bruker Avance III 核磁共振光谱仪(NMR),德国Bruker AG 公司。
1.3 试验方法
1.3.1 抗性淀粉的制备 加蒸馏水调节豌豆淀粉质量分数为25%,25 ℃放置30 min。样品在95 ℃水浴处理30 min,冷却至25 ℃,40 ℃下超声处理(70 W)30 min 后,置于4 ℃冰箱老化24 h,取出25 ℃平衡1 h,105 ℃条件下干燥恒重,粉碎,过筛,即得PRS。
1.3.2 MP 的提取 参考陈金玉等[13]的方法,从冰箱取出冷冻不超过7 d 的鸡胸肉于4 ℃冰箱解冻12 h 后切碎剁成肉糜状,加入提前制备好预冷(4℃)的4 倍体积的蛋白提取液(0.2 mol/L MgCl2,0.1 mol/L NaCl,0.001 mol/L EDTA,0.1 mol/L Na2HPO4,pH=7.0),组织均质机15 000~19 000 r/min 匀浆3 min,离心(4 ℃,4 000 r/min,20 min),取沉淀,加蛋白提取液重复离心3 次,弃上清液留沉淀得粗蛋白,再向所得粗蛋白中加入提前制备好预冷的4 倍体积的0.1 mol/L NaCl 溶液盐洗,11 000 r/min 匀浆1 min,上述条件离心取沉淀,盐洗3 次后的沉淀即为MP,密封,4 ℃保存备用。以牛血清蛋白为标准蛋白,采用双缩脲法[14]测定蛋白质浓度,得到标准曲线方程为y=0.0437x +0.0011,R2=0.9994,式中,x 为蛋白质量浓度(mg/mL),y 为吸光度值。
1.3.3 磷酸化MP 的制备 将2%的焦磷酸钠(Sodium pyrophosphate,SPP)溶 于0.6 mol/L 的NaCl 溶液中,配制20,40 mg/mL 的MP 溶液,均质后25 ℃磁力搅拌反应2 h,将反应后的MP 溶液倒入透析袋中,用pH 值为7.5 的磷酸盐缓冲液4℃透析24 h 后拿出,即得磷酸化MP(SPPMP)。20 mg/mL 用于测定乳化稳定性、乳液消化性和流变性质,40 mg/mL 用于测定凝胶性质。
采用钼蓝比色法[15]测定蛋白磷酸化程度。得到标准曲线Y=0.0629X-0.0082,R2=0.9982,式中,X 为标准液磷酸根含量(mg),Y 为吸光度值。所得SPPMP 的磷酸化程度为102.42 mg/g。
1.3.431P NMR 分析 使用核磁共振对SPPMP样品(10 g/L)进行31P NMR 分析,工作频率为400 mHz。
1.3.5 乳液的制备 按体积比为大豆油∶SPPMP=1∶4(V/V)的比例将大豆油分别添加至1.3.3 节中制备的SPPMP(20,40 mg/mL)中,使用匀浆机在8 000 r/min 下匀浆3 min,即得SPPMP 乳液;按照此方法制备MP 乳液,备用。取SPPMP 乳液40 mL于小烧杯中,分别添加0%,2%,4%,6%的豌豆抗性淀粉(PRS),均 质(8 000 r/min,1 min)后得到SPPMP-PRS 复合乳液,备用。
1.3.6 乳液凝胶的制备 取1.3.5 节中的40 mg/mL 的MP、SPPMP-PRS 乳液置于水浴锅中,设置温度从25 ℃升至75 ℃,75 ℃下保持10 min,取出冷却后4 ℃条件下过夜,备用。进行功能性质分析前室温下平衡30 min。
1.3.7 乳液的乳化稳定性测定 参照Liu 等[16]的方法,用乳化指数(Creaming index,CI)来判断乳液稳定性。取1.3.5 节中的20 mg/mL 的MP、SPPMP-PRS 乳液5 mL 左右于10 mL 离心管中,盖紧管盖,室温静置24 h 后测定乳清(下层)高度Hs及乳液总高度Ht。CI 按式(1)计算:
1.3.8 乳液体外消化率 用人工唾液、人工胃液、人工肠液模拟体内环境,用体外消化的方式测定蛋白消化率。具体操作:将1.3.5 节的乳液真空冷冻干燥后,准确称量含500 mg 蛋白样品于测试管中,加入1 mL 人工唾液,摇晃15~20 s 后加入5 mL 人工胃液,混合物在37 ℃振荡水浴锅中温育30 min,随后加入25 mL 人工肠液,继续在37 ℃振荡水浴锅中温育。在0,30,60,90,120,180 min 分别取3 mL 水解液,沸水浴灭酶,用试剂盒测定其蛋白含量。按式(2)计算蛋白体外消化率:
1.3.9 乳液流变性质的测定
1.3.9.1 表观黏度 取适量1.3.5 节中20 mg/mL的乳液于Physica MCR 301 高级旋转流变仪的测定平台上,选取探头为PP 50,直径为25 mm 的锥板模具,温度恒定为25 ℃,测定样品在剪切速率γ从0~120 s-1递增过程中,表观黏度η 和剪切应力τ 的变化。
1.3.9.2 温度扫描 按照1.3.9.1 节的步骤放样,以τ:1 Pa,f:1 Hz,2 ℃/min 的升温速率从20 ℃升至80 ℃,记录乳液的储能模量(G′)以及tanδ 值在升温过程中的变化。
1.3.10 乳液凝胶特性的测定
1.3.1 0.1 质构特性和凝胶强度 取1.3.6 节中制备的乳液凝胶置于TA-XT Plus 型物性分析仪下测凝胶质构。选择测定程序为TPA 测试,测定参数如下:探头P/0.5,测前速度、测试速度、测后速度分别为1.0,0.5,1.0 mm/s,压缩比为50%,触发类型自动,触发力5.0 g。将仪器程序改为凝胶强度,测定样品的凝胶强度。平行3 次。
1.3.1 0.2 凝胶持水能力 取1.3.6 节中制备的乳液凝胶约8 mL 于10 mL 离心管中,以10 000 r/min 速度离心10 min,取沉淀称重。凝胶持水力按式(3)计算:
式中,M——离心管质量(g);M1——离心前离心管与凝胶总质量(g);M2——离心后离心管与凝胶总质量(g)。
1.4 数据处理
利用Excel 2010、WPS 2018 以 及Origin 2015 进行数据处理及绘图,通过SPSS 16.0 进行单因素比较显著性差异分析。
2 结果与分析
2.1 31P NMR 分析
图1 为MP 和SPPMP 的31P NMR 光谱。未经修饰的MP 没有检测到信号峰,然而SPPMP 在4.62 ppm 出现一个单峰。据文献报道,在4.6 ppm附近的峰是磷酸丝氨酸[17]。因此,结合SPPMP 的磷酸化程度测定结果(102.42 mg/g),该信号极有可能是由于SPP 与MP 之间形成了C-O-P 键(即-C-O-PO32),这与本课题组前期的研究结果一致[3,18]。
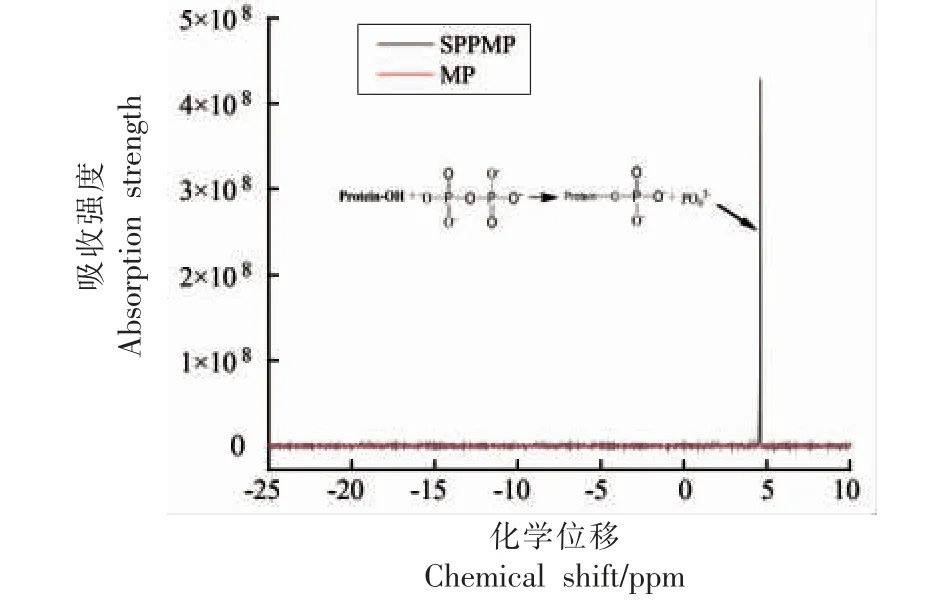
图1 31P NMR 光谱图Fig.1 31P NMR spectra
2.2 乳液的乳化稳定性分析
蛋白乳液的乳化稳定性用CI 来表征,CI 值越小,乳液越稳定[16]。各样品乳液的CI 见图2。由图2 可知,MP 乳液的CI 值(47.24%)大于SPPMP 乳液(21.00%),在SPPMP 乳液中添加PRS 后,复合体系的CI 值随PRS 添加量的增加而增大。表明磷酸化修饰可显著改善MP 乳液的乳化稳定性(P〈0.05),PRS 的存在则使蛋白乳液稳定性降低。磷酸化改性已被证实对蛋白的功能性质有改善作用[19]。盐离子浓度在0.6 mol/L 时,肌纤维横向扩展,MP 充分膨胀[20-21]。磷酸基团的附着增加了蛋白质分子的负电荷,使蛋白之间的静电斥力增大,更多的蛋白质分子吸附在油滴表面,维持乳液体系的稳定性[22]。PRS 填充到膨胀的蛋白内部使蛋白空间位阻增大,从而降低蛋白吸附到油滴表面的速率。此外,膨胀使蛋白间相互作用增强[20],吸附油滴的蛋白层加厚,再加上PRS 的填充,使乳液粒径增大,在储存过程中乳液分层,乳液稳定性降低。这种弱化效应随着PRS 添加量的增加(0~6%)而增强。

图2 不同处理的蛋白乳液乳化稳定性Fig.2 Emulsifying stability of protein emulsions with different treatments
2.3 体外消化率分析
肉蛋白是人类膳食优质蛋白的主要来源。肉蛋白的消化性直接影响肉制品的营养价值。图3a为在0~180 min 内经过不同处理的蛋白样品的体外消化率曲线。在初始0~60 min 内,各样品的体外消化率有较大差异。尤其是SPPMP-PRS 组的消化率明显低于MP 组,这可能与抗性淀粉的“填充效应”有关[23]。抗性淀粉填充到MP 形成的网络结构中,阻碍了蛋白酶的酶切位点,从而降低了体外消化率。随着豌豆抗性淀粉添加量的增加,蛋白网络内部空隙逐渐被填满,蛋白的酶结合位点进一步减少,消化率持续降低。然而,随着消化时间的延长(60~180 min),各组的体外消化率结果趋于接近。图3b 为在体外消化终点180 min 时的蛋白消化率。从图中可得到MP 组与SPPMP 组的最终消化率分别为81.82%和81.55%,二者无显著差异(P〉0.05)。这可能是由于磷酸基团的引入导致蛋白质分子间斥力增大,蛋白聚集速度变慢,因此,磷酸化修饰不影响蛋白酶的酶切效果以及最终的蛋白消化率。Matheis 等[24]的研究结果也表明经磷酸盐改性的酪蛋白消化率与天然蛋白相比无显著差异。Sánchez-Reséndiz 等[25]却发现三偏磷酸钠可提高大豆分离蛋白与花生分离蛋白的消化率。这可能与磷酸盐或蛋白的种类有关。此外,添加2%的豌豆抗性淀粉并没有显著改变蛋白的最终消化率(P〉0.05),继续增加抗性淀粉添加量(4%~6%)的蛋白样品的最终消化率虽然有所降低,但仍然保持了原始蛋白消化率的93%左右。这表明豌豆抗性淀粉协同磷酸化修饰对于蛋白的体外消化率并没有较大的影响。

图3 不同蛋白样品消化率变化(a)以及在180 min 的消化率(b)Fig.3 Changes of digestibility(a)and digestibility at 180 min(b)of protein samples
2.4 乳液静态流变分析
如图4a 所示,MP、SPPMP、SPPMP-PRS 乳液的表观黏度均随剪切速率的增加先急剧下降后趋于平稳,存在明显的剪切稀化现象。图4b 中各样品随剪切速率的增加应力增大。样品的表观黏度与剪切应力均有SPPMP-PRS〉SPPMP〉MP 的结果,且随豌豆抗性淀粉添加量的增加,表观黏度与剪切应力增大。

图4 不同处理的蛋白乳液表观黏度(a)和剪切应力(b)的变化Fig.4 Changes of apparent viscosity(a)and sheer stress(b)of protein emulsions under different treatments
使用Herschel-Bulkley 模型[26]:τ=τ0+κγn,对图4b 中各样品的剪切应力曲线进行拟合,结果见表1。式中,τ 为剪切应力;κ 为稠度系数,κ 值越高表明流体的黏度越高;γ 为剪切速率;n 为流动特征指数。当n〉1 时,流体呈剪切增稠现象,为胀塑性流体;当n=1 时为牛顿流体;n〈1 时,流体呈剪切稀化现象,为假塑性流体[27]。从表1 可知MP 的κ 值为0.036 Pa·s,经磷酸化修饰后,样品SPPMP的κ 值增加至0.071 Pa·s,黏度增大;进一步添加抗性淀粉,SPPMP-PRS 的κ 值随抗性淀粉添加量的增加而增大,与图4a 结果相对应。MP、SPPMP、SPPMP-PRS 的n 值均小于1,为假塑性流体。这表明磷酸化修饰和豌豆抗性淀粉的加入并没有改变MP 的流体类型。当豌豆抗性淀粉的添加量大于2%时,可明显增强磷酸化MP 乳液的剪切稳定性。
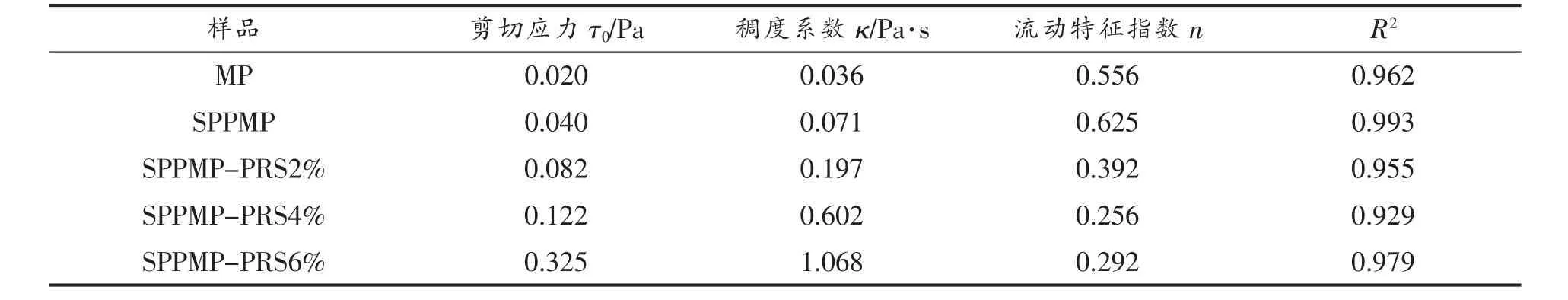
表1 不同处理对乳液流变曲线特征值的影响Table 1 Effects of treatments on characteristic values of rheological curves of emulsions
2.5 乳液动态流变分析
图5a 和图5b 分别为各样品在不同温度下扫描的储能模量G′与相变角tanδ 的变化曲线。G′值越高,tanδ 越小,表明蛋白凝胶弹性越好[28]。与MP相比,磷酸化修饰明显提高了最终G′。这可能是由于磷酸基团的引入增加了蛋白质的电负性和溶解度,另外,通过与MP 侧链氨基酸的-NH3+之间的离子相互作用进一步增强了蛋白质分子间的交联,从而促进热诱导过程中凝胶三维网络结构的形成[3,18]。此外,据报道,MP 的流变性质与淀粉添加量有关[23,29]。图4a 中随着豌豆抗性淀粉添加量的增加,SPPMP-PRS 的G′增强。在加热过程中,抗性淀粉促进了蛋白-蛋白相互作用而增强混合凝胶的黏弹性[30]。在67 ℃之后,MP 的变性达到一定的程度,此时磷酸基团和抗性淀粉的存在促进变性蛋白通过活性基团相互交联或聚集,形成稳定的三维网络结构弹性凝胶体。另外,蛋白乳液中的油滴可参与凝胶的形成,作为活性填充物增强乳液凝胶的强度[31]。在80 ℃时,各样品的G′有SPPMP-PRS〉SPPMP〉MP 的结果。这说明在热诱导凝胶形成过程中,豌豆抗性淀粉的添加能明显增强SPPMP 的凝胶网络结构。
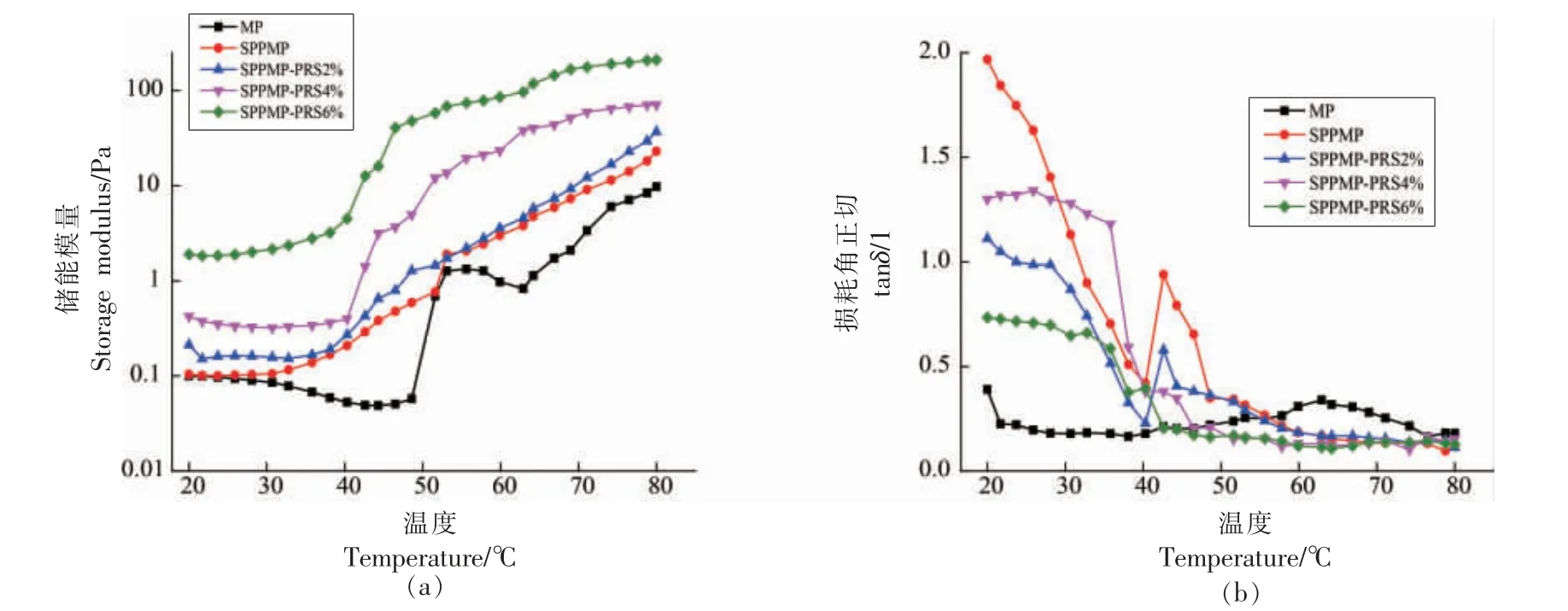
图5 不同处理的蛋白乳液G′(a)和tanδ(b)的变化Fig.5 Changes of G′(a)and tanδ(b)of protein emulsions under different treatments
tanδ 为损耗模量与贮能模量G′的比值,当tanδ 小于1 时,流体发生弹性形变,表现为弹性流体。从图5b 可知,随着温度的升高,MP 逐渐形成凝胶,各样品的tanδ 降低,在35 ℃之后tanδ 均小于1,表明MP、SPPMP 与SPPMP-PRS 均为弹性流体,在加热过程中形成了弹性凝胶。此外,在55℃以后,SPPMP 与SPPMP-PRS 的tanδ 均明显低于MP,这表明磷酸化修饰以及进一步添加豌豆抗性淀粉有利于弹性凝胶的形成,这与G′的结果一致。Fan 等[32]也得到类似的研究结果,即蛋白质与多糖间的相互作用会增强混合凝胶的结构。
2.6 乳液凝胶特性分析
2.6.1 凝胶质构 从表2 可知,SPPMP 较MP 凝胶的硬度、弹性、黏聚性、胶着度、咀嚼度、回复性分别增长了70.39%,20%,88.24%,219.20%,288.10%,190.91%。表明磷酸化修饰可明显增强MP 凝胶的质构特性。磷酸化修饰引入了带负电荷的磷酸基团,有利于热诱导形成均匀的蛋白质网络结构,从而将水分子和油滴禁锢其中,使凝胶硬度、弹性和咀嚼度等性质得到显著改善[33]。

表2 不同处理对蛋白乳液凝胶质构的影响Table 2 Effect of different treatments on texture of protein emulsion gel
在此基础上,进一步添加豌豆抗性淀粉,乳液凝胶的硬度、弹性、胶着度、咀嚼度继续增大。豌豆抗性淀粉的添加量为6%时,SPPMP-PRS 混合凝胶的硬度、胶着度与咀嚼度达到最大值分别为24.5 g,14.00,13.18,分别为SPPMP 凝胶的1.38,1.25,1.62 倍,为MP 凝胶的2.36,4.01,6.28 倍。这表明豌豆抗性淀粉能加强SPPMP 凝胶三维网络结构,且增强效果与抗性淀粉的添加量有关。Sarteshnizi 等[34]研究发现香肠的硬度与抗性淀粉的添加量呈正相关,并认为可能与抗性淀粉中的直链淀粉β 化有关。此外,Sun 等[29]也研究发现羟丙基木薯淀粉与木薯淀粉也可显著影响蛋白凝胶的硬度、弹性、咀嚼度等质构参数。这与本研究结果一致。
2.6.2 凝胶强度 图6 为不同处理的蛋白乳液的凝胶强度。从图中可看出,各样品凝胶强度有SPPMP-PRS〉SPPMP〉MP 的关系,且SPPMP-PRS的凝胶强度随PRS 添加的增加而增大。磷酸化修饰增强了MP 乳液体系的电负性,附着在蛋白质分子上的磷酸基团通过与相邻蛋白质分子之间的离子相互作用,使MP 彼此交联形成致密的网络结构,从而得到具有较高强度的弹性凝胶[35]。此外,磷酸化修饰也可能导致蛋白内部疏水基团暴露,这有利于活性基团在加热过程中通过疏水相互作用促进蛋白有序聚集,进而提高凝胶强度[22]。进一步添加PRS,SPPMP-PRS 的凝胶强度随PRS添加量的增加而增大。这可能是由于抗性淀粉作为填充物填充至蛋白质网络结构中[23],在加热过程中吸水膨胀,增强了凝胶网络结构的内部压力而使凝胶强度进一步增强[36]。这与动态流变学和凝胶质构结果一致。

图6 不同处理对蛋白乳液凝胶强度的影响Fig.6 Effect of different treatments on gel strength of protein emulsion
2.6.3 凝胶持水力 凝胶持水能力是评价肉糜产品的重要指标,各样品的凝胶持水力见图7。MP的凝胶持水力为47.14%,磷酸化修饰后,SPPMP的凝胶持水力较MP 增加了22.15%。豌豆抗性淀粉的加入进一步提高了凝胶持水力,且随抗性淀粉添加量的增加而增大,在添加量为6%时,达到最大值67.86%,较MP 组与SPPMP 组分别增加了43.95%和17.85%。这表明磷酸化修饰明显改善了MP 乳液凝胶的持水能力。一方面,磷酸基团具有很好的亲水性,每个磷酸基团可以结合5~6 个水分子[26];另一方面,蛋白凝胶结构越致密,持水力越强,因为稳定的三维网络结构可以将水分禁锢其中[37]。此外在0.6 mol/L 盐离子浓度下,MP 充分膨胀[20-21],此时豌豆抗性淀粉的“填充效应”使得蛋白质形成更加紧密的网络结构。另外,淀粉结构中的羟基具有较强的亲水性,在乳液凝胶形成过程中,会吸收更多的水分,最终提高凝胶的持水力[38]。随着抗性淀粉添加量的增加(2%~6%),越来越多的淀粉颗粒结合更多的水分子被束缚在MP 乳液凝胶网络的内部,呈现凝胶持水力显著增加的趋势(P〈0.05)。

图7 不同处理对蛋白乳液凝胶持水能力的影响Fig.7 Effect of different treatments on water holding capacity of protein emulsion gel
3 结论
磷酸化修饰可明显改善鸡胸肉MP 乳液的乳化稳定性、流变特性与凝胶性质。将豌豆抗性淀粉(2%~6%)添加至SPPMP 乳液中,不改变乳液的流体类型,形成了紧密均匀的弹性凝胶网络结构。随着豌豆抗性淀粉添加量的增加,SPPMP 乳液的表观黏度、剪切应力与G′均增大;此外,有利于加强乳液凝胶网络结构,凝胶硬度和弹性、凝胶强度、凝胶持水力均有所增强。磷酸化修饰并不影响MP乳液的体外消化率,进一步添加豌豆抗性淀粉,乳液的最终消化率虽然有所降低,但仍然保持了原始蛋白消化率的93.80%。因此,将抗性淀粉与磷酸化改性结合应用于肉制品加工中,在不明显影响肉蛋白营养价值的同时,还能协同提高肉蛋白的加工特性,具有广阔的应用前景。

