异柠檬酸脱氢酶-1 突变对胶质瘤血管生成的影响
阮建桥,王 晶,徐 辉,曹相玫
(1.宁夏医科大学,银川 750004;2.宁夏医科大学总医院病理科,宁夏医科大学第一临床医学院,银川 750004)
胶质瘤是一种异质性疾病,在成人恶性原发性脑肿瘤中常见,占比为70%,由于具有极强的侵袭性,故预后不佳[1]。根据肿瘤的侵袭性生物学行为以及不良预后将其分为Ⅰ~Ⅳ级,可以为胶质瘤的治疗方案提供指导[2]。异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH) 是参与许多重要代谢过程的关键酶,包括IDH-1、IDH-2、IDH-3亚型,其中IDH-1 突变导致α-酮戊二酸(α-ketoglutaric acid,α-KG)转化为2-羟基戊二酸(2-hydroxyglutarate,2-HG),其作为癌代谢物是胶质瘤发生的关键驱动因素[3]。在胶质瘤中,绝大多数IDH-1 突变导致组氨酸替代精氨酸(IDH-1 R132H),IDH-1 突变先于其他分子改变,是胶质瘤发病的早期表现,也是成人胶质瘤的重要鉴别因素,具有预后价值和作为药物靶点的潜力[4-5]。现阶段关于IDH-1 突变对胶质瘤的迁移及侵袭尚不明确。血管生成与胶质瘤快速生长、转移及侵袭密切相关。本研究检测胶质瘤组织中血管生成因子与IDH-1 之间的关系,同时利用强力霉素诱导表达突变型IDH-1 的人胶质瘤U87 细胞,观察其迁移能力,探讨其可能机制,为临床治疗提供参考依据。
1 材料与方法
1.1 主要材料
收集2020—2023 年宁夏医科大学总医院病理科胶质瘤病例198 例,男性112 例,女性86例;年龄≤20 岁者14 例,>20~≤40 岁者50 例,>40~≤60 岁者97 例,>60 岁者37 例。肿瘤分级:Ⅰ级胶质瘤8 例,Ⅱ级胶质瘤56 例,Ⅲ级胶质瘤39 例,Ⅳ级胶质瘤95 例。肿瘤部位:额叶22 例,颞叶39 例,其他部位137 例。实验使用强力霉素(doxycycline)诱导表达mutIDH-1(含IDH-1 R132H)的人脑胶质瘤细胞(U87 细胞)由空军军医大学叶菁教授馈赠,生长方式为贴壁生长,培养基为含1%双抗、10%血清的最低必需培养基(MEM)。
1.2 实验试剂
doxycycline 诱导表达体系:1) 含IDH -1 R132H 的慢病毒表达载体为Plvx -IDH -1(R132H);2)Tet -On 慢病毒表达载体为Plvx -Tet-On;3)doxycycline 诱导剂量为10 μg·μL-1。MEM 购于上海帝博思生物科技有限公司,LumiBest 卓越型电化学发光液(SB-WB011)购自上海圣尔生物科技有限公司,胎牛血清购于上海素尔生物科技有限公司,全蛋白提取试剂盒购于北京中杉金桥生物技术有限公司,IDH-1 一抗试剂(均为鼠单抗)、胶质原纤维酸性蛋白(GFAP)、血管内皮生长因子(VEGF)、CD34、Ki-67,通用型二抗、EDTA (pH 9.0) 修复液、DAB 显色液、PBS均购自北京中杉金桥生物技术有限公司;VEGFR-2 抗试剂(兔单抗)购于Bioworld Technology公司;抗体稀释液购自上海威奥生物科技有限公司;苏木素购自北京九州柏林生物科技有限公司;PAS 试剂盒购自北京索莱宝科技有限公司;SDS-PAGE 凝胶制备试剂盒购自南京凯基生物科技发展有限公司。
1.3 免疫组化法(immunohistochemistry,IHC)
胶质瘤组织常规石蜡切片3~4 μm,65 ℃烤片过夜,切片脱蜡至水,EDTA(pH 9.0)高压修复3 min,自然冷却,3% H2O2水溶液阻断内源性过氧化物酶8 min,PBS 溶液冲洗,加入一抗IDH-1、GFAP、Ki-67、VEGF(稀释比例1∶400)、VEGFR-2(稀释比例1∶250)、CD34(稀释比例1∶200),37 ℃恒温箱孵育70 min,PBS 溶液冲洗,加入二抗,37 ℃恒温箱孵育30 min,PBS 溶液冲洗,DAB 显色10 min,流水冲洗阻断显色,苏木素滴染1 min,水洗,1%盐酸乙醇分化3 s,水洗,淡氨水返蓝数秒,水洗,梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.4 PAS、CD34 双重染色
CD34 进行1.3 中的IHC 检测步骤至DAB显色,水洗,加入过碘酸氧化5~10 min;流水冲洗5~10 min;滴加雪夫试剂10~15 min;流水冲洗10~15 min;苏木素复染1 min,水洗,1%盐酸乙醇分化3 s,流水冲洗返蓝,梯度乙醇脱水,二甲苯透明,脱色中性树胶封片。
1.5 胶质瘤组织IHC 及特殊染色结果判读标准
1)IDH-1、VEGF、VEGFR-2 在细胞质有棕黄色产物形成时判读为阳性,细胞质无显色则为阴性;CD34、GFAP 在细胞膜有棕黄色产物时判读为阳性,细胞膜无显色则为阴性,均采用半定量法进行判读。每张切片随机选取5 个高倍镜(×400)视野,每个视野计数细胞100 个,首先计算阳性染色细胞数占总细胞数的比例,无阳性染色细胞为0 分,阳性细胞数≤10%为1 分,阳性细胞数11%~50%为2 分,阳性细胞数51%~75%为3 分,阳性细胞数>75%为4 分。同时评判染色深浅,无色为0 分,浅黄色为1 分,棕黄色为2 分,棕褐色为3 分,染色强度依据背景着色进行对比。根据两项计分相加所得总分进行结果判定。0~2 分为阴性(-),3~4 分为弱阳性(+或++),>4分为强阳性(+++)[6],阳性率=(强阳性例数÷总例数)×100%。2)Ki-67 指数代表肿瘤细胞的增殖活性,指数≤10%判读为低表达,指数>10%判读为高表达[7]。3)CD34 染色检测胶质瘤中的内皮细胞,PAS 染色检测肿瘤血管的基底膜。CD34 染色表达于内皮细胞,呈棕黄色;PAS 标记血管基底膜,管腔基底膜呈玫红色。高倍镜下CD34 阴性、PAS 阳性管道样结构,即为血管生成拟态(vasculogenic mimicry,VM)[8]。
1.6 细胞培养及doxycycline 诱导
用含1%双抗、10%血清的MEM 培养液进行U87 细胞培养。细胞隔天换液。将培养瓶中生长至90%密度的胶质瘤U87 细胞消化、计数,在直径10 cm 的细胞培养皿中接种1×106个细胞。接种8 h 后待细胞贴壁。实验分组为doxycycline 诱导表达组(dox+组)和非doxycycline 诱导表达组(dox-组),dox+组为完全培养基含doxycycline(10 μg·μL-1)培养;dox-组为完全培养基培养。培养48 h 后取出至显微镜下观察诱导效率。
1.7 Western blot 检测U87 细胞内IDH-1、VEGF、VEGFR-2 的表达
U87 细胞诱导48 h 后,收集细胞沉淀提取全蛋白。配制SDS-PAGE 凝胶,上样等量蛋白进行电泳,湿转蛋白至PVDF 膜上。10%脱脂牛奶室温封闭1.5 h 后用抗体稀释液稀释一抗(VEGF 1∶400、VEGFR-2 1∶250)4 ℃孵育过夜。二抗(1∶2 000)室温孵育1.5 h,化学发光试剂显色1 min 后曝光并进行灰度测量[9]。
1.8 细胞划痕实验检测U87 细胞迁移能力
六孔板背面画“十”字,每孔加入约5×105个细胞,每组设置2 个复孔,重复进行3 次。过夜后细胞贴壁且密度达到80%~90%,用200 μL 枪头在六孔板背后的“十”字进行画线。用PBS 冲洗划起的细胞,在同一区域记录采集0、24 和48 h 的划痕范围照片[10]。用Image J 软件测量划痕区域的面积,分析细胞的迁移速度,采用细胞划痕愈合率比较细胞的迁移能力。细胞划痕愈合率=[(0 h划痕面积-观察时间点划痕面积)÷0 h 划痕面积]×100%。
1.9 统计学方法
采用SPSS 26.0 统计学软件进行数据分析,计数资料用例表示,两组间比较采用卡方检验;计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t 法,各独立实验均重复3 次。P≤0.05 为差异有统计学意义。
2 结果
2.1 IDH-1 突变胶质瘤患者临床病理特征
胶质瘤组织IDH-1 蛋白阳性表达与年龄、性别、部位及组织分级均无相关性(P>0.05);Ki-67 增殖指数与患者性别及病理分级存在关联:高表达在男性患者中表达率高(P<0.05),低表达在女性患者中多见(P<0.05),高表达在高级别胶质瘤(Ⅲ、Ⅳ级)中表达率高于低级别胶质瘤(Ⅰ、Ⅱ级);GFAP 在低级别胶质瘤(Ⅰ、Ⅱ级)中阳性率为36.53%(61/167),在高级别胶质瘤(Ⅲ、Ⅳ级)中阳性率为63.47%(106/167),在低级别胶质瘤中阳性率低于高级别胶质瘤(P<0.05),见表1。
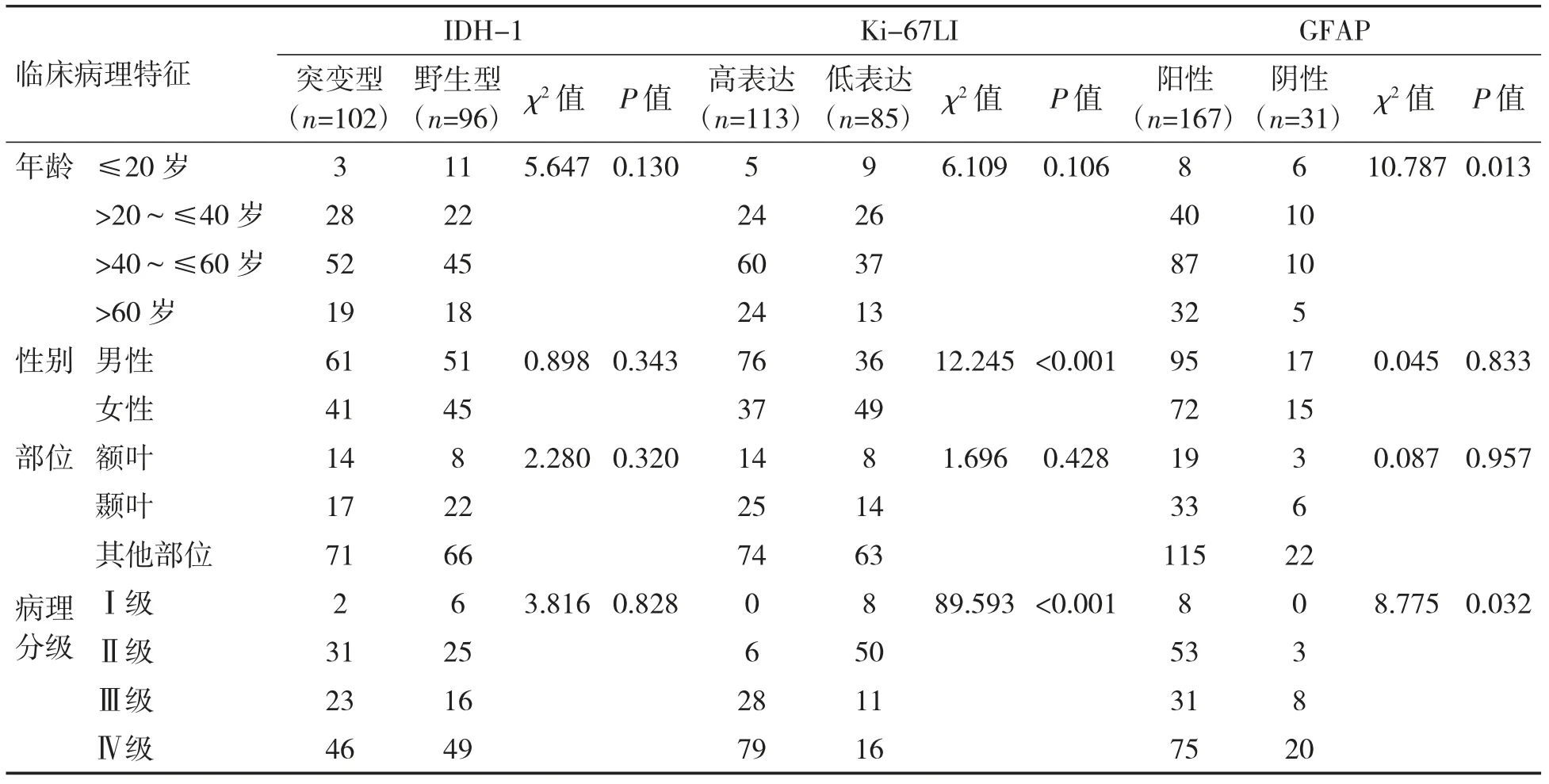
表1 胶质瘤组织IDH-1、Ki-67 及GFAP 表达与患者临床病理特征的关系(例)
2.2 胶质瘤组织HE 染色结果
经HE 染色后确定分级,Ⅰ级胶质瘤8 例,Ⅱ级胶质瘤56 例,Ⅲ级胶质瘤39 例,Ⅳ级胶质瘤95 例,其中以Ⅱ、Ⅲ级、Ⅳ级胶质瘤常见,见图1。
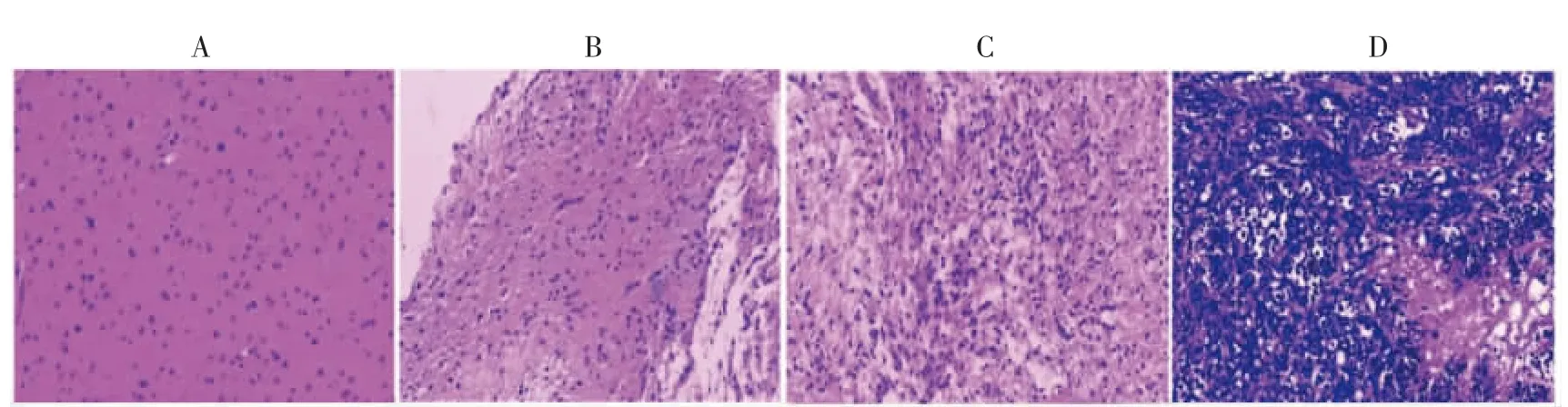
图1 Ⅰ、Ⅱ、Ⅲ级、Ⅳ级胶质瘤HE 染色(×200)
2.3 胶质瘤组织中IDH-1 与Ki-67、GFAP 的关系
胶质瘤组织IHC 结果显示,Ki-67 高表达在突变型胶质瘤中表达率为56.86%(58/102),野生型胶质瘤中为57.29%(55/96)。Ki-67 高表达、低表达在突变型和野生型胶质瘤中差异无统计学意义(P>0.05);GFAP 在突变型胶质瘤中阳性表达率为92.16%(94/102),野生型中为76.04%(73/96),与野生型相比,GFAP 在突变型中高表达(P<0.05),见表2、图2。
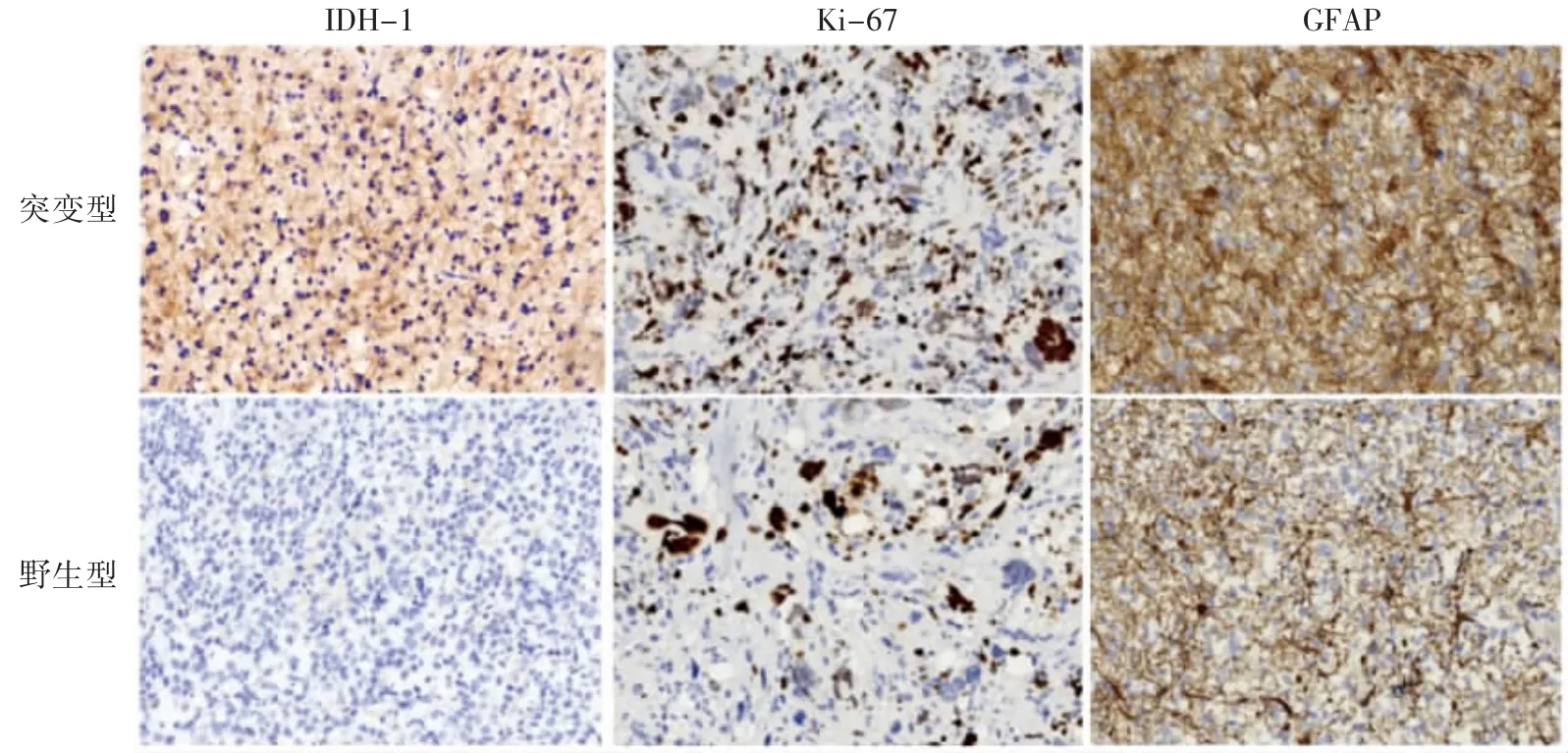
图2 胶质瘤组织IDH-1、Ki-67、GFAP 的表达(×200)

表2 胶质瘤组织Ki-67、GFAP 表达与IDH-1 突变的关系(例)
2.4 胶质瘤组织中CD34、VEGF 与VEGFR-2 的表达
在IDH-1 突变型中,VEGF 阳性表达率为70.59%(72/102),VEGFR-2 为73.63%(75/102),CD34 为68.63%(70/102);在IDH-1 野生型中,VEGF 阳性表达率为54.17%(52/96),VEGFR-2为59.38%(57/96),CD34 为51.04%(49/96);VEGF、VEGFR-2、CD34 在IDH-1 突变型中的表达均高于IDH-1 野生型(P 均<0.05),见图3。
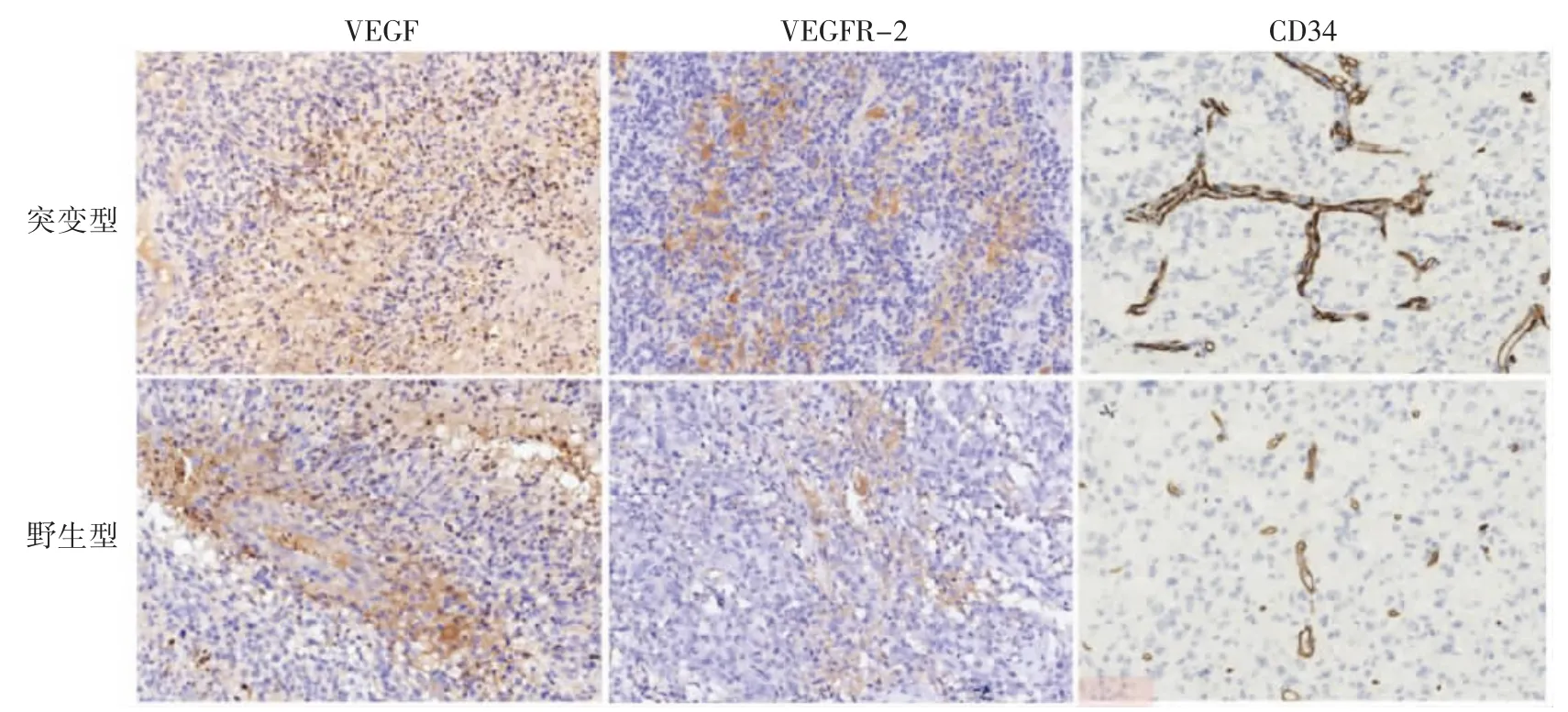
图3 胶质瘤组织中VEGF 与VEGFR-2、CD34 的表达(IHC×200)
2.5 IDH-1 突变胶质瘤的VM
PAS-CD34 双染胶质瘤组织显示,血管内壁CD34 染色呈阳性,基底膜呈玫红色,为肿瘤血管成分(VM 阴性);由胶质瘤细胞形成的不规则管腔样结构,CD34 染色呈阴性,基底膜不完整,PAS 呈阳性管道样结构(VM 阳性)。VM 在突变型以及野生型中均有表达,见图4。

图4 PAS-CD34 双染检测胶质瘤组织中的VM 形成(×400)
2.6 IDH-1 突变改变U87 细胞中VEGF、VEGFR-2 蛋白的表达水平
Western blot 检测结果显示,与dox-组相比,dox+组的VEGF、VEGFR-2 蛋白表达均增高,与IHC 结果一致(P 均<0.05),见图5。

图5 Western blot 检测dox-组和dox+组U87 细胞IDH-1、VEGF、VEGFR-2 相对蛋白的表达水平
2.7 IDH-1 突变对U87 细胞迁移能力的影响
细胞划痕实验结果显示,在24、48 h 中dox+组的细胞划痕愈合率均高于dox-组(P 均<0.05),见图6。

图6 细胞划痕实验检测IDH-1 突变对U87 细胞迁移能力的影响
3 讨论
胶质瘤是颅内最常见恶性肿瘤之一,由中枢神经系统中的胶质细胞/胶质祖细胞发展而来[11],最大程度手术安全切除、放疗、化疗、免疫疗法以及相关联合治疗可以提高胶质瘤患者的预后,但是胶质瘤的极高致死率、预后效果不佳、复发率高是患者生存率极低的主要因素[12]。IDH-1 突变在Ⅱ级、Ⅲ级胶质瘤中常见,90%发生在Ⅱ级胶质瘤中,60%发生在Ⅲ级胶质瘤中,同时在继发性胶质瘤中也很常见[13]。有研究[14]报道,IDH-1 突变会导致2HG 堆积过多并抑制多种酶的功能以及多种依赖于α-KG 的染色质重塑酶,从而影响肿瘤代谢循环过程。在本实验中发现,IDH-1 突变与患者年龄、性别、发病部位、病理级别均无关联。细胞划痕实验中,dox+组的U87 细胞在24、48 h划痕面积高于dox-组,证实IDH-1 突变使细胞的迁移能力增强,从而增加肿瘤的迁移。Ki-67 是一种仅在细胞周期G1、S、G2 或M 期中期的细胞表达核心抗原,正常脑组织中几乎不表达,Ki-67标记指数10%是区分低级别和高级别胶质瘤的临界点,对预测患者的生存具有重要意义[15]。本研究结果显示,Ki-67 高表达在男性患者中表达率高,低表达在女性患者中多见,在高级别胶质瘤(Ⅲ、Ⅳ级)中表达率高,在突变型和野生型胶质瘤中表达差异无统计学意义,这一结果与肿瘤级别越高,恶性程度越高、侵袭性越强一致。GFAP 是胶质瘤标志性的一种中间丝蛋白,几乎只在星形细胞胶质瘤中表达,易受细胞环境的影响,与肿瘤的迁移息息相关[16]。本实验发现,GFAP在突变型中高表达,在高级别胶质瘤中表达增高,这与Priambada 等[17]关于少突胶质细胞分化和IDH-1 野生型弥漫性星形细胞瘤中GFAP 表达降低的研究结果一致,考虑GFAP 与胶质瘤的侵袭性及预后有关。
在许多恶性肿瘤的治疗方案中,抗血管治疗至关重要。VEGF 是参与血管生成的重要因子,胶质瘤细胞在缺氧情况下,VEGF 与其受体VEGFR-2 的下游信号通路被缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)激活,同时血管内皮细胞增殖、迁移,由肿瘤细胞形成不规则管状结构,形成新生血管[18]。本实验发现,VEGF、VEGFR-2、CD34 在突变型中高表达,同时Western blot 检测显示,dox+组中VEGF、VEGFR-2 表达升高,两项结果提示IDH-1 发生突变,降低HIF-1α 表达水平,使VEGF 过表达,促进新生血管生成,VEGF 过表达与胶质瘤预后不良相关[19],因此,临床通过抗VEGF 治疗增加无进展生存期并改善胶质瘤患者的生活质量。VM 在肿瘤血管形成中具有很高的可塑性,在微血管密度较低的胶质瘤区域大量存在,完成肿瘤生长过程中的血氧供应[20]。在双染实验中,CD34 染色阴性、PAS染色阳性的胶质瘤细胞形成的管状结构,即VM阳性。VM 在突变型及野生型中均表达,证实胶质瘤通过血管生成,促进肿瘤转移、侵袭。VM 在高级别胶质瘤中高表达,更易形成微血管,使胶质瘤细胞逃脱缺氧的环境及坏死区域,具有较强的侵袭性,导致患者的治疗效果及预后均不佳[21]。
本实验通过组织及细胞水平探讨IDH-1 突变与胶质瘤血管生成的关系,进一步证实IDH-1突变在胶质瘤中具有至关重要的作用,一种是IDH-1 突变,2HG 大量堆积,抑制HIF-1α,诱导VEGF 表达,促进血管生成,增强胶质瘤侵袭及转移能力[22];另一种是IDH-1 突变过表达可以减少胶质瘤细胞增殖,使发生IDH-1 突变的胶质瘤患者预后更好[23]。本实验通过了解血管生成的机制及其抑制在胶质瘤治疗中的意义,为今后临床胶质瘤的抗血管治疗提供新的理论依据。

