NF-κB/P65 在食管鳞癌细胞和肿瘤浸润淋巴细胞中表达的临床病理意义
王瑞肖,潘小丽,张宁妹,陈晓珍,江海峰,黄凌燕
(宁夏医科大学总医院病理科,宁夏医科大学第一临床医学院,银川 750004)
食管癌是常见的消化系统恶性肿瘤之一,2020 年我国新发食管癌病例32.4 万,死亡病例30.1 万[1]。食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC) 是食管癌最常见的组织学类型,由于其发病隐匿,发现时多为进展期,5 年生存率不到25%[2]。ESCC 的侵袭性与癌细胞增殖、转移、去分化、上皮间质转化等多个生物学功能密切相关。另外,肿瘤微环境,尤其是肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs)对癌症作用已引起学者们的广泛关注,TILs 对癌症存在双向作用,一方面免疫细胞具有杀伤癌细胞的功能,另一方面肿瘤细胞对免疫细胞具有免疫逃逸的能力[3],可能增强ESCC 的侵袭能力。在癌细胞和TILs 中共同表达的作用因子分别通过哪些生物学功能影响ESCC 的侵袭能力有待研究,NF-κB/P65 是NF-κB 家族的经典成员之一,在癌细胞和TILs 中均有表达,但其分别在ESCC 和TILs 中的表达对于ESCC 发病机制和预后方面的研究还不清楚,因此,本研究探讨NF-κB/P65 分别在ESCC 癌细胞和TILs 中的表达对患者预后的意义。
1 资料与方法
1.1 资料收集
回顾性分析宁夏医科大学总医院2007—2012 年的ESCC 患者基本临床病理资料80 例,包括性别、年龄、癌症大小、分化程度、淋巴结转移情况等。1)纳入标准:所有患者术前均未接受放化疗,病理诊断类型为ESCC,病理分期1~3期,均行R0 根治性切除。2)排除标准:临床病理及随访资料不完整,术后生存时间小于3 个月,远处转移。病理诊断标准参照世界卫生组织(WHO)第五版,肿瘤临床分期参照美国癌症联合会(AJCC)第八版[4]。
1.2 免疫组化法检测ESCC 中NF-κB/P65 表达
收集ESCC 组织及周围正常食管组织,10%中性缓冲甲醛固定24 h,石蜡包埋切片,HE 染色。免疫组化切片用EDTA(pH=8.0)煮沸5 min,过氧化氢封闭10 min,加入NF-κB/P65 一抗(1∶100,D14E12,美国CST 公司)4 ℃孵育过夜,二抗室温孵育30 min,DAB 显色。NF-κB/P65 阳性染色在细胞核和(或)细胞质中。阳性对照为抗体公司赠送的阳性切片,阴性对照为PBS 代替一抗。免疫组化染色结果由两位高年资病理医师进行显微镜下判读。1)有丝分裂象计数:在高倍显微镜下,观察NF-κB/P65 在癌细胞、正常上皮细胞、TILs 中的阳性表达率。计算10 个高倍镜的阳性表达率并取平均值。在高倍镜下计数癌细胞有丝分裂象,随机选取10 个高倍镜下计数并计算总和。2)TILs 判读:在ESCC 癌内和癌周均可见TILs,癌内TILs 是计算间质中淋巴细胞占间质的百分比;对于癌周TILs 则计算癌周1 mm 内间质中的淋巴细胞所占百分比,随机选取10 个高倍镜计算后,取平均值。
1.3 生物信息分析
癌症基因组图谱(the cancer genome atlas,TCGA)数据库涵盖ESCC(n=82)和正常者(n=145)。利用TCGA 数据库分析NF-κB/P65 在人ESCC 中的表达水平。利用TCGA 数据集分析NF-κB/P65 的RNA 测序表达作用。
1.4 统计学方法
数据采用SPSS 23.0 统计学软件进行分析,计量资料以均数±标准误(Mean±SEM)表示。两组比较采用Mann-Whitney U 检验,3 组及以上组间比较采用单因素方差分析(ANOVA),相关性采用pearson 相关分析,患者预后采用Kaplan Meier 生存分析。P≤0.05 为差异有统计学意义。
2 结果
2.1 一般资料
回顾性收集80 例食管鳞癌病例,男性65例,女性15 例;年龄41~72 岁,中位年龄57 岁。年龄<60 岁者ESCC 癌细胞中NF-κB/P65 表达的阳性率比年龄≥60 岁者高(P<0.05);不同年龄组间在性别、血型、饮酒史、吸烟史、基础疾病、肿瘤位置方面差异均无统计学意义(P 均>0.05),见表1。
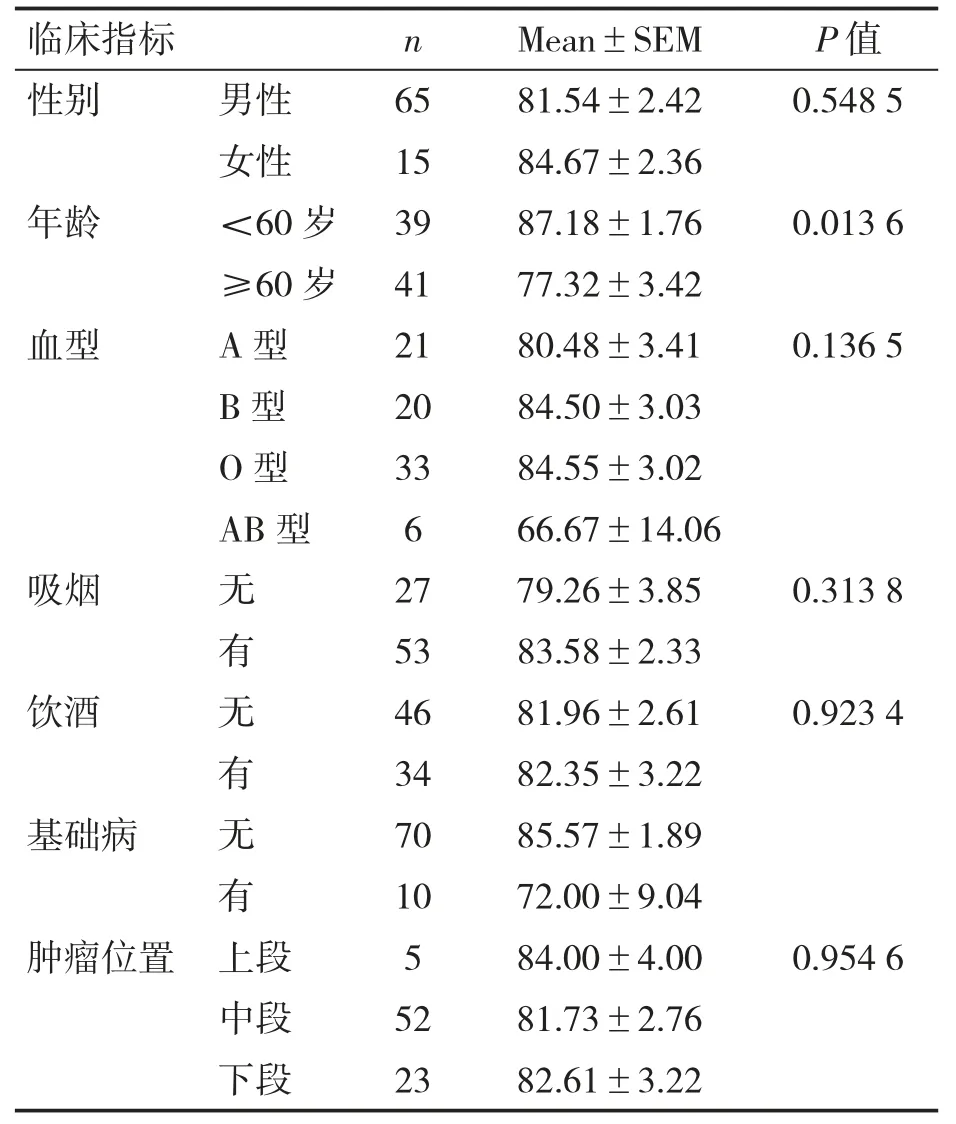
表1 ESCC 癌细胞中NF-κB/P65 阳性表达率临床特征的关系
2.2 ESCC 中NF-κB/P65 的阳性率表达情况
免疫组化检测结果显示,NF-κB/P65 在周围正常鳞状上皮中少量弱表达,在原位鳞癌和浸润性鳞癌中弥漫强阳性表达,在正常鳞状上皮中NF-κB/P65 阳性表达率[(11.59±2.56)%]均低于原位鳞癌[(81.79±2.57)%]和浸润性鳞癌[(84.14±1.77)%](P<0.05),见图1。

图1 NF-κB/P65 在ESCC 细胞中的表达情况
2.3 癌细胞中NF-κB/P65 高表达可能促进ESCC 进展
ESCC 进展与癌组织分化程度、临床分期、淋巴结转移、细胞分裂等因素相关。鳞状细胞癌从分化程度而言,非角化型鳞癌比角化型鳞癌分化更差,NF-κB/P65 在非角化型鳞癌中的阳性表达率为(86.68±1.78)%,而角化型鳞癌为(75.63±14.28)%,非角化型鳞癌高于非角化型鳞癌(P<0.05),见图2A~图2C,NF-κB/P65 阳性表达率升高与ESCC 分化更差有关。NF-κB/P65 在ESCC中的表达与核分裂象呈正相关(r=0.26,P=0.022),见图2D。NF-κB/P65 阳性表达率在临床分期、淋巴结转移与否之间差异无统计学意义(P>0.05),与癌灶大小、淋巴结转移数目均无相关性(P 均>0.05)。
2.4 癌细胞中NF-κB/P65 高表达患者预后差
随访80 例ESCC 患者,总生存期为4~162个月,按照癌细胞内NF -κB/P65 阳性表达率<80%和≥80%分为NF-κB/P65 高表达组和低表达组,NF-κB/P65 高表达组生存期为4~162 个月,中位生存期为(65.00±17.40)个月,平均生存期为(68.39±6.44)个月;NF-κB/P65 低表达组生存期为8~156 月,中位生存期为(106.00±8.39)个月,平均生存期为(102.451±10.23)个月,癌细胞NF-κB/P65 高表达组生存期短于NF-κB/P65 低表达组(P<0.05),见图3。
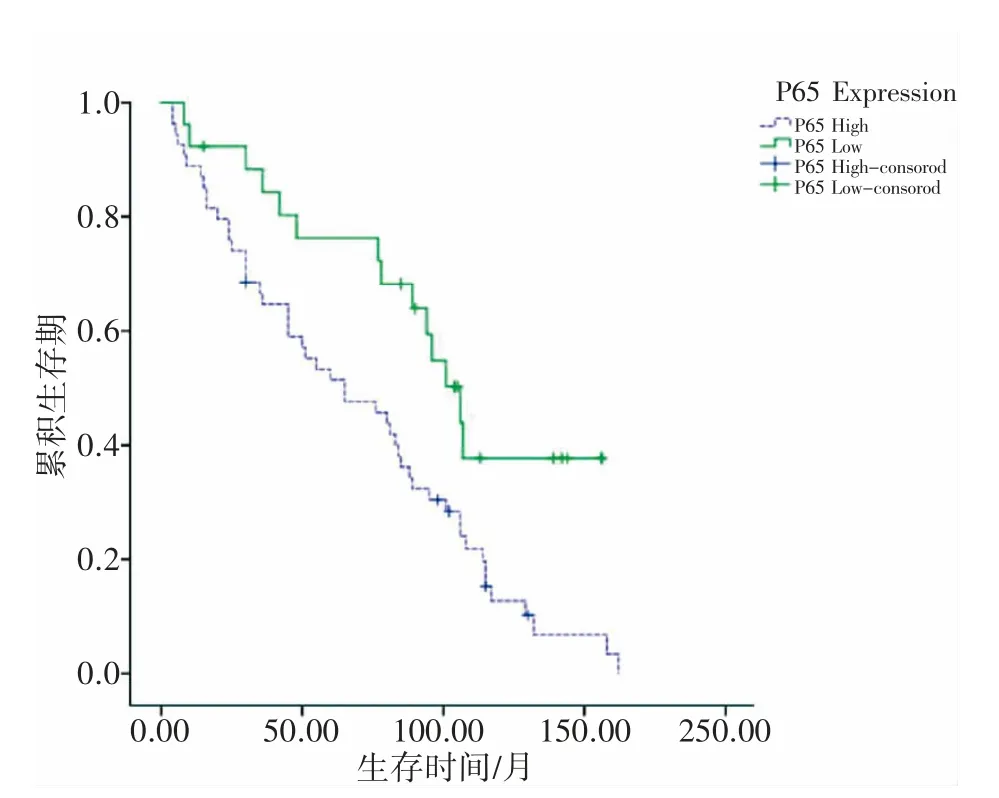
图3 ESCC 癌细胞中NF-κB/P65 的表达情况
2.5 肿瘤内TILs 在ESCC 中的作用
ESCC 癌内间质中TILs 的表达量,最低为5%,最高为80%,平均为32.96%。癌内间质中TILs 的表达量在临床1 期(42.78±4.41)时最高,高于临床2 期(30±2.74)、3 期(31.3±3.15),(P均<0.05)。另外,ESCC 间质中TILs的量与癌灶大小呈负相关(r=0.24,P=0.036),说明随着癌灶体积的增大,癌组织内间质中TILs 的量变少。ESCC 中,TILs 在正常鳞状上皮和ESCC、角化型和非角化型鳞癌、有无淋巴结转移之间差异均无统计学意义(P 均>0.05),与有丝分裂数无相关性(P>0.05),与患者生存期的长短差异无统计学意义(P>0.05),见图4。
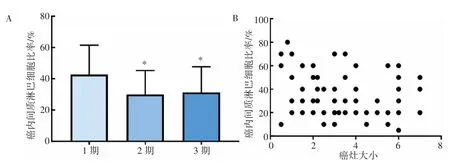
图4 肿瘤内TILs 在ESCC 中的作用
2.6 ESCC 中NF-κB/P65 在TILs 中表达的作用
分析P65 在癌内和癌周TILs 中的表达对ESCC 侵袭能力的影响和患者预后的意义。免疫组化结果显示,癌内TILs 中NF-κB/P65 的阳性表达率与癌内TILs 的量呈正相关(r=0.55,P<0.001),癌内TILs 的量越多,癌内TILs 中NF-κB/P65 的阳性表达率越高。按照NF-κB/P65 在癌内TILs的阳性表达率<30%和≥30%分为低表达组和高表达组,结果显示,高表达组患者预后高于低表达组(χ2=4.293,P=0.038),说明NF-κB/P65 在癌内TILs 中阳性表达率越高,患者生存期越长。对于癌周TILs 中NF-κB/P65 的表达,结果显示,癌周TILs 的量与癌周TILs 中NF-κB/P65 的阳性表达率呈正相关(r=0.316,P<0.05),表明癌周TILs的量越多,癌周TILs 中NF-κB/P65 的阳性表达率越高。检测NF-κB/P65 在癌内和癌周TILs 表达的差异性,结果显示,NF-κB/P65 在癌周TILs的阳性率为(52.09±2.71)%,癌内TILs 的阳性率为(34.88±2.61)%,癌周TILs 的阳性率高于癌内TILs 的阳性率(P<0.001)。另外,NF-κB/P65 在浸润性癌TILs 的阳性率为(51.20±2.77)%,原位癌为(70.00±2.36)%,浸润性癌TILs 的阳性率低于在原位癌TILs 的阳性率(P=0.009 1)。生存分析结果显示,将NF-κB/P65在癌周TILs 阳性表达率<30%和≥30%分为低表达组和高表达组,高表达组存活率高于低表达组(χ2=7.064,P=0.008),见图5。
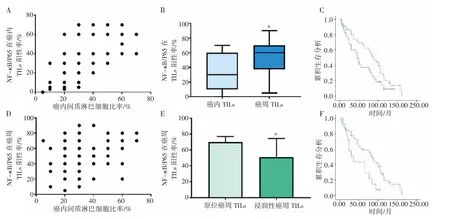
图5 ESCC 中NF-κB/P65 在TILs 表达的作用
2.7 生物信息分析ESCC 中NF-κB/P65 的功能
通过TCGA 数据库对NF-κB/P65 与癌症的形成和进展,以及对TILs 相关因子进行功能分析,结果显示,ESCC 中NF-κB/P65 表达与DNA修复、上皮间质转化、基质形成呈正相关(P<0.05),与炎性反应和IL-10 信号通路均呈正相关(P<0.05),与T 淋巴细胞表达呈负相关(P<0.05),见图6。

图6 ESCC 中NF-κB/P65 功能分析
3 讨论
NF-κB/P65 作为一个经典的炎症因子可以诱导细胞增殖[5]。与结肠炎相关癌症和肝炎相关癌症小鼠模型均表明NF-κB/P65 可能通过TILs促进癌症的发生[6-7]。
本研究检测NF-κB/P65 在ESCC 细胞中的表达情况,结果显示,NF-κB/P65 在原位鳞癌和浸润性鳞癌中的表达均高于正常鳞状上皮细胞,表明NF-κB/P65 可能参与了ESCC 的发生。就癌组织分化程度而言,NF-κB/P65 在非角化型鳞癌细胞中的表达高于角化型鳞癌,表明NF-κB/P65可能参与了ESCC 去分化。癌细胞NF-κB/P65 阳性表达率与有丝分裂象数量呈正相关,说明NFκB/P65 促进了ESCC 细胞分裂与增殖,导致癌细胞生长加快,有研究[8]表明,NF-κB/P65 可能通过ADAM17 的持续激活导致ESCC 细胞活力增强、凋亡减少。Shi 等[9]的研究也显示P65 可促进ESCC的增殖。癌细胞中NF-κB/P65 高表达患者的生存率明显比低表达的低,这些结果说明,NF-κB/P65可能通过促进癌细胞去分化和增殖来促进ESCC进展,导致患者生存性差[10]。生物信息学分析结果也表明,NF-κB/P65 可能通过与DNA 修复、上皮间质转化及肿瘤基质的作用促进ESCC 的发生和进展。Han 等[11]的研究也表明NF-κB/P65 作为ESCC 中重要的信号通路,可以通过对SFE 的作用抑制ESCC 的进展。
ESCC 中,癌内TILs 的百分比在临床1 期患者中明显高于临床2、3 期患者,且与癌灶大小呈负相关,说明在ESCC 初期招募TILs 使其数量增多,随着临床分期的增高、癌灶增大,TILs 的量逐渐减少,但是TILs 量的多少与患者预后长短差异无统计学意义,与Jiang 等[12]和Sudo 等[13]的研究结果相似。本研究结果表明,ESCC 中癌内和癌周中NF-κB/P65 在TILs 的表达均与TILs 的量呈正相关,TILs 所占间质百分比越高,其内NFκB/P65 表达的阳性率越高,Millen 等[14]在结直肠癌和Vecchio 等[15]在恶性黑色素瘤中的研究结果均与本研究一致。另外,NF-κB/P65 在癌周TILs的阳性表达率高于癌内TILs,且癌周TILs 中NF-κB/P65 的阳性表达率在原位癌高于浸润性癌,生存分析结果显示,癌内和癌周TILs 中NFκB/P65 阳性表达率越高,患者预后越好。这些结果表明,NF-κB/P65 在TILs 中的作用对ESCC 进展具有一定的抑制作用,癌周TILs 中NF-κB/P65 的作用比癌内TILs 中更强,随着从原位鳞癌向浸润性鳞癌进展,癌周TILs 中,NF-κB/P65 对ESCC 的保护作用逐渐变弱。通过生物信息分析,NF-κB/P65 在ESCC 中TILs 的表达可能通过与炎性反应、T 淋巴细胞和IL-10 抗炎症信号通路的作用,对ESCC 进展具有抑制作用。Zhang 等[16]的研究表明,在结肠癌中,Agpat4/LPA 通过巨噬细胞对NF-κB/P65 的作用调节抗肿瘤反应。
ESCC 中NF-κB/P65 的作用复杂,其在癌细胞和TILs 中表达可能通过不同的下游作用因子发挥作用,对ESCC 进展和患者预后的影响也具有明显差异性。NF-κB/P65 在ESCC 细胞中高表达,对ESCC 的发生和侵袭能力增强可能具有促进作用,NF-κB/P65 阳性率越高,患者预后越差,相关的研究表明,TNF-α 刺激NF-κB/P65 通路上调SLC52A3 的转录,导致癌细胞增殖和集落能力增强,最终使患者预后差[17]。TILs 在ESCC 初期作用更强,随着ESCC 进展,癌灶越大,TILs 作用越小。ESCC 中TILs 的量越多,NF-κB/P65 阳性表达率也越高,且癌周TILs 中NF-κB/P65 阳性表达率更明显,NF-κB/P65 在癌内和癌周TILs中表达越高,患者预后越好。NF-κB/P65 在TILs的表达可能对ESCC 具有一定抑制作用,相似的研究表明,PD-1/PD-L1 信号通过NF-κB/P65 上调淋巴上皮中VCAM-1 的表达,阻断高度脆弱的Treg 和Teffs 向引流淋巴结的肿瘤出口,促进肿瘤消退[18]。总之,NF-κB/P65 在ESCC 细胞中呈现癌基因的潜在功能比较明显,但其在TILs 中的作用可能是机体免疫能力的反映,对ESCC 的进展和预后具有保护作用,其具体的作用机制尚需广泛深入研究。

