干扰FoxO1 慢病毒包装及稳转大鼠骨髓间充质干细胞株的建立
徐海瑾,徐 彧,孔 斌,李 雄,李建宁,李 卉,曹婷婷,宋 辉
(1.宁夏医科大学基础医学院,银川 750004;2.宁夏医科大学内分泌学研究所,银川 750004;3.宁夏回族自治区人民医院胸外科,宁夏医科大学第三临床医学院,银川 750004)
1 型糖尿病(type 1 diabetes mellitus,T1DM)和2 型糖尿病(type 2 diabetes mellitus,T2DM)的发病机制不同,但患者都会出现胰岛功能衰竭[1-2]。胰岛移植已被证明能够修复糖尿病患者的胰岛功能,但由于异体移植免疫排斥反应和胰岛供体资源的不足而不能满足患者的需求[3]。BMSCs 具有广泛的增殖和分化潜能,在体外能诱导分化为胰岛素分泌细胞(IPCs),解决了供体胰岛短缺的问题,为细胞替代治疗提供了新的途径[4]。叉头状转录因子O1(forkhead box protein O1,FoxO1)在进化上高度保守,在哺乳动物中由4 个主要成员组成,包括FoxO1、FoxO3、FoxO4 和FoxO6[5]。FoxO1在肝脏和胰腺等胰岛素反应组织中高度表达,并与代谢调节密切相关[6]。FoxO1 基因敲除增加小鼠胰腺前体细胞来源的β 细胞数量并促进小鼠肠道内分泌前体细胞生成IPCs[7-8]。FoxO1 促进了人诱导性多能干细胞来源的肠道器官样培养物向功能性IPCs 的分化[9],并上调了体外培养的人胎儿胰腺前体细胞生成的IPCs 中β 细胞标志物的表达[10-11]。FoxO1 在小鼠胰腺前体细胞中的过表达会导致体内胰腺发育不良[12]。此外,FoxO1 是成年胰岛β 细胞中胰腺十二指肠同源盒因子1(pancreatic and duodenal homeobox factor1,PDX1) 的负调控因子[13],PDX1 在胚胎期胰岛β 细胞的生成和成熟过程中起着关键的调节作用[14]。因此,推测FoxO1 可能是BMSCs 分化为功能性IPCs 过程中的负性调控因子。本研究通过构建干扰FoxO1 基因的shRNA 慢病毒载体,建立干扰FoxO1 的大鼠BMSCs 稳转株,为后续研究FoxO1 在BMSCs 诱导分化为IPCs 过程中的作用及潜在机制奠定基础,进一步为干细胞治疗糖尿病的研究提供参考。
1 材料与方法
1.1 材料
SPF 级4 周龄雄性SD 大鼠10 只,体质量100~150 g,由宁夏医科大学实验动物中心提供,并且按照宁夏医科大学实验动物伦理规定进行操作;大肠埃希菌Stbl3 菌株购自北京全式金生物技术有限公司,FoxO1 shRNA 质粒购自湖南丰晖生物科技有限公司,引物合成、质粒测序由生工生物工程(上海) 股份有限公司完成;DMEM/F12 培养基、胎牛血清、胰蛋白酶、青霉素链霉素双抗生素溶液购自美国Gibco 公司,DMEM 培养基购自美国HyClone 公司,liopfectamineTM3000购自美国Invitrogen 公司;RIPA 裂解液、BCA 蛋白测定试剂盒购自南京凯基生物科技发展有限公司,GAPDH 购自美国Cell Signaling Technology公司,FoxO1 购英国Biorbyt 公司,辣根过氧化酶标记的山羊抗兔IgG 购自北京中杉金桥生物技术有限公司;总RNA 提取试剂盒、去内毒素中提质粒试剂盒购自美国OMEGA 公司,逆转录试剂盒、Real time PCR 试剂盒购自日本TaKaRa 公司;油红O、茜素红购自赛业(广州)生物科技有限公司。
1.2 方法
1.2.1 BMSCs 的原代分离及培养 100~150 g SPF 级雄性SD 大鼠10 只,处死后,分离股骨和胫骨,置于无菌PBS 中。75%乙醇消毒后用PBS冲洗3 遍。将股骨和胫骨两端剪掉,用DMEM/F12 完全培养基多次冲洗髓腔,收集于离心管中。离心后收集沉淀,重悬,转移至培养瓶,放入培养箱。次日半量换液,后期每2 d 换1 次液,取3 代BMSCs 用于检测和进一步实验。
1.2.2 BMSCs 的分化功能鉴定 成骨诱导:待3代BMSCs 汇合度达到60%~70%时,替换为成骨诱导分化培养基培养,间隔2 d 换液。诱导27 d后,茜素红染色。成脂诱导:待3 代BMSCs 100%汇合,替换为成脂诱导分化培养基A 液培养。3 d后,替换诱导分化B 液培养。24 h 后换回A 液继续诱导。A 液和B 液交互作用,镜下可观察到脂滴时停止诱导,油红O 染色。
1.2.3 FoxO1 干扰慢病毒载体的构建 完成干扰和阴性对照的慢病毒载体设计(干扰质粒组名为:sh1、sh2、sh3,空白质粒:Vector),以嘌呤霉素抗性为稳定筛选标志,且质粒携带EGFP 基因,成功转染的细胞在荧光显微镜下可观察到绿色荧光。
1.2.4 质粒扩增 将质粒转化到大肠杆菌受体Stbl3 中,转化后的菌液涂布平板,37 ℃恒温培养箱培养,次日挑取单克隆菌落至1 mL 培养基内4~6 h,获得的菌液倒入200 mL 培养基,摇床培养12~16 h,结束后提取质粒,获取pLKO.1-EGFP+Puro 质粒。
1.2.5 验证质粒载体及筛选干扰效果最佳的质粒 1)干扰质粒瞬转293T 细胞:待293T 细胞汇合度达到60%~70%时转染。使用基础培养基DMEM 稀释liopfectamineTM3000 和目的质粒,稀释后的lipo3000 和质粒DNA 以1∶1 混匀,室温孵育10~15 min 后,均匀滴加至六孔板内,2 d 后荧光显微镜观察绿色荧光蛋白表达情况,并收集细胞。2)Western blot 检测:提取细胞总蛋白,BCA定量后,金属浴蛋白变性5 min,经10% SDSPAGE 分离凝胶分离,转至PVDF 膜上。封闭液(含10%脱脂奶粉) 封闭2 h,TBST 缓冲液洗膜,一抗、二抗孵育后,再次洗膜后显影。
1.2.6 慢病毒包装 待293T 细胞汇合到70%~80%时包装病毒。使用Opti-MEM 培养基稀释liopfectamineTM3000,混匀。用同种培养基稀释目标质粒和两个辅助质粒,制备三质粒DNA 预混液,混匀。将lipo3000 和三质粒DNA 混合物1∶1混匀,室温孵育10~15 min,加入完全培养基,混匀后加入六孔板中,37 ℃孵育细胞48 h,0.45 μm滤器过滤收集病毒原液,-80 ℃保存。
1.2.7 病毒滴度检测 96 孔板每孔接种1×105个293T 细胞。在10 个无菌EP 管内加入90 μL完全培养基,取病毒原液10 μL 加到第1 个EP管中,混匀,标记为101μL,然后取101μL 管中10 μL 混合液加入第2 个管中,标记为100 μL,依次倍比稀释至10-8μL。将各病毒混合液依次滴加至96 孔板中。24 h 后追加10 μL 完全培养基,48 h 后荧光鉴定。根据绿色荧光蛋白的数量计算病毒滴度:病毒滴度=绿色荧光蛋白的数量/病毒稀释倍数(TU·μL-1)。
1.2.8 慢病毒感染BMSCs 构建稳转株并验证转染效果 3 代BMSCs 接种于六孔板中;次日,1 mL病毒原液+200 μL 完全培养基稀释病毒后加到处理组BMSCs 中;第3 天,使用完全培养基继续培养;第5 天,用嘌呤霉素筛选细胞,药筛两轮,每轮4 d,继续培养后,得到干扰FoxO1 基因的BMSCs 稳转株和对照株。收集细胞,使用Western blot 验证其表达效果。提取RNA,逆转录为cDNA,RT-qPCR 实验检测基因表达水平。引物序列见表1。

表1 引物信息
1.3 统计学方法
数据采用GraphPad Prism 8.0 软件进行处理。计量资料以均数±标准差(±s)表示,组间比较采用t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 BMSCs 的细胞形态
在倒置显微镜下可见,原代BMSCs 大小不一,呈梭形贴壁生长,分布不均,见图1A;3 代BMSCs 呈梭形、鱼排状漩涡排列,分布较均匀,见图1B。

图1 BMSCs 细胞形态(×40)
2.2 BMSCs 分化能力鉴定
BMSCs 通过成骨分化培养基培养27 d 后,茜素红染色可见大量棕色片段,即为矿盐沉积及钙化结节,见图2A;通过成脂分化培养基培养26 d 后,经油红O 染色可观察到细胞集落群中充满脂滴的脂肪细胞,见图2B。
2.3 FoxO1 干扰载体的构建
获得测序正确的FoxO1 干扰慢病毒载体。测序结果完全符合,无突变,表明FoxO1 干扰慢病毒载体构建成功,见图3。

图3 pLKO.1-sh-FoxO1 质粒测序峰图
2.4 重组表达质粒的鉴定
重组表达质粒瞬转293T 细胞48 h,细胞荧光明显,表明EGFP 表达良好,见图4。Western blot 结果显示,载体中标签蛋白表达成功,并筛选到干扰效果最佳的目的质粒sh1-FoxO1,见图5。
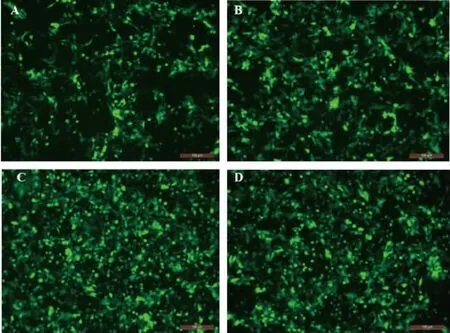
图4 质粒瞬转48 h 后的293T 细胞(×200)

图5 Western blot 检测293T 细胞中FoxO1 蛋白相对表达水平
2.5 FoxO1 干扰慢病毒包装及滴度检测
通过三因子慢病毒包装系统包装所得的慢病毒,经过逐孔稀释,转染293T 细胞48 h 后,荧光显微镜观察293T 细胞,通过计算,慢病毒滴度为1×108TU·μL-1,符合后续实验要求,见图6。
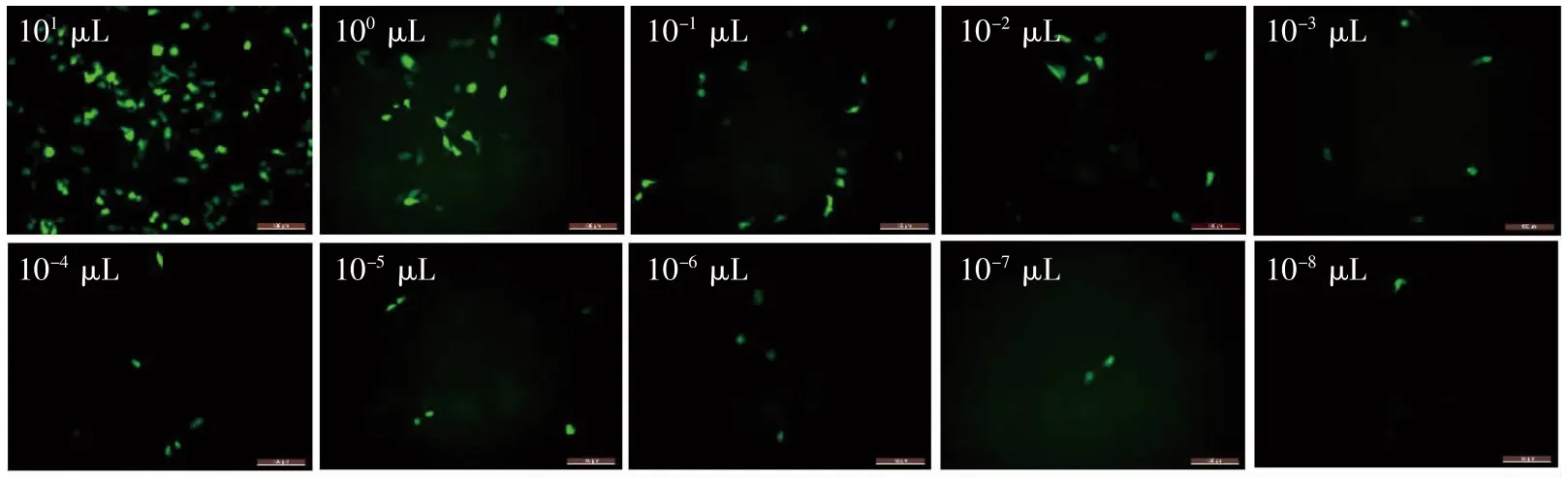
图6 慢病毒滴度测定(×200)
2.6 FoxO1 慢病毒感染BMSCs 构建稳转细胞株
采用三因子慢病毒包装系统包装完成的FoxO1 慢病毒感染BMSCs,经过最佳嘌呤霉素筛选浓度1 μg·mL-1进行筛选,得到干扰FoxO1 基因的大鼠BMSCs 稳转株。Western blot 结果显示,与Vector 组相比,sh1 组FoxO1 的蛋白相对表达量降低(P<0.05);RT-qPCR 结果显示,与Vector组相比,sh1 组FoxO1 的mRNA 相对表达量降低(P<0.01),表明构建的干扰表达载体在大鼠BMSCs 中有很好的表达效果,见图7。

图7 慢病毒转染的BMSCs 中FoxO1 mRNA 和蛋白检测
3 讨论
糖尿病是一种严重的人类代谢性疾病,主要特征为患者高血糖。目前胰岛移植、胰岛素注射、药物治疗等是糖尿病的主要治疗手段,但其仍存在药物依赖、异体移植免疫排斥反应和胰岛供体短缺等局限性,不能满足临床治疗的需要[15-16]。干细胞可以分化成多种细胞系,并有可能修复、保持或提高各种组织的能力。有研究[17]发现,将BMSCs 移植到胰腺组织后可分化为IPCs,且表达β 细胞标志物,并在葡萄糖刺激后产生胰岛素。将BMSCs 体外诱导分化的IPCs 移植到经链脲佐菌素诱导的糖尿病小鼠体内,可缓解其高血糖状态[18-19]。因此,在糖尿病治疗方面,将干细胞有针对性地在体外分化为IPCs,取代异常胰岛β 细胞治疗糖尿病已成为重要的研究方向之一[20-21]。
叉头盒O 类蛋白(FoxO)属于转录蛋白家族,参与许多细胞过程,是调节细胞稳态的重要环节[22]。FoxO1 的表达场所主要在胰岛素敏感组织中,包括胰岛β 细胞、肌肉细胞、肝细胞、脂肪细胞等。值得关注的是,FoxO1 在胚胎阶段全部的胰腺中都有表达,但在发育成熟的胰腺中只在胰岛β 细胞中表达。有研究[23]显示,在生理代谢应激后,去除胰岛β 细胞中的FoxO1 导致胰岛素分泌受损和β 细胞数量减少。FoxO1 基因敲除会增加小鼠胰腺前体细胞或肠内分泌前体细胞来源的β 细胞数量[8-9]。此外,抑制FoxO1 可促进体外培养的人诱导性多能干细胞[10]和人胎儿胰腺前体细胞[11-12]获得IPCs。这些结果表明,FoxO1 在不同时期或不同条件下的表达和活性的调节对胰岛β 细胞的发育、成熟和功能维持至关重要。因此,在体外诱导干细胞定向分化为IPCs 的过程中,了解FoxO1 的作用及其机制具有重要意义。
本研究构建了FoxO1 干扰的慢病毒表达质粒,选择BMSCs 作为感染对象,并且对感染细胞进行一定时间的嘌呤霉素的选择后,最终获得了稳定低表达FoxO1 的细胞株。首先将sh1-Fox-O1、sh2-FoxO1、sh3-FoxO1 与Vector 重组质粒瞬时转染至293T 细胞,通过Western blot 筛选确定重组表达质粒sh1-FoxO1 干扰效果最佳。然后通过三因子慢病毒包装系统包装sh1-FoxO1 慢病毒,并且确定BMSCs 的最佳嘌呤霉素筛选浓度为1 μg·mL-1。使用FoxO1 慢病毒感染BMSCs 2~3 d,嘌呤霉素筛选两轮,每轮4 d,然后提取转染后BMSCs 的蛋白和RNA,对FoxO1 在细胞中的表达进行分析。结果显示,与转染阴性病毒的细胞相比,转染携带有FoxO1 干扰慢病毒的细胞中,FoxO1 蛋白及mRNA 表达均下调。
综上所述,本研究成功构建了FoxO1 干扰BMSCs 稳转株,为进一步研究FoxO1 在诱导BMSCs 定向分化为IPCs 过程中的作用及其潜在机制奠定了基础,同时,通过建立起一个有效并且稳定的诱导分化方案,为干细胞治疗糖尿病的研究提供了有力的参考。

