hUMSCs外分泌蛋白治疗实验性自身免疫性葡萄膜炎模型大鼠的机制初探*
刘珏, 谢希婷,2, 沈树浩, 王颖薇, 穆亚君, 陈剑, 周清△
(1暨南大学附属第一医院,广东 广州 510630;2深圳深东爱尔眼科医院,广东 深圳 518116)
葡萄膜炎是多发于青壮年的常见致盲性眼病,约2/3的葡萄膜炎患者出现慢性视力损伤[1],在发展中国家致盲率高达25%[2]。自身免疫因素是非感染性葡萄膜炎发病机制的重要基础[3],目前治疗葡萄膜炎较为普遍的疗法是长期全身使用皮质类固醇药物或免疫抑制剂,治疗效果不稳定,而治疗引发的眼部并发症及全身副作用限制了此类药物的应用[4],开发安全有效的治疗方法是葡萄膜炎研究领域重要而紧迫的社会目标。间充质干细胞(mesenchymal stem cells, MSCs)是一类具有自我更新和分化潜能的细胞,可以通过影响全身Th细胞和Treg细胞及其细胞因子的分泌[5],减轻EAU的严重程度,是实验性自身免疫性葡萄膜炎(experimental autoimmune uveitis, EAU)动物模型治疗方案中的突破点[6]。但在局部微环境下,MSCs存在异常分化[7]、促进肿瘤细胞增殖和迁移[8]以及引起增殖性视网膜病变[9]等作用。MSCs外分泌蛋白具有MSCs免疫调节作用的生物活性,同时避免了MSCs的副作用[10],可作为取代MSCs的治疗方案。目前针对MSCs外分泌蛋白在EAU模型中的免疫调节作用,以及MSCs外分泌蛋白是否影响眼球“免疫赦免防线”——血-视网膜屏障(blood-retina barrier, BRB)的相关研究仍有许多未知区域,发掘探讨这些内容可为EAU模型的非细胞治疗方案提供参考。本实验应用腹腔注射人脐带间充质干细胞外分泌蛋白(human umbilical cord mesenchymal stem cells-derived secretome, hUMSCs-S)对EAU模型大鼠进行治疗,通过检测眼内炎症细胞浸润、视网膜色素上皮细胞(retinal pigment epithelial,RPE)紧密连接蛋白及血清中相关炎症因子的表达,探讨 hUMSCs-S是否可以干预EAU的发生和发展其可能的作用机制,以期为EAU的治疗提供补充依据。
材料和方法
1 动物
6~8周龄SPF级雌性健康Lewis大鼠72只,体重160~180 g,购自北京维通利华实验动物技术有限公司(质量合格证编号No. 99410000001387; No.11400700386749),许可证号为SYXK(粤)2017-0174,动物实验编号为No. 00220089和 No.00229138;实验方案和实验过程经暨南大学实验动物福利伦理委员会审批及全程监督,批准编号为IACUC-20190303-04和IACUC-20190705-02。
2 主要试剂
提取原代人脐带间充质干细胞(human umbilical cord mesenchymal stem cells, hUMSCs),培养至P3代收集提取hUMSCs-S。该部分实验由暨南大学再生医学实验室团队执行,hUMSCs-S由暨南大学再生医学实验室提取鉴定并惠赠。
视网膜光感受器间维生素A类结合蛋白(interphotoreceptor retino-binding protein, IRBP)由上海生物工程有限公司合成;弗氏完全佐剂(Freund′s complete adjuvant, CFA)购自Sigma;氨基甲酸乙酯购自上海麦克林生化科技有限公司;眼球固定液购自武汉谷歌生物科技有限公司;大鼠白细胞介素17(in-terleukin 17, IL-17)/IL-17A ELISA Kit购自欣博盛生物科技有限公司;DMEM低糖培养液购自Gibco,苏木素-伊红染液购自江苏凯基生物技术股份有限公司;CD3抗体及紧密连接蛋白ZO-1抗体购自Abcam;PBS磷酸缓冲液干粉购自Biosharp。
3 主要方法
3.1 hUMSC-S的提取及鉴定 使用组织块消化法提取hUMSC-S,置于37℃、5% CO2培养箱培养至P3代,24 h后收集上清液,1 000 kD透析袋密封上清液,超纯水中透析,每3 h更换1次透析外液,透析24 h后用0.22 μm过滤器除菌并收集透析液。提取外分泌蛋白后用BCA法测试其蛋白浓度,Zeta电位仪检测Zeta电位。随机抽取10批次的外分泌蛋白混合后进行质谱检测。-80 ℃下保存备用。
3.2 实验分组与模型制作 排除全身及眼部异常,动物按序编号,用随机数字表法将实验动物随机分为正常对照(control, CTRL)组、EAU模型组及hUMSCs-S治疗组,每组24只大鼠。参照Caspi的方法建立EAU动物模型并制备造模药物[11],IRBP与CFA(含2.5 g/L结核分枝杆菌)混合震荡1 min制成乳液(0.2 mL含50 μg IRBP )。EAU模型组及hUMSCs-S治疗组组:每只大鼠尾根部及双侧大腿皮下注射乳液0.2 mL(尾部注射0.1 mL、双侧大腿皮下注射各0.05 mL),CTRL组大鼠相同部位注射等体积PBS缓冲液;hUMSCs-S治疗组大鼠在免疫诱导的同时按100 μg/100 g体重腹腔注射hUMSCs-S悬液,CTRL组和EAU模型组腹腔注射等体积PBS缓冲液。
3.3 眼前段Caspi评分 建模后每日在裂隙灯显微镜下观察并拍摄记录大鼠眼前段情况,共观察21 d,根据Caspi评分标准[12]评价眼前段炎症程度。
3.4 眼球组织切片HE染色及病理学观察 于第7、14和21天随机抽取3组大鼠各8只,20%氨基甲酸乙酯按1.5 mL/kg体重腹腔注射麻醉大鼠,待充分麻醉后断颈处死大鼠,Ⅲ型安尔碘消毒眼周皮肤,用无菌眼科显微器械分离眼球与睑结膜等周围组织,剪断眼球远端视神经及血管,完整摘除双侧眼球,固定并制成石蜡切片行HE染色,根据Caspi组织病理学分级评分[12],用显微镜(Leica DM4000)拍摄全眼球切片,每张切片选取前房睫状突附近3个视野进行观察,采用ImageJ软件对前房浸润炎症细胞进行计数,拍摄及计数分析由两名经验丰富的眼科专业研究人员同时操作。
3.5 免疫组化检测 CD3+T细胞及免疫荧光检测ZO-1蛋白 眼球组织切片经过脱蜡、抗原修复、双氧水处理、血清封闭后,Ⅰ抗4 ℃孵育过夜,Ⅱ抗室温孵育50 min,DAB显色、苏木素染核、脱水封片,镜下观察棕黄色着色细胞为CD3阳性表达。各组大鼠眼球石蜡切片经过脱蜡、抗原修复、血清封闭后,滴加ZO-1 Ⅰ抗4 ℃孵育过夜,Ⅱ抗室温孵育2 h、DAPI染细胞核后封片,-20 ℃避光保存,荧光显微镜下观察并采集图像。
3.6 ELISA检测外周血IL-10、IL-17水平 第14天时随机抽取3组大鼠,先进行上述3.4步骤取材,随后开腹采集腹主动脉血3~5 mL,将血液标本置于37 ℃水浴锅中孵育1 h,2 000 ×g离心10 min后取上清,釆用ELISA试剂盒检测IL-10、IL-17水平。
4 统计学处理
采用SPSS 27.0统计学软件对实验数据进行统计分析,实验数据以均数±标准差(mean±SD)表示,EAU模型组与hUMSCs-S治疗组大鼠眼部炎症Caspi评分采用两样本t检验分析,血清中IL-10、IL-17表达量差异比较使用单因素方差检验,以P<0.05为差异有统计学意义。
结果
1 hUMSCs-S蛋白质谱分析鉴定
BCA蛋白定量检测结果显示有血清存在条件下提取液中的蛋白浓度约为3.690 mg/mL,无血清条件下提取的蛋白浓度为0.598 mg/mL。蛋白质谱分析结果显示hUMSC-S中含蛋白质共379种,其中包括ICOS配体、vasorin、protein sidekick-2、moesin、retinal dehydrogenase-1、caspase recruitment domain-containing protein 16及各型免疫球蛋白等与免疫反应相关和视网膜损伤及修复过程相关的蛋白成分。
2 眼前段炎症观察及Caspi评分
CTRL组大鼠眼前节表现为角膜透明,虹膜纹理清晰,虹膜血管无明显充血扩张,瞳孔等大等圆,对光反射灵敏,眼底红光反射存在,见图1A:a~d。EAU组造模后第7天开始可观察到虹膜表面血管扩张、充血(图1A:f);第14天眼前段炎症加重达高峰,虹膜表面血管进一步扩张、充血,房水混浊,瞳孔区虹膜后粘连或闭锁(图1A:g),眼底红光反射变暗,严重者出现前房积血;第16~18天眼前段炎症减轻,造模后第21天前段炎症消退,个别模型可见虹膜血管轻度充血(图1A:h)。

Figure 1. Anterior chamber performance and Caspi score of the rats in the 3 groups. A: anterior chamber images at various time points: the day of modeling (D0), the 7th day (D7), the 14th day (D14), and the 21st day (D21). Vascular dilation and congestion on the surface of the iris could be observed since D7 after modeling in the EAU group (f). Blood vessels on the surface of the iris were further dilated and congested, with cloudy aqueous humor, and atretopsia on the D14 (g). hUMSCs-S group exhibited less inflammation in the anterior segment than EAU group, with onset of congestion and dilation of iris vessels on D7 (j), and mild turbidity of aqueous humor on D14 (k). The anterior segment basically returned to normal on D21 (h, l). Scale bar=2 mm. B: anterior chamber Caspi score of rats in EAU and hUMSCs-S group. Mean±SD. n=8. *P<0.05, **P<0.01 vs huMSCs-S group.图1 3组大鼠眼前段表现及眼前段Caspi评分
hUMSCs-S治疗组眼前段炎症表现较EAU模型组轻, 第7~10天起病,第13~14天病变达高峰,观察到虹膜血管充血、扩张,房水混浊;其后炎症逐渐消退,至第21时眼前节基本恢复正常,见图1 A:i-l。
EAU模型组及hUMSCs-S治疗组大鼠前房Caspi评分,采用两样本t检验进行分析,结果显示EAU组眼前段Caspi评分均数在第11~17天均高于hUMSCs-S组(P<0.05),见图1B。
3 眼球组织切片HE染色及组织病理学分析
观察第7天、第14天、第21天3个时间点各组大鼠眼球组织石蜡切片HE染色情况,其前房、虹膜睫状体、视网膜病理学改变、前房及玻璃体炎症细胞浸润情况与眼前段炎症改变时间段及炎症程度一致。
CTRL组虹膜、视网膜及前房结构完整、分层有序,无水肿及炎症细胞浸润(图2A:a、d、g)。EAU组在第7天出现虹膜及视网膜水肿、前房和玻璃体腔炎症细胞浸润;第12~14天达高峰,虹膜血管扩张、充血,虹膜及前房大量炎症细胞浸润(图2A:b、h)、视网膜分层结构紊乱(图2A:e);第21天病变消退,结构基本恢复正常,炎细胞浸润减少,极少数模型遗留视网膜结构紊乱。hUMSCs-S组虹膜及视网膜组织轻度水肿(图2A:c、f)、虹膜及前房少量炎症细胞浸润(图2A:c、i),破坏程度较EAU组明显减轻,第21天虹膜及视网膜结构均恢复正常。第14天时EAU模型组视网膜损伤Caspi评分均数高于hUMSCs-S治疗组(P<0.01),见图2B。EAU组前房渗出细胞数明显高于CTRL组和hUMSCs-S组(P<0.05),见图2C。
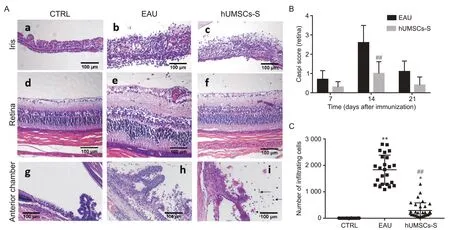
Figure 2. HE staining of iris, retina and anterior chamber, retinal Caspi score and anterior chamber infiltrating inflammatory cells onthe 14th day after modeling of three groups of rats. A: HE staining of iris, retina and anterior chamber. Iris, retina and anterior chamber were intact, stratified and orderly without edema or inflammatory cell infiltration in the CTRL group (a, d,g). In the EAU model group, edema of the iris and retina, infiltration of a large number of inflammatory cells in the iris,anterior chamber, dilation and congestion of the iris blood vessels, and disorders of retinal stratification were observed (b,e, h). In the hUMSCs-S group , there was mild edema of iris and retina tissues as well as a small amount of inflammatory cell infiltration in iris and anterior chamber (c, f, i). Scale bar=100 μm. B: statistical results of retinal tissue Caspi scores between the EAU group and the hUMSCs-S group at days 7, 14 and 21. C: infiltrating cells of the anterior chamber in the three groups at D14 were analyzed. Mean±SD. n=8. *P<0.05, **P<0.01 vs CTRL group; ##P<0.01 vs EAU group .图2 造模后第14天3组大鼠虹膜、视网膜及前房组织HE染色结果,视网膜Caspi评分及前房渗出炎症细胞计数
4 眼球免疫组化检测CD3+ T细胞及免疫荧光检测ZO-1蛋白
CTRL组虹膜睫状体及视网膜可见少量CD3+T细胞表达;EAU模型组虹膜睫状体有大量CD3+T细胞阳性表达,视网膜的外核层、内核层、内丛状层及节细胞层及脉络膜层均可见阳性细胞。hUMSCs-S治疗组虹膜睫状体及视网膜的CD3+T淋巴细胞的表达较EAU组明显减少。
CTRL组ZO-1蛋白在视网膜明显表达;EAU模型组在第14天时视网膜及脉络膜的ZO-1明显减少,以视网膜内层及色素上皮层缺失明显;hUMSCs-S治疗组视网膜内层ZO-1表达较CTRL减少,但仍多于EAU模型组,见图3。

Figure 3. Immunohistochemistry staining of CD3+ T-lymphocytes and immunofluorescence staining of ZO-1 in iris and retina of the three groups at D14 after modeling. A small amount of CD3+ T cells were observed in iris,ciliary body and retina in CTRL group (a, d). In EAU group, a large number of CD3+ T cells were positively expressed in the iris, ciliary body, anterior chamber and the retina (b, e). The expression of CD3+ T lymphocytes in iris ciliary body and retina of hUMSCs-S group was significantly reduced compared with EAU group (c, f). ZO-1 protein was obviously expressed in retina in CTRL group (g). In the EAU group, ZO-1 levels in retina decreased significantly,especially in the inner retina and retinal pigment epithelium (h). The expression of ZO-1 in the inner retina of hUMSCs-S was lower than that of CTRL, but still higher than that of EAU group (i).图3 造模后第14天3组大鼠虹膜、视网膜CD3+ T淋巴细胞免疫组化染色及ZO-1免疫荧光染色结果
5 ELISA检测大鼠外周血IL-17、IL-10浓度
采用ELISA试剂盒对3组大鼠第14天时外周血中IL-17、IL-10水平进行检测。结果显示,EAU模型组外周血清中IL-17表达组较CTRL组和hUMSCs-S治疗组均增加(P<0.01),见图4A; EAU模型组血清中IL-10表达水平高于CTRL组(P<0.01),hUMSCs-S治疗组血清中IL-10表达水平高于EAU模型组(P<0.05),见图4B。
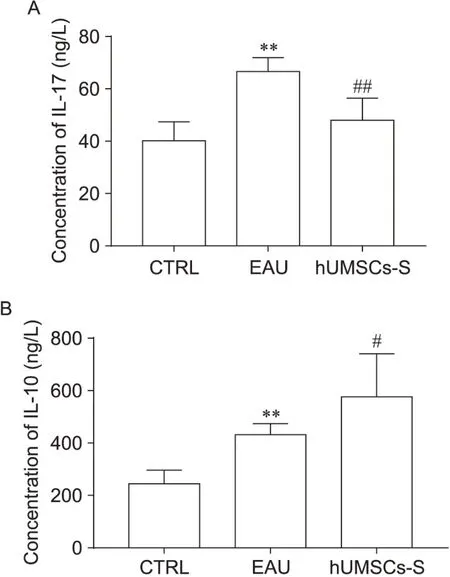
Figure 4. Concentrations of IL-17 (A) and IL-10 (B) in peripheral blood of rats in 3 groups at D14 after modeling.mean±SD. n=8. **P<0.01 vs CTRL group; #P<0.05,##P<0.01 vs EAU group.图4 造模后第14天3组大鼠外周血中IL-17和IL-10浓度
讨论
本实验应用IRBP联合弗氏完全佐剂成功诱导EAU大鼠模型,在诱导免疫的同时给予腹腔注射hUMSCs-S,结果显示腹腔注射hUMSCs-S可使EAU大鼠眼前段炎症缓解、前房浸润炎症细胞数量减少,视网膜损伤程度减轻,证明腹腔注射hUMSCs-S对大鼠EAU治疗有效。
BRB的完整性与眼内炎症反应程度关系密切,EAU时BRB被破坏,白细胞黏附,血管通透性增加,炎症细胞及相关因子透过屏障浸润至视网膜,引起视网膜组织水肿、炎症细胞浸润和新生血管生成。BRB的完整性和眼部微血管通透性的维持主要依赖于紧密连接蛋白的表达,即ZO-1紧密连接蛋白,其表达可反应BRB的完整性。实验结果提示,ZO-1蛋白在CTRL组大鼠视网膜表达明显;在造模第14天时EAU组大鼠视网膜及脉络膜相应区域淡染甚至无染色、CD3+T细胞大量表达;hUMSCs-S治疗组大鼠视网膜内层ZO-1表达较CTRL组减少,较EAU模型组表达量增加,表明腹腔注射hUMSCs-S可通过减轻EAU模型大鼠视网膜即脉络膜ZO-1蛋白破坏程度维持视网膜结构完整性。
研究表明,Th17细胞分泌的IL-17在EAU模型动物的虹膜睫状体、视网膜及脉络膜组织中均有表达,其表达量与病变程度正相关[13],而作为EAU中Th1分泌的主要促炎因子,IFN-γ基因敲除鼠仍可由IL-17诱导发生EAU[14],IL-17特异性抗体可明显减轻EAU症状[15];说明IL-17是EAU发病机制中更为重要的因子。现有对MSCs及其外分泌蛋白治疗EAU模型的机制研究多集中在抑制眼球局部T细胞增殖分化,减少IL-17的表达,上调Treg细胞占比等方面;IL-17在EAU病理机制中的作用还包括破坏ARPE-19细胞(人视网膜上皮细胞)的ZO-1紧密连接蛋白,刺激其分泌炎症介质[16],吸引活化白细胞进一步加重损伤[17]。目前应用MSCs-S治疗EAU的给药方式一般采取眼周局部注射或玻璃体腔注射。在本实验中,第14天时EAU模型组大鼠外周血中促炎因子IL-17的表达水平较CTRL组增加,经腹腔注射hUMSCs-S的EAU大鼠外周血IL-17表达水平较EAU组下降,但与CTRL组比较仍有增加。
IL-10是调节性免疫细胞分泌的抑炎因子。体外实验证实,经MSC分泌的微囊泡处理的激活状态BV2细胞及外周血单核细胞表达抑炎因子IL-10和TGF-β总量增加,同时炎性细胞因子(TNF-α和IL-1β)的表达减少[18];MSCs-S治疗可显著提高神经退行性病变[19]及慢性炎性疾病模型(如多发性硬化[20]、实验性自身免疫性脑脊髓炎[21]和1型糖尿病[22])动物体内损伤组织、外周淋巴器官及血清中表达IL-10的Treg细胞比例;细胞及动物实验证实MSCs-S抑炎作用的主要机制为通过抑制浆细胞分化,诱导Breg细胞表达IL-10,进而减轻炎症[23]。外周血中IL-10表达的调控在EAU治疗中的作用未见报道,本实验探讨了hUMSCs-S对EAU模型外周血中IL-10的影响,实验结果证实,与腹腔注射PBS的EAU组相比,腹腔注射hUMSCs-S组大鼠外周血中抑炎因子IL-10表达明显升高。提示腹腔注射hUMSCs-S可提高外周血中抑炎因子IL-10的表达。
综上所述,在IRBP联合弗氏完全佐剂诱导的EAU大鼠模型中,眼球内ZO-1紧密连接蛋白的表达减少会导致BRB的破坏、炎症细胞浸润、导致视网膜炎症的产生,腹腔注射hUMSC-S可以通过减少ZO-1蛋白的破坏达到维持BRB稳定性、减少炎症细胞浸润的作用。腹腔注射hUMSCs-S后EAU大鼠外周血中炎症因子IL-17表达下降、抑炎因子IL-10的表达增加与EAU缓解程度一致,说明hUMSCs-S除能够有效穿透组织和生物屏障,在眼球局部发挥作用外,还可能通过在全身发挥抑炎、调节免疫作用同步发挥调节炎症免疫的作用。使用hUMSC-S可以有效地抑制模型大鼠EAU炎症反应。在实际应用中,相对于间充质干细胞来源紧缺及导入机体方式不完善等限制,hUMSC-S具有来源广泛,分离提取技术成熟,获取存储较易的优点,本实验的完成为异源性MSCs外分泌蛋白全身给药治疗大鼠EAU提供了证据,腹腔注射hUMSCs-S有潜力成为EAU干细胞治疗中重要的补充手段。

