CT 定量对腰椎术后邻近椎体骨密度变化的评估
张 红,刘传梅,张 琳,樊子健,庄顺达,江万里
1.山东中医药大学附属医院放射科,山东 济南 250014;2.山东中医药大学第一临床医学院,山东 济南250014
随着脊柱外科及腰椎内固定器的发展,腰椎后路融合术因创伤小、恢复快被广泛应用于临床。研究证实,腰椎后路融合术对保守治疗无效的腰椎间盘突出症、腰椎滑脱症及腰椎椎管狭窄症患者疗效显著[1]。尽管腰椎后路融合术优势较多,但仍存在较多并发症,其中以腰椎骨密度改变最显著。腰椎骨密度的改变既是影响腰椎椎弓根钉固定效果的重要因素之一[2],也是导致腰椎融合术后邻近节段退变加剧、腰椎不融合的重要因素。因此,评价腰椎骨密度的改变对有效减少腰椎术后并发症有重要意义。
目前,双能X 线吸收测量法(dual-energy X-ray absorptiometry,DXA)是诊断腰椎骨质疏松症的金标准。依据椎体CT 值评估骨密度也越来越受到骨质疏松学界关注[3]。术前三维重建CT 检查中测得的椎体松质骨CT 值与DXA 测得的骨密度值具有较好的相关性,且在骨质疏松患者的筛查中具有重要价值[4]。CT 测量骨密度的真实性和准确性在众多文献中被证实[5]。
腰椎术后,固定椎体中骨质密度降低已被证实,但对邻近椎体骨质密度的变化少有研究[6]。因此,本研究通过测量固定椎体邻近椎体术前、术后不同时间段的CT 值来评估腰椎椎体骨密度的变化,为临床干预提供影像学依据,以减少术后并发症的发生。
1 资料与方法
1.1 一般资料
回顾性分析2019 年1 月至2022 年5 月山东中医药大学附属医院因腰椎间盘突出症、腰椎滑脱症和腰椎椎管狭窄症而行内固定融合术治疗的腰椎退行性疾病患者资料。纳入标准:①术前15 d 在院内行腰椎CT 检查,且检查结果完善的患者;②固定节段为L4~S1椎体;③手术方式均为腰椎后路融合术。排除标准:①存在先天性脊柱畸形、脊柱创伤、脊柱肿瘤、脊柱结核、强直性脊柱炎、既往脊柱手术史等情形;②存在代谢性骨病或长期服用皮质激素等影响骨密度的药物;③无法完成随访的患者。最终共纳入86 例,其中男54 例,女32 例;年龄24~81 岁,平均(64.70±3.51)岁。对患者术前(86 例)、术后5~10 d(65 例)、3 个月(56 例)、6 个月(63 例)、12 个月(59 例)、18 个月(59 例)进行随 访观察,测量邻 近椎体L1~3的CT 值。
1.2 仪器与方法
采用GE Revolution 256 层CT 扫描仪。扫描参数:120 kV,层厚、层距均为0.625 mm。扫描范围自T12椎体上缘至S2椎体下缘。
由1 位经验丰富的医师使用PACS 测量CT 值。在腰椎轴位图像上勾画ROI,大小为50 mm2,ROI 放置在正常椎体的椎体前中部,避开骨皮质及椎体静脉丛,选取轴位上、中、下3 个层面,在松质骨内完成对椎体的测量,测量3 次取平均值(图1)。
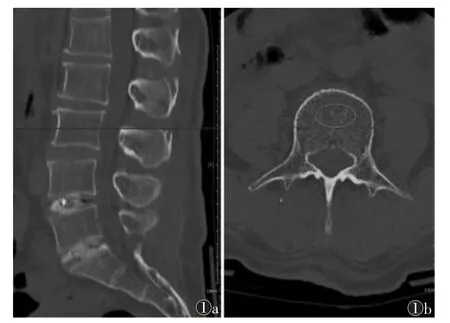
图1 椎体CT 值的测量 注:图1a 为矢状位MPR 图像,图1b 为轴位图像,选取正中层面测定CT 值
1.3 统计学方法
2 结果
86 例患者中,男54 例,平均年龄(62.42±5.11)岁,平均BMI 为(26.67±2.39)kg/m2;女32 例,平均年龄(65.25±3.51)岁,平均BMI 为(24.37±3.28)kg/m2。不同性别、年龄分布差异均无统计学意义(均P>0.05),BMI 差异有统计学意义(P<0.05)。
与术前CT 值相比,L1~3椎体的CT 值在术 后5~10 d 变化不明显,差异无统计学意义(P>0.05);在术后3~12 个月呈不同程度下降趋势,术后12 个月降至最低水平,术后18 个月缓慢上升,术后3、6、12 及18 个月与术前相比,差异均有统计学意义(均P<0.05)。L1~3椎体的CT 值在各个时间点呈同步变化趋势(表1,2)。
表1 L1~3 椎体在不同时间点的CT 值(HU,)

表1 L1~3 椎体在不同时间点的CT 值(HU,)
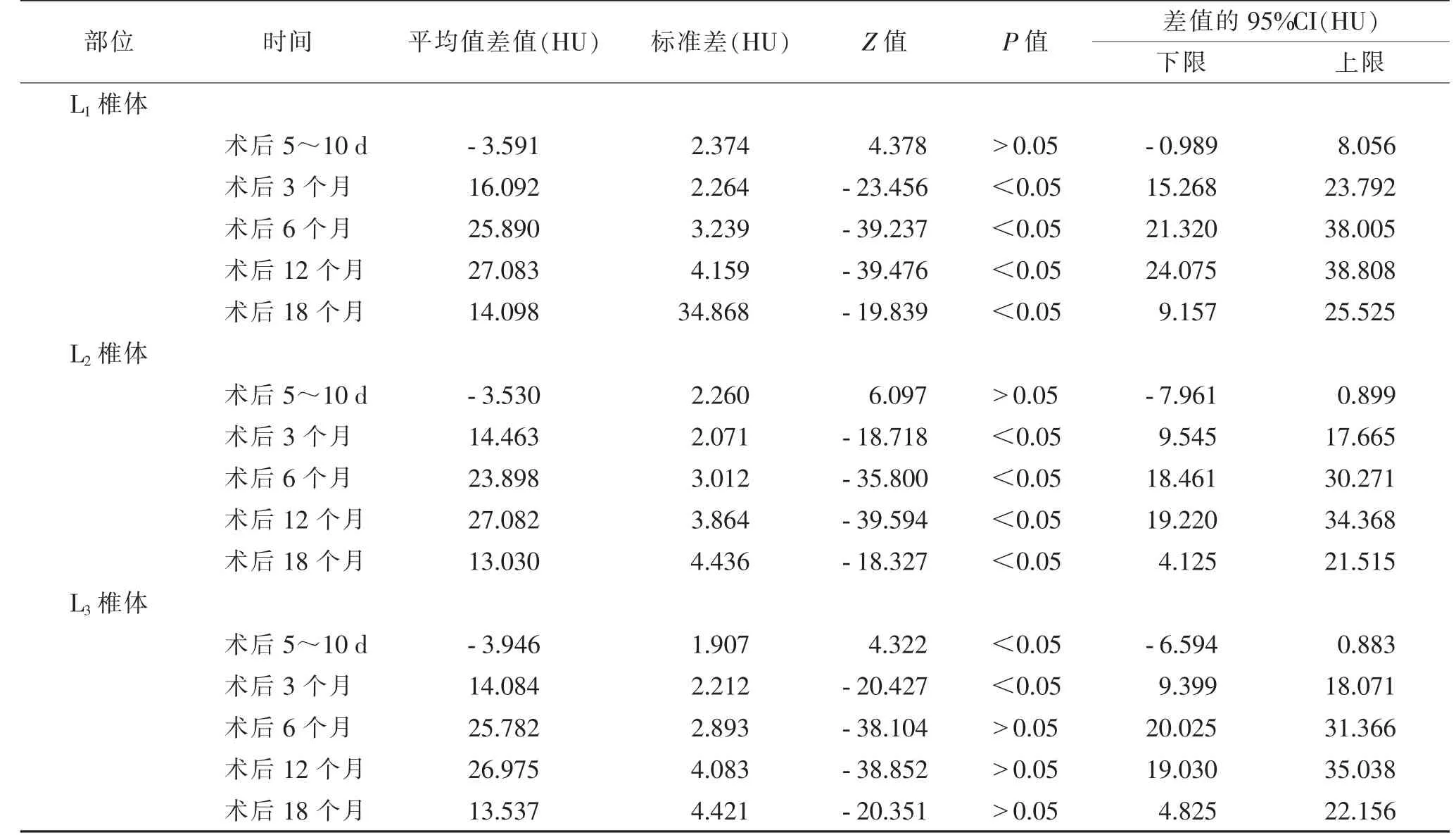
表2 L1~3 椎体在不同时间点的广义估计方程分析结果
3 讨论
DXA 被认为是诊断骨质疏松的金标准,但脊柱畸形、脊柱手术史、腰椎内固定物、椎体压缩性骨折等均会影响DXA 的诊断准确性[7]。避开皮质骨等区域,定量CT 较DXA 能更早、更灵敏地反映骨量丢失较敏感的椎体松质骨的骨量变化,但其应用需额外的质量控制、校准体模和软件培训,目前在临床实践中的应用较少[8]。使用椎体CT 值代表骨密度和诊断骨质疏松的优点[9]:①与定量CT 检查相比,腰椎CT 是腰椎融合内固定术的术前常规检查之一,测量CT 值无需额外的费用、时间、扫描设备、软件和辐射暴露,且操作方便快捷,更易在基层医院普及;②椎体CT 值测量松质骨的密度,避开了皮质骨、退变结构、骨折等的影响,在严重退变患者中可获得比DXA 更准确的骨密度值;③椎体骨折患者的DXA结果大多表现为骨量减少甚至正常,无法检出骨折,而常规CT 能在骨质疏松时直接在矢状位重建图像上确定椎体压缩性骨折的存在,以便早期治疗[10]。
CT 值不仅受设备型号的影响,还与管电压、管电流、扫描时间等参数有关[11],因此,需控制相关影响因素,确立广泛认可的诊断界值。管电压不同,CT 值也不同,且随管电压降低而明显增高,本研究管电压固定在120 kV。因此,在同一台CT 机、扫描参数均相同的情况下,进行的比较是可行的[12]。
腰椎术后患者邻近椎体骨密度变化可能会导致手术失败的原因:融合的腰椎相邻节段增加了邻近椎体的压力和小关节负荷,加速了这些节段的退化[13]。腰椎融合术后腰椎整体的活动度减少,但非固定节段的活动度增加。邻近椎体骨密度降低可能会导致椎体骨折的发生,术后患者伤椎再骨折及相邻椎体新发骨折的概率为13.6%[14]。很多研究认为患者椎体CT 值越低,腰椎术后骨质疏松相关并发症风险越高。本研究腰椎术后患者邻近椎体的CT 值在术后12 个月降至最低,此时应采取相应的措施预防并发症的发生。
本研究腰椎术后病变患者邻近椎体骨密度不同程度降低,其主要原因为:术后患者常规卧床,活动度减少会导致邻近椎体骨密度降低;术后3 个月佩戴制动装置也会导致不同程度骨量丢失;机体的自我调节和自我适应功能导致成骨效应逐渐被激活,当机体内成骨效应和破骨效应逐渐达到平衡时,骨密度的变化会出现一个平台期,邻近椎体骨密度在术后12 个月降至最低水平[2]。后期由于恢复锻炼或抗骨质疏松药物的应用,患者骨质密度会有一定程度恢复,因此患者在18 个月及以后骨密度有所上升[15]。因此,腰椎术后邻近椎体骨密度呈先下降后上升的过程。
在本研究中,与术前CT 值相比,术后5~10 d L1~3椎体CT 值变化不明显,差异无统计学意义,术后3、6、12、18 个月椎体骨质密度不同程度降低,以术后12 个月下降最显著,但18 个月CT 值密度略有升高,骨密度略恢复,但仍未到达术前椎体骨密度水平,差异有统计学意义。
本研究的局限性:①样本量较小,未能按年龄段进一步分组研究;②部分患者依从性差,未获得所有患者的术后各期的随访资料;③近几年椎体CT 值评估骨质密度的方法不断发展,越来越成熟和完善,但仍有许多临床问题亟待研究和解决,椎体CT 值诊断骨质疏松的标准尚不明确,也限制了椎体CT 值评估骨密度变化的进一步推广,需大样本量数据进一步分析。
综上所述L4~S1椎体内固定术后邻近L1~3椎体CT 值存在先缓慢降低再上升的过程;L1~3椎体之间CT 值呈同步变化趋势;患者椎体CT 值越低,腰椎术后骨质疏松相关并发症风险越高。因此,应积极采取抗骨质疏松症方案,尤其在12 个月之前,可减少骨密度降低引起继发病症的可能性。

