甲状腺髓样癌的常规超声及超声造影特征分析
苟政江,宋 涛,高军喜,庄晓晨,李智铭
新疆医科大学第一附属医院腹部超声诊断科,新疆 乌鲁木齐830000
甲状腺髓样癌(medullary thyroid carcinoma,MTC)是一种少见的甲状腺恶性肿瘤,仅占全部甲状腺恶性肿瘤的2%~3%[1]。MTC 起源于甲状腺滤泡旁细胞(C 细胞),根据疾病遗传特性,分为遗传性和散发性两大类,散发性MTC 发病率较高,占发病总数的75%~80%[2]。MTC 恶性程度较高,仅次于未分化型甲状腺癌,呈浸润生长,早期易发生颈部淋巴结转移及远处转移。因此,早期诊断对疾病预后非常关键。目前,降钙素原并未成为甲状腺疾病的常规检查,超声在诊断MTC 时发挥着重要作用。MTC 既有甲状腺恶性结节的超声特征,也有良性结节特征[3]。本研究通过对比分析MTC 与甲状腺乳头状癌(papillary carcinoma of the thyroid,PTC)及结节性甲状腺肿(nodular goiter,NG)的常规超声及超声造影特点,总结分析MTC 超声的特征性表现,提高超声对该病的诊断准确率。
1 资料与方法
1.1 一般资料
回顾性分析自2010 年1 月至2022 年1 月在我院经术前常规超声检查并经病理证实的MTC 患者(MTC 组)52 例(64 个病灶),其 中男22 例,女30 例,平均年龄(48±12)岁。选择同期基本资料(性别、年龄等)相似的经病理证实的PTC 患者(PTC 组)98 例(125 个病灶)及NG 患者(NG 组)112 例作为对照,其中PTC 组中,男38 例,女60 例,平均年龄(47±10)岁;NG 组中,男40 例,女72 例,平均年龄(51±12)岁。MTC 组中19 例(21 个病灶)行超声造影检查;PTC 组、NG 组均行超声造影检查。
1.2 仪器与方法
1.2.1 常规超声
采用GE Logiq E9 彩色多普勒超声诊断仪,ML6-15 线阵探头,频率10~15 MHz,多切面充分扫查双侧甲状腺及颈部淋巴结。甲状腺结节的常规超声观察特征参照美国放射学会(ACR)甲状腺影像报告和数据系统(TI-RADS)2017 版[4]:①内部结构分为囊性、实性和囊实性。②回声根据颈部肌肉及正常甲状腺组织的回声进行定义,病变回声低于甲状腺正常腺体为低回声/极低回声;病变回声与周围正常甲状腺腺体相似为等回声;病变回声高于甲状腺正常腺体为高回声。③边界分为清晰、不清晰。④形态分为规则、不规则。⑤钙化分为无钙化、微小钙化(直径≤1 mm)和粗大钙化(直径>1 mm)。⑥纵横比≥1 指结节在横切或纵切时,结节前后径≥左右径或上下径,反之则为纵横比<1[5]。⑦结节内部血流分布多于周围甲状腺组织为丰富,反之为不丰富[6]。⑧淋巴结转移以最终病理结果为准分为有和无。
1.2.2 超声造影
采用GE Logiq E9 彩色多普勒超声诊断仪,9L线阵探头,频率8.4~9.0 MHz。造影检查使用SonoVue对比剂(Bracco 公司),加生理盐水5 mL 稀释后经肘静脉注射,剂量1.5 mL,后注射生理盐水5 mL 冲管,单点聚焦置于病灶深部边缘,调整适当增益清晰显示病灶,连续动态观察对比剂灌注达峰及退出过程,并同步录像存储。超声造影观察指标[7-8]:①结节增强强度分低增强、等增强和高增强(与周围正常腺体比较);②增强模式分向心性、离心性和弥漫性增强;③增强均匀性分均匀和不均匀增强;④周边环状增强分有与无;⑤消退方式分快速、同步和缓慢消退。
1.3 图像分析
常规超声及超声造影图像判读由2 位从事多年甲状腺超声及超声造影的医师共同完成,意见不一致时请另一位经验丰富的上级医师会诊达成一致。
1.4 统计学分析
采用SPSS 25.0 软件进行统计分析。分类变量以个(%)表示,组间差异比较行χ2检验,不满足最小期望采用Fisher 精确检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 MTC 与PTC 常规超声特征比较(表1)
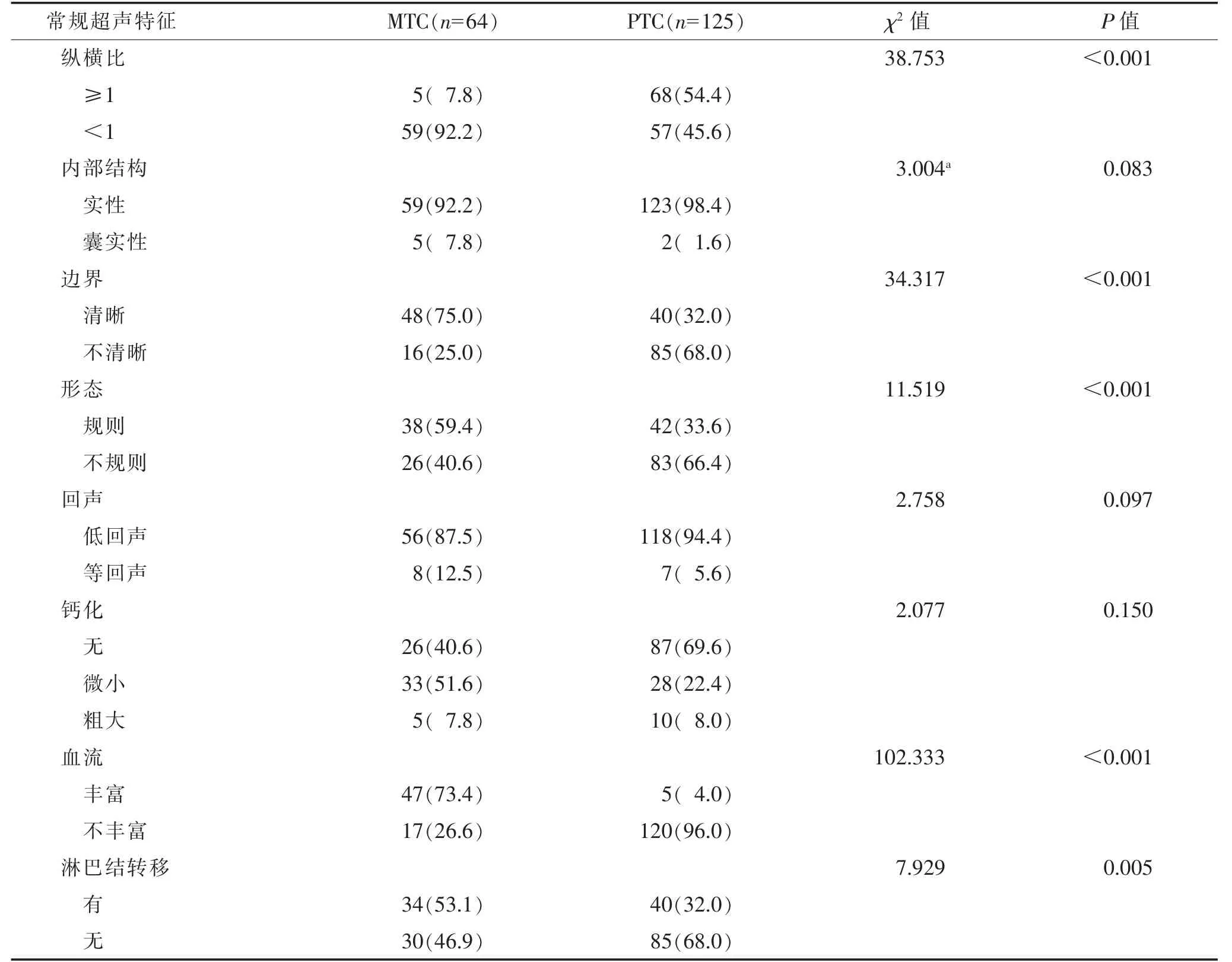
表1 MTC 与PTC 常规超声特征比较 个(%)
MTC 与PTC 常规超声特征相比,纵横比<1 多见,结节边界多清晰,形态多规则,血流多丰富(图1),内部多见微小钙化,淋巴结转移更多见(图2),差异均有统计学意义(均P<0.05)。

图1 甲状腺右叶髓样癌常规超声和彩色多普勒超声图像 注:患者,男,63 岁。图1a为常规超声,示甲状腺右侧叶实性低回声结节,纵横比<1,边界清晰,形态规则;图1b为彩色多普勒超声,示结节内部血流信号极丰富 图2 甲状腺右叶髓样癌常规超声图像 注:患者,女,28 岁。图2a 可见甲状腺右侧叶实性结节部并其内多发微小钙化,图2b 示同侧颈部多发异常结构淋巴结,病理证实为髓样癌多发颈部淋巴结转移
2.2 MTC 与NG 常规超声特征比较(表2)
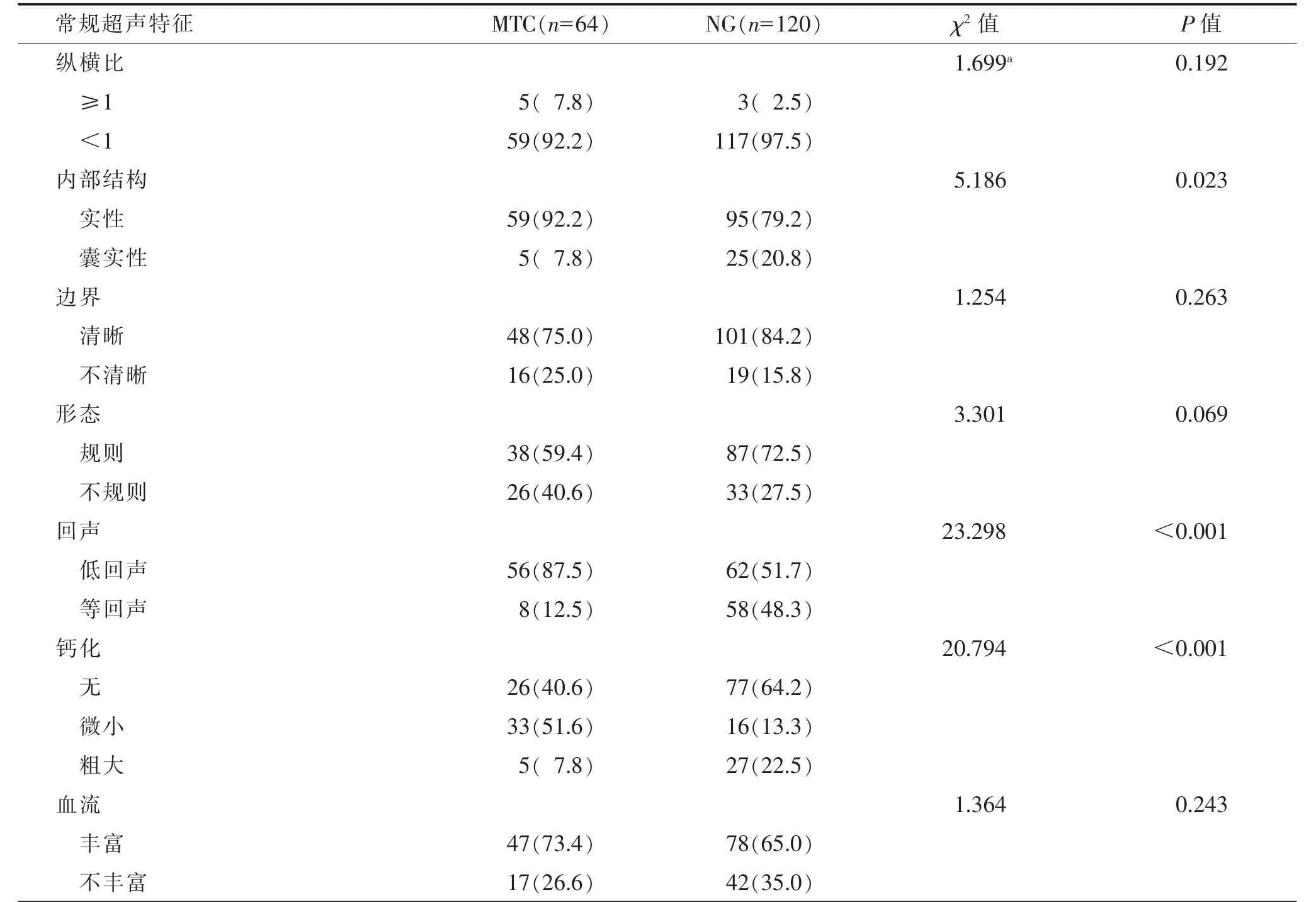
表2 MTC 与NG 常规超声特征比较 个(%)
MTC 与NG 常规超声特征相比,以实性低回声多见,内部多伴微小钙化,差异均有统计学意义(均P<0.05)。
2.3 MTC 与PTC 超声造影特征比较(表3)
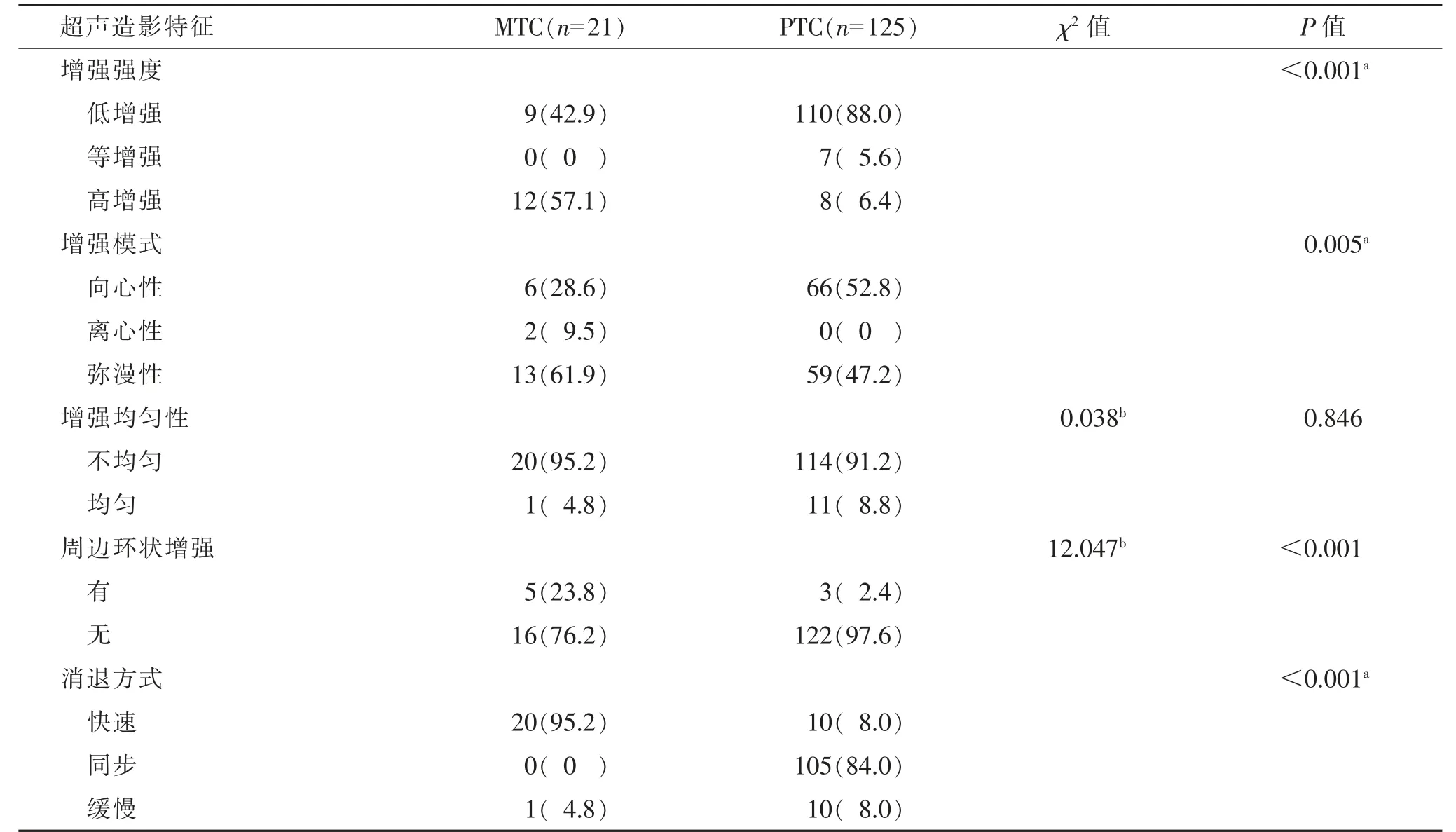
表3 MTC 与PTC 超声造影特征比较 个(%)
MTC 与PTC 超声造影特征相比,以弥漫性高增强多见,部分周边可见环状增强(图3),多快速消退;PTC 以向心性低增强多见(图4),差异均有统计学意义(均P<0.05)。
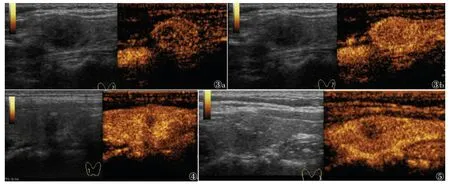
图3~5 甲状腺髓样癌超声造影声像图 注:图3 患者,女,44 岁;甲状腺左叶髓样癌。图3a 为甲状腺左侧叶实性结节超声造影呈弥漫性高增强,图3b 为结节周边环状增强。图4 患者,女,46 岁;甲状腺右侧叶乳头状癌超声造影呈向心性低增强。图5 患者,女,32 岁;甲状腺左侧叶髓样癌超声造影较周围正常腺体呈快速消退
2.4 MTC 与NG 超声造影特征比较(表4)
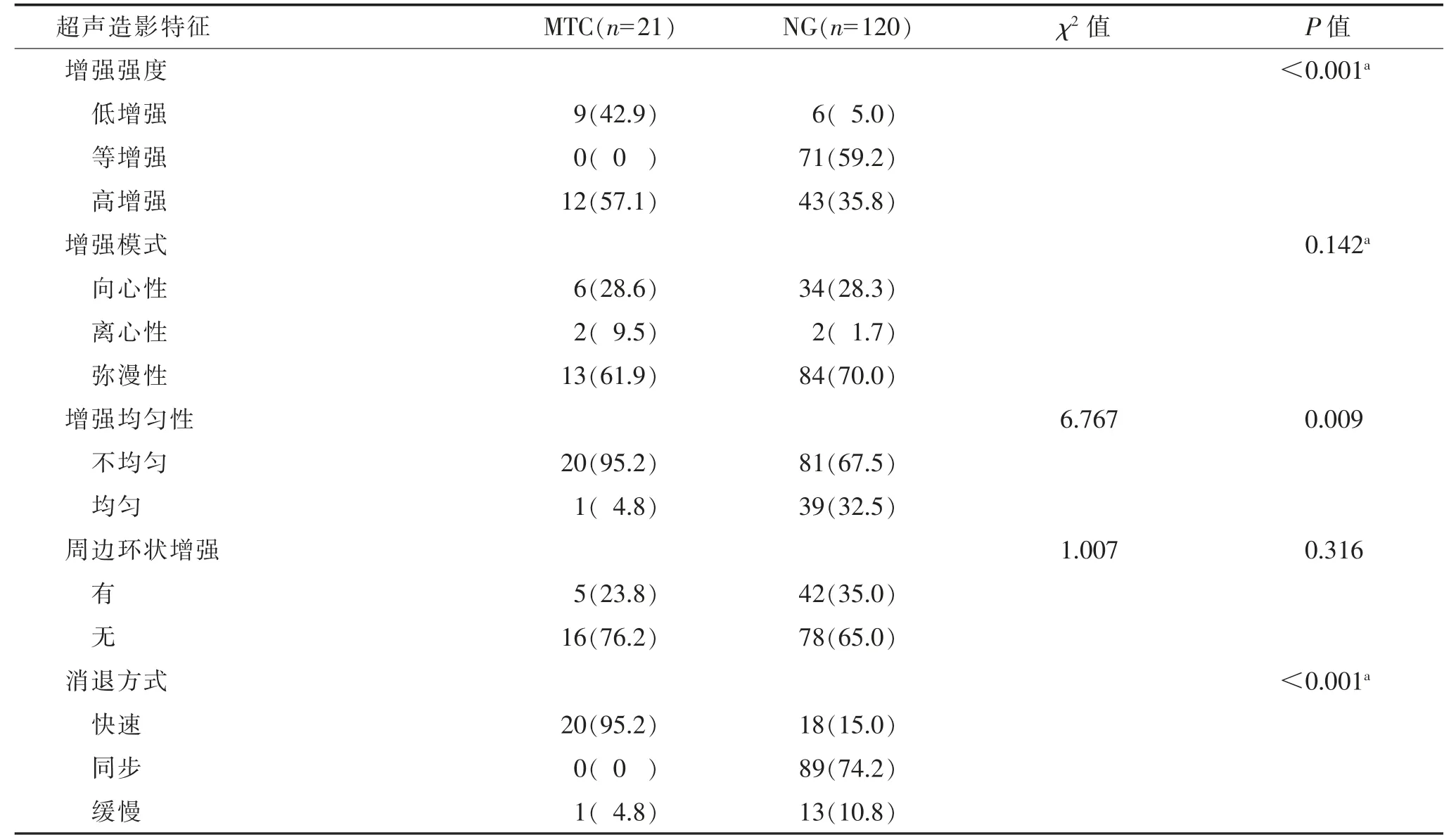
表4 MTC 与NG 超声造影特征比较 个(%)
MTC 与NG 超声造影特征比较,多表现为不均匀高增强,快速消退(图5),差异均有统计学意义(均P<0.05)。
3 讨论
MTC 是起源于甲状腺滤泡旁细胞(C 细胞)的恶性肿瘤,发病率较低,预后较差,早期易出现淋巴结转移[6]。虽然血清降钙素原是特异性诊断指标,但并不作为甲状腺的临床常规筛查手段。超声作为甲状腺疾病最常见且便捷的检查手段,已广泛应用于临床。超声造影技术目前也逐步作为常规检查应用于甲状腺结节的鉴别诊断。
本研究显示,MTC 组与PTC 组相比,纵横比<1更多见,说明MTC 更多接近于良性结节水平生长方式。有研究认为,良性结节局限于正常的组织平面内,故呈卵圆形;而恶性结节呈侵袭性生长,能够突破正常的组织平面呈直立性生长[9]。MTC 在边界、形态方面多表现出良性结节的特征,这可能与肿瘤细胞压迫周围正常甲状腺组织形成假包膜和假囊有关[10],表现出较清晰的边界及相对规则的形态;而PTC 的肿瘤细胞呈浸润生长,结节内及其边缘会发生瘢痕及纤维化,牵拉周围组织,使结节形态不规则、边界不清晰。本研究中MTC 组与NG 组相比较多表现为实性结节,原因可能与MTC 血供丰富,结节不易出现液化坏死及囊性变有关;而NG 结节内易出现囊性变,因此较多呈混合性回声。本研究中MTC 较PTC 更易出现微小钙化,微小钙化是甲状腺恶性肿瘤的重要标志,与MTC 癌细胞生长迅速、肿瘤内血管与纤维组织过度增生使钙盐沉积及被淀粉样包绕形成有关。MTC 与NG 比较,NG 的钙化多为粗大钙化,原因是在致病因素导致滤泡上皮增生和复旧交替过程中,因纤维结缔组织增生而影响血供,造成出血、坏死、囊变等继发性改变,血肿吸收、机化后形成钙化,与文献[11-12]报道一致。本研究MTC 较PTC 血流信号丰富,可能与MTC 肿瘤细胞为巢状排列,癌细胞之间存在较多纤维血管结构分布,易形成丰富的血流信号有关,这与骆洪浩等[13-14]研究一致;
且其与部分血流信号丰富的NG 相似,因此在血流方面MTC 与NG 较难鉴别。血流丰富的NG 多在单纯性弥漫性甲状腺肿的基础上,病情反复进展,导致滤泡上皮长期的增生和退变交替出现,而处于增生期的结节易形成丰富血流信号。研究中MTC 组较PTC 组更易出现淋巴结转移,原因可能是MTC 较PTC 恶性程度高,肿瘤生长迅速,侵袭性更高,易发生远处转移。
本研究中MTC 超声造影较PTC 多表现出不均匀、弥漫性、高增强、快速消退等特征。MTC 内部血供丰富,超声造影多表现为高增强,而PTC 肿瘤内新生血管边缘区相对密集,中央区相对稀疏,边缘区与中央区血管丰富与否可能是造成PTC 向心性低增强的原因[15]。本研究中MTC 组对比剂消退速度较其他2 组快,这可能与MTC 肿瘤内部血管变异大,分支多,易形成动静脉瘘有关。张卫兵等[16]研究认为,周边环状增强是良性结节超声造影的重要特征,但本研究中MTC 组部分结节超声造影时周边有环状增强,与NG 组相似,原因可能是部分MTC 肿瘤类似良性结节膨胀性生长,压迫周边组织形成晕环,导致超声造影时周边形成环状增强。
本研究的不足之处:MTC 发病率低,超声造影样本量偏小,今后需增加样本量进一步研究。
综上所述,MTC 与PTC 相比,常规超声以纵横比<1 多见,边界多清晰,形态多规则,内部多伴钙化,血流丰富且更易出现淋巴结转移,超声造影易表现为弥漫性高增强,部分周边可见环状增强,快速消退;MTC 与NG 相比,常规超声以实性低回声多见,内部多伴微小钙化,超声造影多表现为不均匀高增强,快速消退。准确掌握以上特征可为临床MTC 的准确诊断提供影像学依据。

