基于临床与CT 平扫联合模型预测脑出血早期进展的价值
过 永,徐家军,张晓金,吴 波,杨 飞,张 虎
华东师范大学附属芜湖医院/芜湖市第二人民医院医学影像科,安徽 芜湖241000
原发性脑出血(primary intracerebral hemorrhage,pICH)是指除继发性脑出血(如颅脑创伤、动静脉瘘、动脉瘤、颅内肿瘤)等原因引起的脑血管破裂,导致血液短期内在脑实质内聚集。出血性脑卒中严重威胁人们健康,发病率、致残率及致死率较高,仅次于缺血性脑卒中[1]。早期血肿扩大被认为是预后不良的独立危险因素,预防血肿扩大发生是治疗pICH 的重要手段之一,可降低死亡率[2-3]。CTA 对比剂外泄点征是脑出血患者血肿扩大的重要依据[1,4-7],但在临床工作中受限于患者配合度、医院条件、检查时间等,且部分患者可能存在对比剂过敏、肝肾功能损害等问题。CT 平扫能快速、准确地判断出血部位、出血量、是否破入脑室等问题,是临床首选检查方法,但对血肿扩大的预测敏感度较低,且联合临床建立模型预测脑出血进展鲜有报道[8]。本研究回顾性分析208 例pICH 患者的临床资料和CT 平扫特征,构建临床、影像和两者联合预测模型,旨在为pICH 患者的个体化治疗提供依据。
1 资料与方法
1.1 一般资料
收集我院2019 年9 月至2022 年6 月收治的pICH 患者208 例,分析其首次CT 平扫特征、入院时实验室检查及临床资料。纳入标准:①发病6 h 内行头颅CT 平扫,且在24 h 内复查。②年龄≥18 岁,且无外科手术指征;③CT 平扫符合脑出血诊断标准,CT 值65~85 HU。排除标准:①颅脑外伤、脑血管畸形、颅内肿瘤伴出血、手术出血等继发性脑出血;②各种原因导致图像质量差、无法分析;③脑室内出血、大脑半球大面积出血或多部位出血;④无法完成复查或复查前行手术治疗;⑤出血灶<1 mL;⑥实验室检查、临床资料不完整。
1.2 仪器与方法
使用GE Revolution 64 和Philips MX 16 CT 机扫描。扫描范围从颅底至头顶部。扫描参数:120 kV,电流随电压自动改变,矩阵512×512,层厚5 mm,层距4.5 mm。
1.3 图像分析
由2 位工作15 年的放射科医师在PACS 上阅片,分析血肿部位、血肿密度评分、形态评分[9]、有无水肿、是否破入脑室,以及有无混合征、黑洞征、卫星征、岛征、旋涡征、低密度征等[8,10],并进行BAT 评分[B 为混合征,A 为低密度征,T 为发病时长(发病至首次CT 平扫时间),有混合征计1 分,有低密度征计2 分,发病时长<2.5 h 计2 分,满分5 分]。意见不一致时,经协商达成统一意见。另由1 位医师利用数坤科技的脑卒中软件[11]测量血肿体积。将首次CT平扫及24 h 内复查的原始图像导入数坤Stroke 中处理,得到初始和复查血肿体积,两者差值>6 mL 或增加33%,即纳入进展组,否则纳入稳定组。208 例中,稳定组146 例,进展组62 例。
1.4 统计学分析
采用R 软件(4.1.2 版)和SPSS 23.0 软件进行数据处理。计数资料以例(%)表示,组间比较行χ2检验。符合正态分布的计量资料用表示,组间比较行独立样本t 检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较行秩和检验。利用单因素分析筛选2 组有差异的指标,进一步行多因素logistic回归分析筛选血肿进展的独立影响因子,并分别构建临床、影像和两者联合预测模型。多因素logistic回归分析筛选血肿进展的独立影响因子;联合预测模型稳定性评价采用5 折交叉验证;绘制各模型的ROC 曲线,AUC 比较行DeLong 检验,将最优模型以列线图展示,采用校准曲线评估其预测准确性,决策曲线评价临床获益。以P<0.05 为差异有统计学意义。
2 结果
2.1 2 组临床资料和CT 平扫特征比较
2 组性别、发病时长、超急性期血肿扩大速度(onsetto-imaging time,OTT)值、格拉斯哥昏迷量表(Glasgow Coma Scale,GCS)评分、美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)评分、糖尿病、脑出血史、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)、甘油三酯比较,差异均有统计学意义(均P<0.05)(表1)。
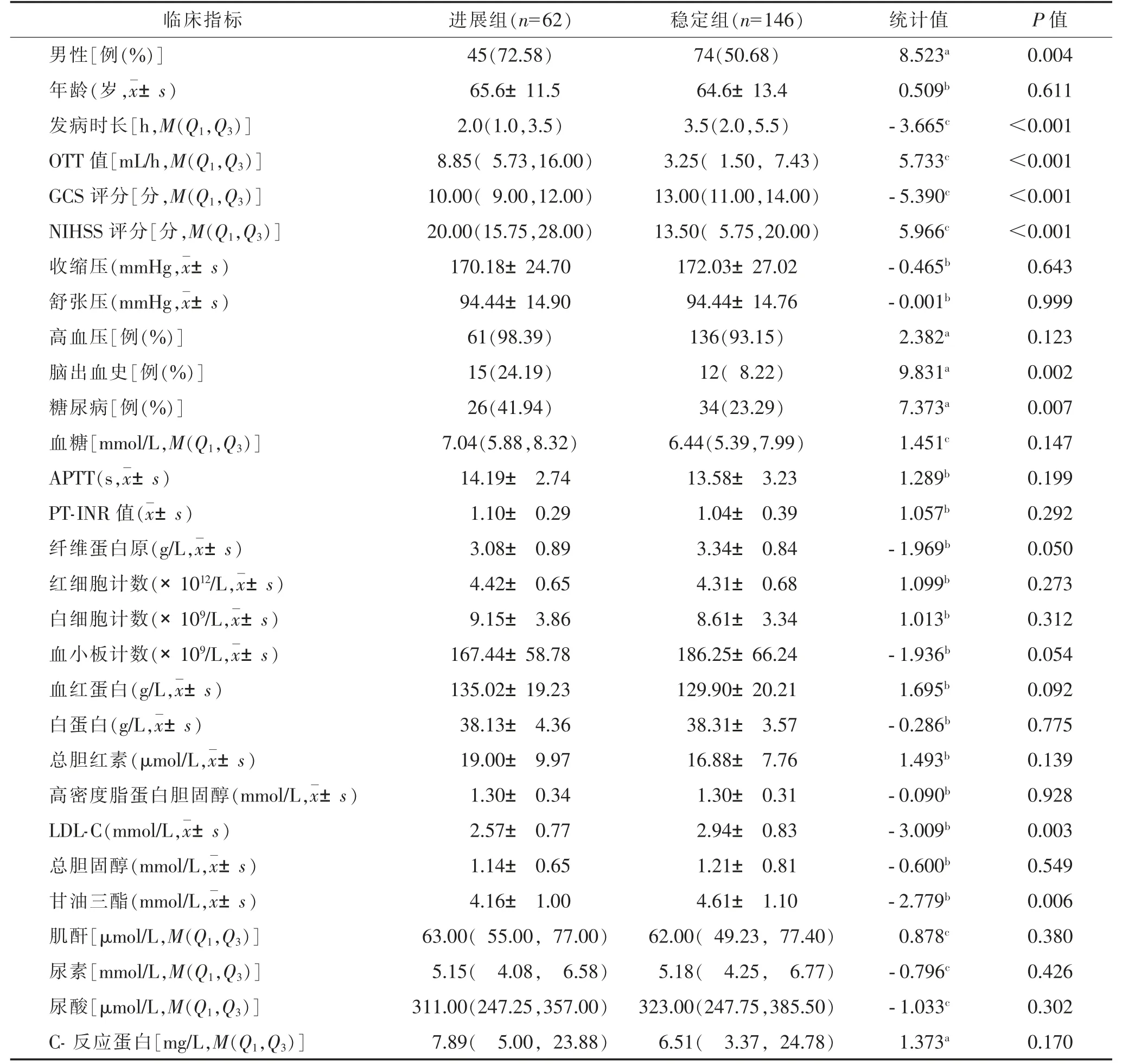
表1 进展组和稳定组临床资料对比
2 组初始血肿体积、形态评分、密度分类评分、脑水肿、混合征、黑洞征、卫星征、岛征、旋涡征、低密度征、BAT 评分比较,差异均有统计学意义(均P<0.05)。2 组血肿是否破入脑室、发病部位比较,差异均无统计学意义(均P>0.05)(表2)。
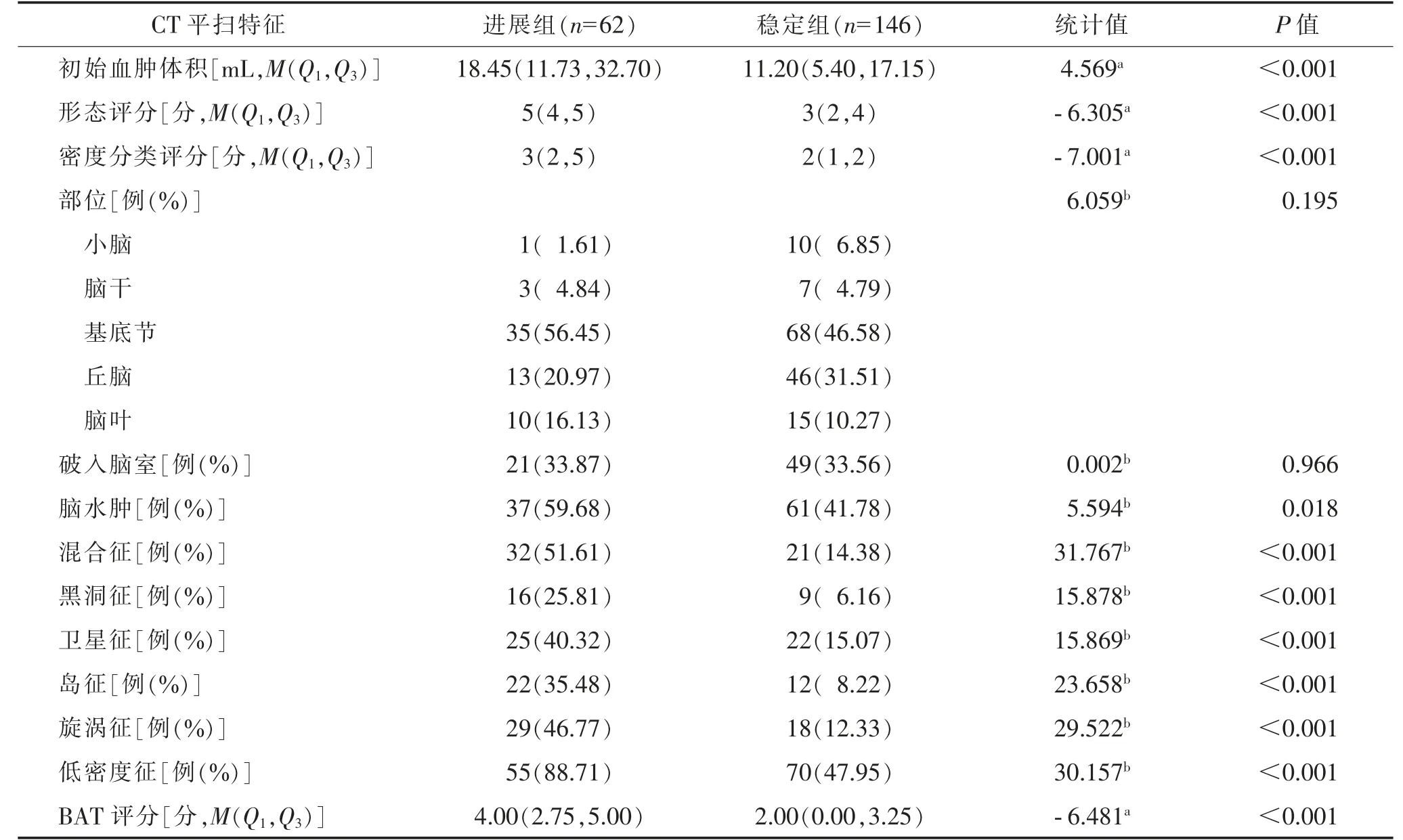
表2 进展组和稳定组CT 平扫特征比较
2.2 多因素logistic 回归分析和模型的建立
多因素logistic 回归分析显示,LDL-C(OR=0.408,95%CI 0.206~0.810)、糖尿病(OR=3.288,95%CI 1.129~9.578)、混合征(OR=4.077,95%CI 1.214~13.687)、形态评分(OR=1.728,95%CI 1.134~2.632)是发生血肿扩大的独立影响因素(均P<0.05)。以LDL-C、糖尿病建立临床预测模型;以混合征、形态评分建立影像预测模型;以LDL-C、糖尿病、混合征、形态评分建立临床联合影像预测模型,对应AUC、敏感度及特异度见表3。
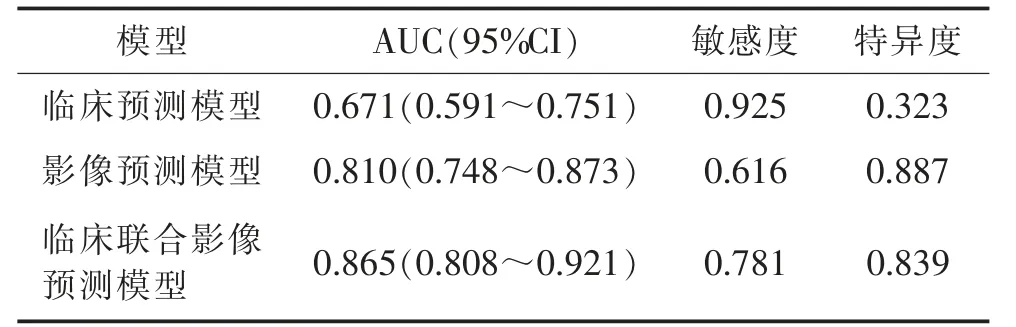
表3 不同预测模型的诊断效能比较
2.3 各预测模型的ROC 曲线分析及预测效能
采用5 折交叉验证方法,取5 次AUC 均值为0.834,与联合预测模型AUC 为0.834 基本相符。采用DeLong 检验两两比较3 种预测模型的AUC,差异均有统计学意义(均P<0.05)。联合预测模型的AUC高于临床和影像预测模型,其敏感度、特异度较高且相对稳定(图1)。将临床联合影像预测模型进一步转化成可视化的列线图模式(图2)。校准曲线显示联合预测模型具有较好的一致性(图3);决策曲线显示联合预测模型具有较高的临床实用性(图4)。
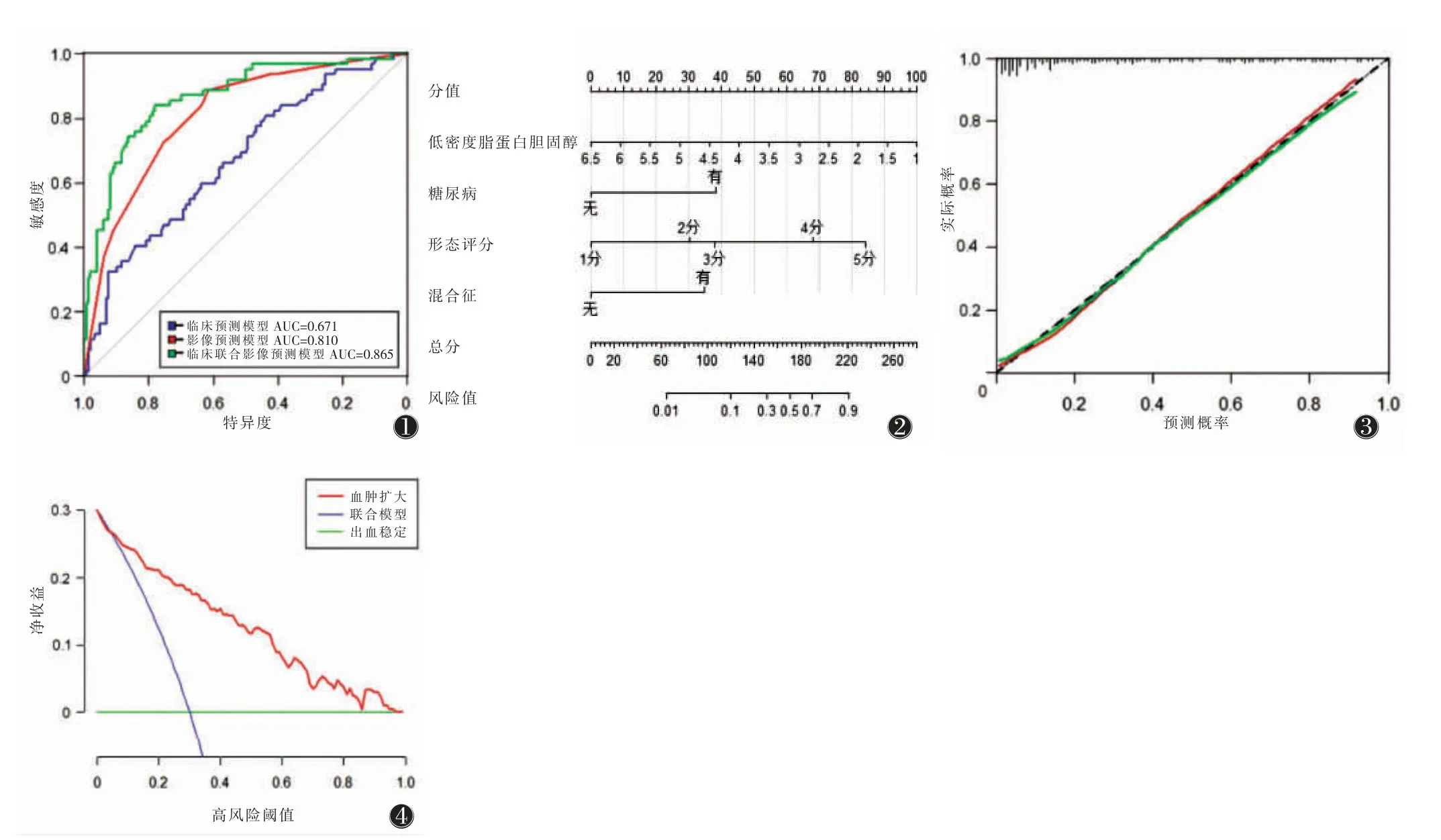
图1 临床预测模型、影像预测模型及两者联合模型预测血肿扩大的ROC 曲线 图2 临床联合影像模型预测血肿扩大列线图 注:患者入院检查结果能直观反映个体发生血肿扩大的概率 图3 临床联合影像预测模型校准曲线 注:灰色虚线表示理想预测曲线,红色和绿色实线表示预测曲线和内部验证曲线,两者越靠近虚线表示精准度越高 图4 临床联合影像预测模型的决策曲线 注:绿色实线表示脑出血稳定患者,紫色实线表示血肿扩大患者,红色实线表示联合模型当风险阈值在6%~86%时,临床有获益
3 讨论
《中国脑出血诊治指南(2019)》[1]指出我国pICH发病率呈上升趋势,起病迅速、进展快,致残、致死率高,预后差,给社会和家庭带来了沉重负担。目前,深度学习及影像组学在多方面虽有重要突破,但VOI勾画难度较大,数据解析与临床实际难以一一对应,且临床转化困难[12-15]。CT 平扫征象被证明是脑出血血肿进展的重要因素,但未与临床因素相结合综合考虑[16]。
本研究单因素分析中,血肿初始体积越大、CT 平扫值越小、GCS 评分越低、血肿形态越不规则及出现混合征,常预示血肿进展概率增加,与以往报道[3,7,10]基本符合。多因素logistic 回归分析显示,糖尿病、LDL-C、形态评分及混合征是血肿早期进展扩大的独立影响因素。血糖升高可能导致脑内乳酸水平增高,脑局部糖代谢量减低进而改变血-脑脊液屏障功能,促使血肿进展,与陈媛媛等[3]研究结果一致。本研究还发现,LDL-C 降低是脑出血早期血肿扩大的独立影响因素,原因可能是LDL-C 通过细胞外液将脂质转移至全身、被介导内吞,若在动脉壁内短期被大量氧化则加剧内膜损害。低水平的LDL-C 可显著降低心脑血管疾病的风险,但对其与出血性脑卒中、血肿扩大及预后的关系仍不清楚[17]。最新研究表明,LDL-C过低是脑出血死亡率较高的独立危险因素[18],与本研究结果相似,这提示临床在治疗脑出血时追求过低的LDL-C 水平,可能会加速血肿进展。
本研究发现,血肿形态不规则是早期发生血肿扩大的危险因素,与杨耀博等[19]的研究结果一致,短时间内血液大量聚集,形成不规则形状,对周边小血管挤压,造成较大的剪切力,进而导致小血管损伤、撕裂,使血肿进一步扩大。混合征或混杂征被定义为2 种不同密度的血肿,分界清楚,CT 差值≥18 HU,有研究表明混合征出现概率仅10%~35%,其预测脑出血进展的敏感度低,但特异度较高[20],与本研究结果相似。混合征是影响血肿进展的独立危险因素,若临床未及时止血或止血不充分,会导致血肿。
本研究发现,临床预测模型的敏感度较高、特异度较低,影像预测模型的敏感度低、特异度较高,对于临床判断血肿是否进展的可靠性不佳,临床联合影像预测模型具有较好的敏感度、特异度,其AUC为0.865,优于其他2 种模型。联合预测模型转化为可视化的列线图能更直观地预测脑出血早期血肿扩大的概率,为临床个体化治疗提供依据。校准曲线和决策曲线表明,联合模型预测概率与实际发生概率具有较好的一致性,稳定性较好,对临床决策收益更大。
本研究的不足之处:①采用回顾性分析,样本量偏小,为单中心研究,可能存在偏倚;②部分重症患者入院前可能已发生血肿扩大,且未考虑院前急救措施可能对模型的影响;③脑室出血因数量少而未被纳入研究,可能导致结果出现偏差等。
综上所述,本研究筛选出糖尿病、LDL-C、形态评分及混合征4 个独立影响因子,并构建临床联合影像预测模型,该模型对pICH 的早期血肿扩大具有较高的诊断效能,可视化的列线图能够帮助临床医师对pICH 患者进行个体化决策治疗。

