敏旱和抗旱狗牙根叶片对干旱胁迫的转录组响应差异分析
李 硕, 李培英,2,3*, 孙宗玖,2,3, 李 雯
(1. 新疆农业大学草业与环境科学学院, 新疆 乌鲁木齐 830052; 2. 新疆草地资源与生态自治区重点实验室,新疆 乌鲁木齐 830052; 3. 西部干旱区草地资源与生态教育部重点实验室, 新疆 乌鲁木齐 830052)
干旱胁迫因为有限的水分供给,会显著降低植物叶片的含水量,并导致其组织脱水;为了适应环境,植物不仅会在生理生化水平上发生响应,在分子和细胞水平上也会产生一定变化[1]。植物的抗旱过程是由多基因控制共同协调,目前在模式植物和一年生作物上,抗性适应机制研究已大量开展,并取得了显著进展[2]。袁岐[3]、胡靖康[4]和高莹梅等[5]对番茄(Solanumlycopersicum)GATA,ZF-HD和BES1转录因子家族全基因组挖掘发现了SL-ZH8,SL-ZH10等15个抗旱基因,且SlGATA17基因的下调表达,SLB3和SLB9基因沉默均可降低番茄的抗旱能力。朱虹[6]将来自甘薯(Dioscoreaesculenta)的IbWRKY2,IbGATA24,IbSDT基因转化拟南芥(Arabidopsisthaliana),发现均能提高拟南芥的抗旱性。相对而言,草坪草大多为异花授粉植物,倍性高,基因组信息不清楚,限制了其抗旱分子机制的揭示和优良抗旱基因的挖掘。
Illumina二代测序技术不需知道对应物种的全基因组序列,适合研究全基因组库未构建的物种[7]。测序通量大,成本较为低廉,被广泛应用于研究植物具有经济价值性状的关键基因,挖掘基因组层面的选择信号,驯化野生种质等方面[8-10]。目前,已在结缕草(Zoysiajaponica)[11],黑麦草(Loliumperenne)[12]和草地早熟禾(Poapratensis)[13]等草坪草研究中应用。
狗牙根(Cynodondactylon(Linn.) Pers)因其繁殖速度快,成坪时间短,耐践踏,在生产上被广泛应用[14]。狗牙根对干旱具有很强的抗性,不同品种、不同生态型间抗旱性上存在显著差异[15]。Shi[16]和Lu等人等人[17]通过研究发现,水分再分配、渗透物质积累和抗氧化防御系统的变化可能是狗牙根种质间抗旱性差异的原因之一。在分子方面,Zhou等人[18]通过转录组构建Tifway和C299的cDNA文库,共鉴定出277个干旱响应基因,认为胁迫信号、角质层蜡积累、抗氧化防御和脱水保护蛋白积累等基因的表达对暖季多年生草适应长期干旱胁迫至关重要。CdDHN4的启动子可以通过脱落酸(Abscisic acid,ABA)施用、干旱或冷处理来调节;且CdDHN4对ABA敏感,在干旱胁迫诱导下,CdDHN4启动子被激活,通过ABA依赖性信号阻止气孔开放,从而提高植株抗旱性[19]。Chen等[20]研究发现,在水稻中过度表达狗牙根胁迫响应核因子Y基因(Cdt-NF-YC1)可使其对干旱和盐的耐受性增加。新疆气候干旱,降雨量少,但狗牙根资源广泛分布,且已有研究发现不同生境狗牙根种质间抗旱性存在显著差异[21-22],是研究狗牙根抗旱性的优良种质,其抗旱分子机制有待研究。
本研究使用Illumina二代测序技术,以前期筛选获得的抗旱和敏旱狗牙根为材料,对其正常水分(土壤相对含水量为田间持水量的80%~90%),中度干旱(50%~60%)及重度干旱(20%~30%)下的叶片的mRNA进行测序,分别对得到的差异表达基因进行GO,KEGG分析和注释,探究其关键代谢通路中的差异表达基因和高表达转录因子,为狗牙根抗旱相关基因的筛选奠定基础。
1 材料与方法
1.1 实验材料与处理
以抗旱C138和敏旱C32狗牙根为材料[20],选择高40 cm,直径10 cm的PVC管作为容器,装入5.8 kg的混合花土,每管移栽5 cm长的根茎5根,每份种质移栽12管,适应生长30 d,当覆盖度达到95%以上时开始进行干旱胁迫试验。
以土壤相对含水量为标准,设置3个干旱梯度,正常灌溉土壤相对含水量80%~90%为正常灌溉,土壤相对含水量50%~60%为中度干旱胁迫,土壤相对含水量20%~30%为重度干旱胁迫,每个处理水平4次重复。对每管进行充分灌溉使其土壤含水量达到饱和,其后自然蒸发,每天测量土壤相对含水量,当各处理土壤含水量达到设定范围时,每天称重补水,维持10 d后对叶片进行取样,液氮速冻后保存于实验室—80℃超低温冰箱中备用。
1.2 文库的构建及库检
由北京百迈克生物科技有限公司对本实验样品(狗牙根C138和C32叶片)进行转录组测序。
1.3 差异基因的筛选
将材料中各自对应的中度和重度处理分别与对照两两比对,应用每千个碱基每百万映射读取的fragments数(Fragments Per Kilobase of exon model per Million mapped fragments,FPKM)方法分析基因表达水平,以差异倍数(Fold change,FC)≥4且Pvalue≤0.05为筛选标准,对之后得到的DEGs在百迈克云平台上进行GO和KEGG功能注释统计,选取Top20富集分析term进行后续分析。
1.4 实时荧光定量PCR验证
随机挑选6个基因进行实时荧光定量PCR验证,如表1所示,使用上海生物工程有限公司平台设计引物,3次技术重复,内参基因Actin,扩增体系为95℃ 30s;95℃ 10s;60℃ 30s;95℃ 15s;95℃ 1min;60℃ 15s;45个循环。

表1 PCR验证引物Table 1 PCR validation primer
2 结果与分析
2.1 测序数据与评估
测序后得到18个转录组文库。对原始数据进行筛选,去除原始数据中含有接头,N的比例大于10%、质量值Q≤10的碱基数占整条数据的50%以上的低质量数据得到过滤后数据,经过滤后共获得256.12 Gb高质量数据。由表2可知,各组Q20碱基百分比在98.23%及以上,Q30碱基百分比在94.68%及以上,说明测序建库工作质量良好。

表2 转录组数据质控Table 2 Summary of the RNA-Seq results
2.2 基因差异性表达分析
对于抗旱狗牙根C138而言,与对照组(土壤相对含水量90%~100%)相比,干旱下共获得差异表达基因1 193个,其中上调525个,下调668个;中度胁迫时差异表达基因数量为711个,其中上调基因227个,下调基因484个;重度胁迫时为482个,其中上调基因298个,下调基因184个。
与对照相比,C32干旱下共有2 031个差异基因表达,其中上调1 086个,下调927个。中度胁迫时有810个差异基因表达,其中上调基因有436个,下调基因有374个;重度胁迫时有1 203个差异基因表达,其中上调基因有650个,下调基因有553个。
中度胁迫下,两个材料共有79个共表达基因,其中有20基因共表达为下调,37个基因共表达为上调,22个基因表达无变化;C138特异响应基因632个,C32特异响应基因731个。重度胁迫下两材料共有101个共表达基因,其中有38基因共表达为下调,46个基因共表达为上调,17个基因表达无变化,C138特异响应基因381个,C32特异响应基因1 102个。与中度胁迫相比,重度胁迫下材料的上调基因均增加,但C138下调基因减少,C32下调基因增加;各干旱胁迫下特异性表达基因均大于共表达基因,说明了不同材料响应干旱的特异性,结果如图1所示。
2.3 差异表达基因的GO分析
将筛选阈值定为Pvalue≤0.01,对获得的差异表达基因进行GO注释分析,这些DEGs被富集注释到3个GO分类,分别是生物过程(Biological process),分子功能(Molecular function)和细胞组分(Cellular component)。
对差异表达基因进行TOP20 GO富集分析得到图2。与对照相比,C138在中度干旱时,有121个(50.00%)DEGs注释到分子功能,其中富集极显著的为叶绿素合成(chlorophyll binding),铁离子合成(iron ion binding)和转录因子活性(DNA-binding transcription factor activity);84个(34.71%)DEGs注释到生物过程,其中富集极显著的为光合作用(photosynthesis,light harvesting),蛋白质-发光团连锁(protein-chromophore linkage)和次级代谢过程调控(regulation of secondary metabolic process);37个(15.28%)DEGs注释到细胞组分中的3条极显著通路,即叶绿体类囊体(chloroplast thylakoid membrane),光合系统I(photosystem I)和光系统II(photosystem II);重度干旱时有54个(55.10%)DEGs注释到分子功能,其中富集极显著的为水解酶活性与O-糖基化合物的水解(hydrolase activity,hydrolyzing O-glycosyl compounds),萜烯合成活性(terpene synthase activity)和硫醇酯水解酶活性(thiolester hydrolase activity);有13个(13.28%)DEGs注释到细胞组分,只富集到胞外区(extracellular region)和锚定质膜组分(anchored component of plasma membrane);有45个(45.92%)DEGs注释到生物过程,其中富集极显著的为次级代谢过程(regulation of secondary metabolic process),线粒体钙离子稳态(mitochondrial calcium ion homeostasis)和碳水化合物代谢过程(carbohydrate metabolic process)。

图2 各材料及处理间差异基因Top 20 GO term富集图Fig.2 Enrichment map of Top 20 GO term of differential genes between two different materials and treatments注:A为CL138 vs ML138;B为CL138 vs SL138;C为CL32 vs ML32;D为CL32 vs SL32;E为ML138 vs ML32;F为SL138 vs SL32Note:Panel A, CL138 vs ML138;Panel B, CL138 vs SL138;Panel C, CL32 vs ML32;Panel D, CL32 vs SL32;Panel E, ML138 vs ML32. Panel F, SL138 vs SL32

图3 干旱胁迫下两份材料代谢通路图中DEGs变化Fig.3 Changes of DEGs in the metabolic pathway of two material under drought stress注:A为C138中与丙氨酸、天冬氨酸和谷氨酸代谢途径相关的DEGs表达热图;B为C138中氮代谢途径相关的DEGs表达热图;C为C138苯并恶嗪类生物合成途径DEGs表达热图补充;D为C32中与丙氨酸、天冬氨酸和谷氨酸代谢途径相关的DEGs表达热图;E为C32中氮代谢途径相关的DEGs表达热图;F为C138中苯并恶嗪类生物合成途径相关的DEGs表达热图Note:Panel A is heat map of DEGs expression related to Alanine,aspartate and glutamate metabolism in C138; Panel B is heat map of DEGs expression related to nitrogen metabolism in C138; Panel C is heat map of DEGs expression related to benzoxazinoid biosynthesis in C138; Panel D is heat map of DEGs expression related to alanine,aspartate and glutamate metabolism in C32; Panel E is heat map of DEGs expression related to nitrogen metabolism in C32; Panel F is heat map of DEGs expression related to benzoxazinoid biosynthesis in C32

图4 各材料及处理间样品差异基因Top 20 KEGG富集图Fig.4 Enrichment map of Top 20 KEGG differential genes among different materials and treatments注:A为CL138 vs ML138;B为CL138 vs SL138;C为CL32 vs ML32;D为CL32 vs SL32;E为ML138 vs ML32;F为SL138 vs SL32Note:Panel A, CL138 vs ML138; Panel B, CL138 vs SL138; Panel C, CL32 vs ML32; Panel D, CL32 vs SL32; Panel E, ML138 vs ML32; Panel F, SL138 vs SL32
C32中度干旱时,有64个(43.54%)DEGs注释到分子功能,其中富集极显著的为谷氨酸合成酶活性[glutamate synthase (NADH) activity],核酸酶活性(nuclease activity)和铁离子合成(iron ion binding);有22个(14.97%)DEGs注释到细胞组分,只富集到叶绿体(chloroplast);有61个(41.49%)DEGs注释到生物过程,其中富集极显著的为谷氨酸生物合成过程(glutamate biosynthetic process),对蓝光的响应(response to blue light)和向光性(phototropism)。重度干旱时有187个(67.75%)DEGs注释到生物过程,其中极显著的为谷氨酸生物合成过程(glutamate biosynthetic process)和向光性(phototropism);有89个(32.24%)DEGs注释到分子功能,其中极显著的为谷氨酸合成酶活性[glutamate synthase (NADH) activity]和ADP结合(ADP binding)等,在细胞组分上无富集差异基因。
中度干旱时期,2个材料差异基因功能GO分析最显著的主要集中于谷氨酸生物合成过程(glutamate biosynthetic process),谷氨酸合成酶活性[glutamate synthase (NADH) activity],铁离子合成(iron ion binding)和半胱氨酸-tRNA氨基酰化(cysteinyl-tRNA aminoacylation)等;重度干旱时期,2个材料差异基因功能GO分析最显著的主要集中于伤害反应(response to wounding),细胞对饥饿的反应(cellular response to starvation)和对饥饿的反应(response to starvation)。
2.4 差异表达基因的KEGG分析
KEGG Top20富集途径显示,中度干旱胁迫下C138中差异表达基因主要富集在光合作用天线蛋白(Photosynthesis-antenna proteins),卟啉与叶绿素代谢(Porphyrin and chlorophyll metabolism)和二萜类生物合成(Diterpenoid biosynthesis);C32中基因主要富集在氮代谢(Nitrogen metabolism),类黄酮生物合成(Flavonoid biosynthesis)和昼夜节律-植物(Circadian rhythm-plant);重度干旱胁迫下C138中差异表达基因主要富集在类黄酮生物合成(Flavonoid biosynthesis);C32中基因主要富集在昼夜节律-植物(Circadian rhythm-plant),氮代谢(Nitrogen metabolism)和苯并恶嗪类生物合成(Benzoxazinoid biosynthesis)。
中度胁迫下,2个材料差异基因功能KEGG富集通路主要集中在氮代谢(Nitrogen metabolism)和丙氨酸,天冬氨酸和谷氨酸代谢(Alanine,aspartate and glutamate metabolism),在重度胁迫下,2个材料差异基因功能KEGG富集通路主要集中在苯并恶嗪类生物合成(Benzoxazinoid biosynthesis)。
通过对两份材料中富集最显著的3条代谢通路里的差异基因表达状况绘制热图可以看出,丙氨酸、天冬氨酸和谷氨酸代谢途径中(ko00250),C138在谷氨酸和天冬氨酸合成途径中有差异基因富集,C32则在3个氨基酸代谢途径中均有富集,其中,两份材料的合成谷氨酸过程均由GLT1基因控制,其中TVU00531.1和TVT97435.1在两份材料中均表达,且表达模式相同,VAH79012.1在C138中不表达,在C32中表达显著,具体功能有待进一步研究。两份材料氮代谢途径中(ko00910),均有L-谷氨酸的参与;属于NRT的TVU34107.1基因在C138中参与硝酸盐合成L-谷氨酸的过程,在轻度干旱下上调表达,中、重度下调表达,但在C32中,负责合成亚硝酸盐,且在中度胁迫时高度表达。在苯并恶嗪类生物合成途径中(ko00402),吲哚类物质合成的BX1和BX2基因和表达模式大部分相同,但属于BX2的OEL15381.1基因在C32中重度干旱下表现为上调,轻度和中度先为下调,在C138中不表达。VAH79012.1和OEL15381.1都在C138中不表达,在C32中表达显著,这些基因可能与狗牙根两份材料之间的抗旱性差异有关。
2.5 干旱胁迫下差异表达转录因子(TFs)的变化
将干旱胁迫下狗牙根叶片的差异表达基因与NCBI数据库进行比对(图5),C138中鉴定出42个转录因子,其中26个下调,16个上调,包括转录因子数量最多的家族是AP2/ERF(9),bZIP(5),MYB(5)和WRKY(6)家族,大部分的上调转录因子属于AP2/ERF(5),bZIP(3)和MYB(3)家族,下调最多的转录因子属于WRKY(5)和AP2/ERF(3)家族;C32中鉴定出39个转录因子其中22个上调,17个下调,转录因子最多的家族是MYB(5),AP2/ERF(4)和bHLH(4)家族,大部分的上调转录因子属于MYB(4)和AP2/ERF(3)家族,下调最多的转录因子属于bHLH(3),GARP-G2(3)和Tify(3)家族。其中有5个转录因子是两个材料所共有的,包括AP2/ERF(3),bZIP(1)和MYB(1)家族。如图5C所示,除c475644.graph_c0(AP2/ERF)基因在CL138中下调表达,其他基因均上调表达,尤其是c474046.graph_c0(MYB)基因在SL32和ML32中上调表达明显。
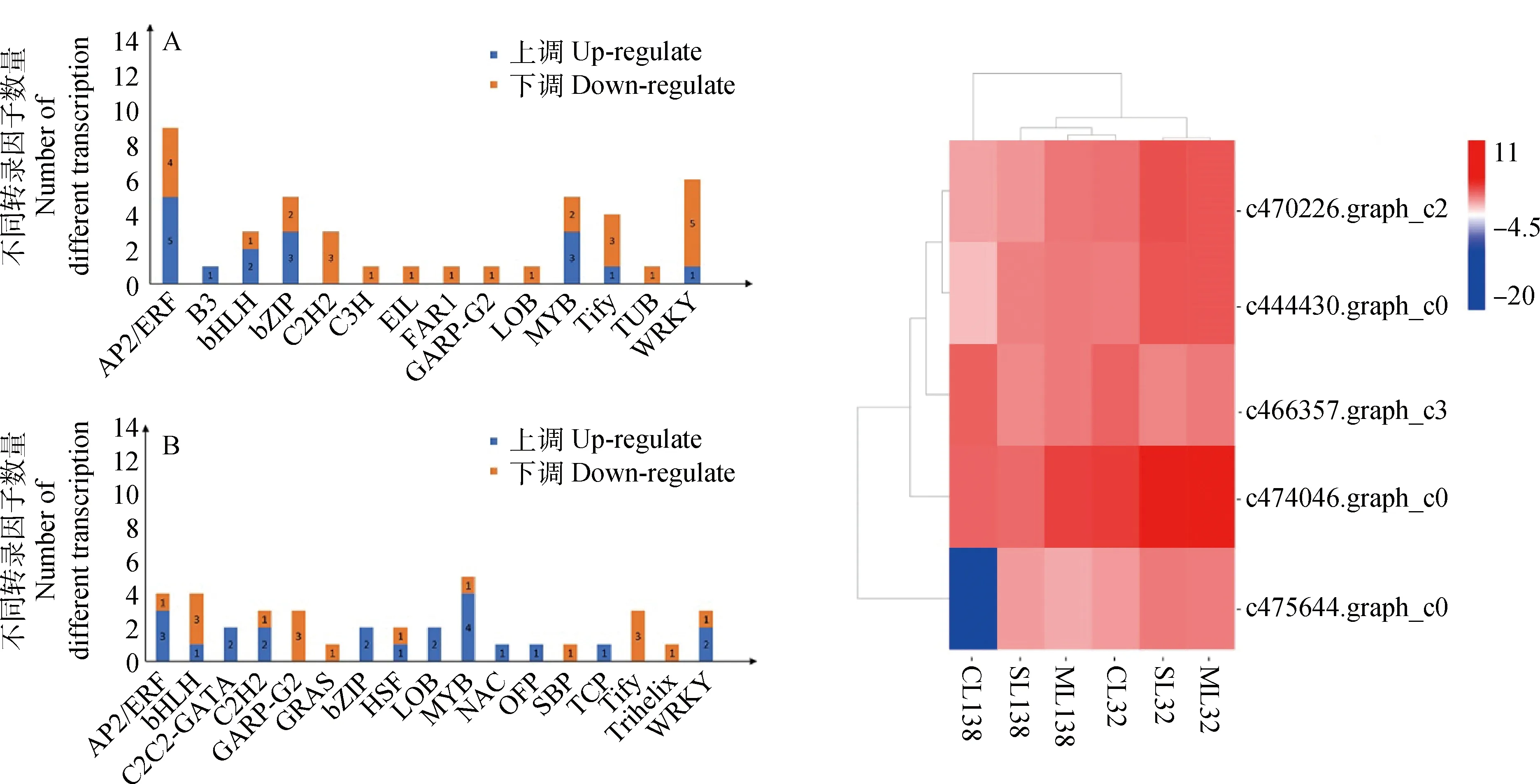
图5 干旱胁迫下狗牙根叶片差异表达转录因子的分布Fig.5 The histograms show the number of up- and down-regulated transcription factors注:A为Cd138叶片;B为Cd32叶片;C为共表达差异基因DEG-TF的分级聚类Note:Panel A is histogram of C138 leaf transcription factors; Panel B is histogram of C32 leaf transcription factors; Panel C is hierarchical clustering of DEG-TF co-expression genes
2.6 干旱胁迫下差异表达转录因子(TFs)的变化
为验证RNA-Seq测序试验结果准确性,随机挑选6个基因进行实时荧光定量PCR验证。如表1所示,使用上海生物工程有限公司平台设计引物,3次技术重复,以Actin为内参进行qRT-PCR试验。由图6可知,6个基因在干旱胁迫下表达趋势与测序结果基本一致,说明测序结果有效。
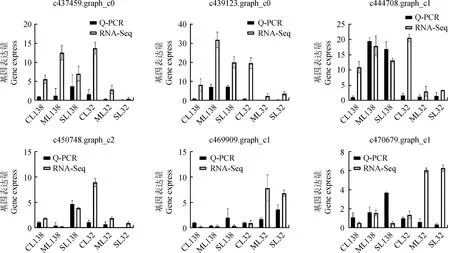
图6 实时荧光定量PCR结果Fig.6 Results of real-time fluorescent quantitative PCR
3 讨论
本研究结果显示,受到干旱胁迫后,敏旱型C32干旱胁迫响应基因数为2 031个,大于抗旱型C138干旱胁迫响应基因数,尤其是在重度干旱胁迫下。Fracasso等[23]对两种不同耐旱程度高粱(Sorghumbicolor)研究发现,敏旱型高粱中有更多的差异基因表达,与本研究结果一致。Kim等[24]对狗牙根幼苗进行干旱转录组分析,发现干旱处理3,6,9 d的上调基因数量大于下调基因,这与本研究结果一致。冷暖等[13]对干旱胁迫15 d草地早熟禾进行转录组分析,发现有52.25%的差异基因上调表达;但张然等[25]对草地早熟禾抗旱材料10-202和敏旱材料09-61进行干旱3 d后的转录组分析发现,10-202材料有3 166个差异基因表达,09-61中有314个基因表达。这可能与干旱胁迫的时间和材料所处的物候期有关,具体原理还需进一步分析。本研究中,两个材料胁迫时上调基因数目都有所增加,说明干旱胁迫下狗牙根叶片可能是通过基因的正调控来响应干旱的。
光合作用对植物生长和适应干旱胁迫具有重要意义。干旱胁迫通过抑制光合作用,降低植物碳水化合物的产生,减少植物生长和代谢所需的能量供给,使植物无法抵御外界的伤害。严平等[26]研究认为干旱胁迫下的小麦光合作用下降主要是由于气孔导度下降所导致;但Boyer等[27]认为,光合器官对光合作用的影响至关重要,光合作用下降主要是由于光合器官叶绿素的解体[28]、光系统II活性下降[29],而且叶绿体是植物中产生活性氧的主要场所。本研究显示中度干旱胁迫下,C138GO功能最富集的为蛋白质-发色团连锁、光合作用和采光,叶绿体类囊体膜、叶绿素合成、光系统I和光系统II,而在C32中则富集较少甚至都没有富集到这些。张一龙等[30]研究结果表示,干旱胁迫下C138保持较高的类胡萝卜素含量来应对干旱,其叶绿素含量也高于C32,说明可能是C138受到干旱胁迫时,在光合作用相关植物器官上富集了更多的基因,能生成更多的ATP、叶绿素和类胡萝卜素来抵御干旱。
光合作用抑制主要是由于早期或轻度干旱胁迫期间的气孔关闭,而在暖季草坪草中,长时间干旱后代谢作用的限制可能更为重要。草地早熟禾耐旱品种‘Midnight’在长期干旱(10至15 d)复水后光合能力迅速恢复到对照水平,可能是因为光合作用固碳受损较少[31];肖烈等[32]发现,白羊草可以通过提高体内碳水化合物含量(如淀粉、可溶性糖)来应对不同程度的干旱胁迫。Hu等人[33]表示,与敏旱型狗牙根C299相比,耐旱型狗牙根Tifway光合作用能力要更强,这主要是由于Tifway具有更稳定的碳同化产物。本研究显示重度干旱胁迫下,C138大部分显著富集到了碳水化合物代谢过程、细胞糖代谢过程、碳水化合物代谢调控过程等能量代谢过程,C32大部分显著富集在DNA分解过程、DNA整合、ADP结合、DNA分解过程等细胞分裂过程。这与张一龙等[34]研究结果一致,即C32中度胁迫时的叶宽与重度胁迫相比变化不显著,而C138在干旱下比C32有更多的碳水化合物合成。
植物次生代谢产物在其应对极端环境时在自身保护和生存竞争上充当着重要角色。Chen等[35]对5种不同低温处理下的叶片的转录组分析表明,光合作用、氮代谢和碳固定途径在狗牙根对冷胁迫的反应中起关键作用。也有研究表明干旱特别是在长期干旱胁迫下,羊草叶片中氮合成代谢的关键酶活性显著降低[36]。Brini等[37]在对拟南芥氨基酸转运蛋白的研究中认为氨基酸转运是植物氮分配的主要机制,氨基酸转运蛋白对渗透胁迫有重要作用。王玉斌等人[38]对不同抗旱型高粱的研究显示,耐旱型高粱中KEGG途径显著富集在苯丙氨酸合成等氨基酸渗透保护途径上。李春燕等人[39]对干旱胁迫下白羊草苗期叶片进行基因表达分析发现,类黄酮化合物生物合成在叶片中显著富集。本研究显示,C138和C32干旱胁迫响应基因在二萜类生物合成、苯并恶嗪类生物合成、类黄酮生物合成、氮代谢、精氨酸与脯氨酸代谢、淀粉和蔗糖代谢、组氨酸代谢、氨基酸生物合成、丙氨酸、天冬氨酸和谷氨酸代谢等代谢通路上有所富集,可见狗牙根的干旱胁迫响应通路主要涉及生物合成和生物次级代谢。C32干旱胁迫基因显著富集在氮代谢上,所以氮代谢可能是C32应对干旱胁迫的主要途径之一;C138中,干旱胁迫基因主要富集在光合作用蛋白、丙氨酸、天冬氨酸和谷氨酸代谢上。所以,C138可能通过积累可溶性糖和氨基酸(如丙氨酸,谷氨酸)等渗透压物质来应对干旱胁迫。
通过测序分析,本研究一共获得了来自18个转录因子家族的81个转录因子。其中AP2/ERF家族基因数量最多。Zhu等人[40]对抗寒和不抗寒两种狗牙根进行转录组分析发现,AP2转录因子高度表达是狗牙根抗寒的重要因素。Matuskura等[41]发现,在拟南芥中过量表达水稻(Oryzasativa)OsDREB2B基因,提高了拟南芥对干旱和热胁迫的耐受性。吴婧等人[42]研究发现,ERF同源基因在干旱处理的蒙古冰草(Agropyronmongolicum)中表达差异显著。本研究中3个AP2/ERF基因在干旱胁迫下的狗牙根中均高度表达,其中1个基因在CL138中不表达,在ML138和SL138中均高度表达,但在C32中未见明显变化。说明AP2/ERF转录因子可能受干旱胁迫诱导表达,但干旱胁迫下狗牙根AP2/ERF转录因子未见详细研究,此前狗牙根AP2/ERF转录因子大部分集中在抗寒方面,所以AP2/ERF转录因子可能是狗牙根抗旱关键转录因子之一。
4 结论
狗牙根受到干旱胁迫时敏旱材料响应基因数量更多,且主要通过基因的正调控来响应干旱。丙氨酸、天冬氨酸和谷氨酸代谢(ko00250),氮代谢(ko00910)和苯并恶嗪类生物合成(ko00402)中的特异性差异表达基因可能是狗牙根应对干旱胁迫的关键基因。C138受到干旱胁迫时有更多的光合作用相关基因响应,氮代谢可能是C32应对干旱胁迫的主要途径之一。中度胁迫下狗牙根抗旱可能与光合作用和碳水化合物合成有关,重度胁迫下次生代谢和渗透保护可能是狗牙根抗旱的重要富集途径。

