小黑麦SWEET家族基因鉴定及其在不同逆境下表达模式分析
李 根, 牛奎举
(甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧可持续发展研究中心,甘肃 兰州 730070)
在植物体可以利用的养分中,糖是生物体主要的碳源和能量来源[1],同时也是一种重要的信号分子。在高等植物的叶肉细胞中,叶绿体可以通过光合作用将二氧化碳转化为有机碳固定,使光合作用产生糖[2-4]。然而,糖不能通过植物细胞膜系统独立运输,需要适当的糖转运体的协助[2],目前主要发现有三类蛋白,即单糖转运体(Monosaccharide transporters,MSTs)[5],蔗糖转运体(Sucrose transporters,SUTs)[6-7]和糖外排转运蛋白(Sugars will eventually be exported transporters,SWEETs)[8]。在过去的20年里,糖转运蛋白的前两个基因家族MSTs和SUTs在高等植物中得到了广泛的研究[9],而SWEETs基因家族是近些年来被确定为糖外排体,其成员在已糖或蔗糖跨细胞膜转运过程中发挥了重要作用[10],但是人们对其功能了解尚不完全。
SWEETs广泛存在于真核与原核生物,是一类不依赖于环境pH值,仅利用细胞内外的浓度差来实现糖类的双向可逆转运功能的糖转运蛋白家族[10]。真核SWEETs蛋白通常由七个α-螺旋跨膜结构域(7α-helical transmembrane domain,7-TMs)组成,这些结构域由两个3-TM结构域(包含两个保守的MtN3/saliva)串联重复组成,由一个保守程度较低的跨膜螺旋连接,并使其分开,该跨膜螺旋结构通常被称为3-1-3TM SWEET结构[11]。研究发现,SWEETs糖转运蛋白家族成员能够参与调控植物对非生物胁迫的响应过程。拟南芥(Arabidopsisthaliana)AtSWEET15在叶片衰老和渗透胁迫(包括高盐、寒冷和干旱)会受到脱落酸(Abscisic acid,ABA)信号诱导,过表达AtSWEET15会使植株叶片衰老加速,对高盐胁迫敏感,而缺乏AtSWEET15的突变株对高盐敏感性降低[12]。在寒冷胁迫下,在拟南芥中过表达茶树[Camelliasinensis(L.)O. Ktze.]CsSWEET1a和CsSWEET17,转基因株系与野生型相比,相对电导率显著降低,蔗糖转化酶AtCWINVs和AtVACINVs基因的表达被抑制,从而有效提高拟南芥抗冻性[13]。拟南芥AtSWEET11和AtSWEET12与寒冷及干旱胁迫相应有着密切联系,AtSWEET11,AtSWEET12双突变体比野生型和单突变体表现出更强的抗冻性[14]。
小黑麦(×Triticosecale)是一种由人类创制的自花授粉的谷类作物,是由小麦(Triticumspp.)和黑麦(Secalecereale)杂交而成的新物种,在世界各地广泛种植。它结合了小麦优越的农业形态、最终利用品质特征和黑麦的强适应性、高活力、对非生物和生物胁迫的优质抗性,作为优良的一年生粮饲兼用作物在世界范围内广泛种植[15-17],为缓解牧区草畜矛盾,保护生态环境,促进草地畜牧业可持续发展发挥了重要作用。但其在生长发育过程中也同样易受到环境胁迫,严重时会影响牧草的饲用品质及产量。因此,培育高产抗逆的优质小黑麦品种十分必要。随着现代分子生物学和生物信息学技术的发展,草类植物响应环境胁迫的机理研究已从最初的形态、生理水平逐渐发展到转录、翻译及大分子物质网络互作调控等分子机制层面[18]。截至目前,很多研究表明SWEETs糖转运蛋白与生物及非生物胁迫响应联系密切,但小黑麦SWEETs家族参与响应非生物胁迫的研究较少。因此,本研究对小黑麦SWEETs基因家族进行了鉴定,并系统分析了SWEET基因的结构特点、保守基序、蛋白质结构等基本特征,在此基础上进一步分析了TwSWEETs在近源及模式植物间的进化关系,同时对其在小黑麦叶片和根部在不同逆境胁迫下的基因表达情况进行了深入分析。本研究为进一步了解SWEETs基因在调节植物发育过程中糖的积累和分配及它们在非生物胁迫中发挥的作用奠定理论基础,进而有助于优良基因资源的挖掘和新品种培育。
1 材料与方法
1.1 试验材料
选用‘石大一号’品种小黑麦,由本实验室保存并提供。
1.2 试验方法
1.2.1小黑麦TwSWEETs基因家族的鉴定 拟南芥、水稻(OryzasativaL.)、小麦(TriticumaestivumL.)和玉米(ZeamaysL.)的SWEETs基因蛋白序列可直接从NCBI数据库中下载(https://www.ncbi.nlm.nih.gov/),并根据拟南芥和水稻的SWEET蛋白序列作为鉴定小黑麦TwSWEETs的请求序列,以本课题组已有的多个小黑麦转录组数据作为本地数据库。使用BioEdit Sequence Alignment Editor软件进行搜索比对,Program选择‘tblastn’,Expectation Value:E-20,搜索比对小黑麦的SWEET基因家族蛋白序列。
1.2.2小黑麦TwSWEETs蛋白序列理化性质分析 使用在线ExPAsy-ProtParam工具(https://web.expasy.org/protparam/)分析小黑麦TwSWEETs蛋白序列的理化性质,包括氨基酸数量、分子量、理论等电点、不稳定性指数、脂肪族指数和总平均亲水性[19];使用TMHMM在线工具预测跨膜螺旋结构(TMHMM 2.0-DTU Health Tech-Bioinformatic Services)[20];使用ProtComp v. 9.0在线工具[Plant-mPLoc server(sjtu.edu.cn)]初步预测亚细胞定位[21];使用SOPMA在线工具对蛋白质的二级结构进行预测[NPS@:SOPMA secondary structure prediction (ibcp.fr)];使用SWEISS MODEL在线工具对蛋白质的三级结构进行预测(https://swissmodel.expasy.org/)[22-26]。
1.2.3小黑麦TwSWEETs蛋白序列系统进化树及保守基序分析 利用在线工具MEME(http://meme-suite.org/)对小黑麦的SWEET糖转运蛋白的氨基酸序列进行保守基序分析[27]。利用MEGA 11.0软件中的最大似然法构建16条小黑麦、59条小麦、17条拟南芥、21条水稻和29条玉米的基序系统进化树。
1.2.4小黑麦幼苗生长条件及非生物胁迫处理 采用土培法育苗,将小黑麦‘石大一号’种子用无菌水过夜浸泡,冲洗数次后进行消毒处理,然后种植于育苗钵中,放置在甘肃农业大学草业学院生长室中。昼夜温度为25℃/20℃,每天光周期循环14 h,相对湿度为50%。待生长14天后,选择长势均一的幼苗进行非生物胁迫处理。试验设置3组处理,每组处理4个重复。对照处理(CK)为正常纯净水浇灌;干旱处理为20% PEG6000浇灌种植土壤,处理后放置于生长室中;低温处理设置温度为4℃,放置于低温光照培养箱。分别于处理3 h,6 h,12 h和24 h采集叶片和根系并放入液氮中快速冷冻,保存于-80℃冰箱。
1.2.5RNA提取和实时定量PCR(qRT-PCR)分析 RNA提取使用天根生物科技有限公司(中国)的总RNA提取试剂盒(离心柱型),货号#DP419。然后使用宝生物(Takara)大连有限公司的PrimerScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒合成cDNA,货号R047A。具体试验步骤按照制造商的说明进行。
使用在线工具Primer BLAST(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计了小黑麦TwSWEETs基因的特异引物,由西安擎科生物科技有限公司合成。qRT-PCR使用天根生化科技(北京)有限公司的SuperReal RreMix Plus(SYBR Green)荧光定量试剂盒,货号FP206-02。20 μL反应总体积包括5 μL稀释模板(20 μL cDNA用180 μL ddH2O稀释20倍)、3 μL ddH2O,1 μL上游和1 μL下游引物(10 μmol·L-1)和10 μL 2×SuperReal PreMix Plus(SYBR Green)。反应过程在LightCycler®96仪器(中国上海Roche)上进行。反应程序为:95℃预变性15 min,PCR反应为95℃变性10 s和58℃退火30 s,40次循环,熔解曲线分析保留默认,为95℃持续1 s,65℃持续15 s,95℃持续1 s。每个处理设置三次生物学重复,每个生物学重复设置4次技术重复,去掉极端数值。使用2-ΔΔCt方法计算相对基因表达值[28]。选用Actin(ACT)作内参基因,除TwSWEET6b-1和TwSWEET6b-2没有合适的引物以外,其余14条小黑麦TwSWEETs基因特异性引物如表1所示。
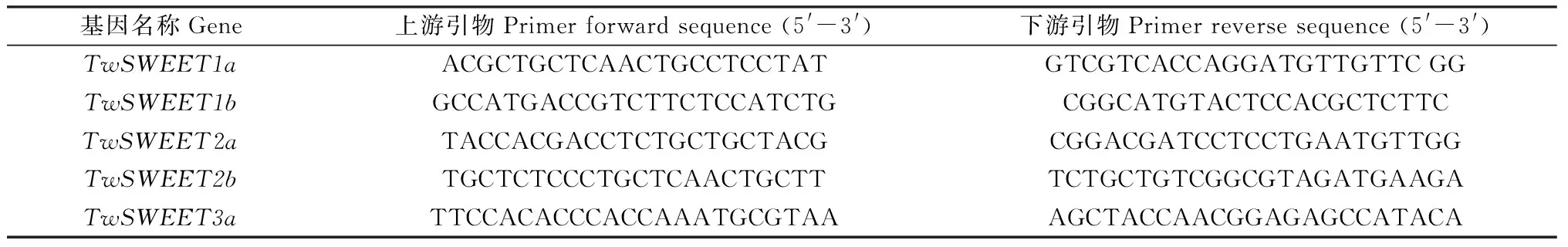
表1 qRT-PCR引物序列表Table 1 Primers used in this study for qPCR
1.2.6数据分析 采用SPSS 24.0 Windows版(SPSS Inc.,USA)进行数据分析,用平均值和标准误表示测定结果,对照组与不同时间的处理组采用t检验,采用GraphPad Prism 8.0.2软件绘制柱状图。
2 结果与分析
2.1 小黑麦TwSWEET基因家族的鉴定及理化性质分析
通过对比分析在小黑麦本地转录组数据库中获得16条序列,并将其命名为TwSWEET1a,TwSWEET1b,TwSWEET2a,TwSWEET2b,TwSWEET3a,TwSWEET4,TwSWEET6a,TwSWEET6b-1,TwSWEET6b-2,TwSWEET11,TwSWEET12,TwSWEET13,TwSWEET14,TwSWEET15,TwSWEET16和TwSWEET17。
如表2所示,16条小黑麦TwSWEETs蛋白序列编码的氨基酸数目在231(TwSWEET2b)到311(TwSWEET12)之间,平均约270个氨基酸,分子质量在25.428 KD到33.913 KD之间。除TwSWEET1a/12/17的理论等电点(Theoretical isoelectric point,pI)小于7外,其余蛋白的pI都大于7,属于碱性蛋白质。根据蛋白质不稳定系数是否大于40可将其分为稳定蛋白(小于40)和不稳定蛋白(大于40)。分析发现,16条小黑麦TwSWEETs蛋白中有10条属于稳定蛋白,6种属于不稳定蛋白。另外,16条小黑麦TwSWEETs蛋白脂肪指数在108.86到123.40之间,亲水性(Grand average of hydropathicity,GRAVY)均大于零,说明它们都是疏水性蛋白。对TwSWEETs蛋白的跨膜螺旋结构(Transmembrane helices,TMH)预测发现,小黑麦TwSWEETs家族包含6~7个TMHs,约70%的成员拥有7个TMHs;此外,对这些蛋白的亚细胞定位初步预测结果发现,它们多数都定位于质膜(Plasma membrane,PM)上,少数SWEETs基因存在多种定位结果。

表2 小黑麦TwSWEETs蛋白序列理化性质分析Table 2 Physicochemical properties analysis of TwSWEETs protein sequence in triticale
2.2 小黑麦TwSWEETs编码的蛋白质二级和三级结构预测
如表3和图1所示,16条TwSWEETs编码的蛋白质二级结构均由α-螺旋结构、无规则卷曲结构、β-转角结构和延伸链组成,但各结构所占比例有所差异。在所有TwSWEETs蛋白质中,绝大多数蛋白质α-螺旋结构相比其他结构所占比例最高,除TwSWEET3a/4/6a/6b-1/11/12/13外,其余TwSWEETs的α-螺旋结构所占比例均高于40%。无规则卷曲结构所占比例在27.71%~40.84%之间,平均为34.45%,β-转角结构在四种结构中所占比例最低,其中,TwSWEET11的β-转角结构占比为2.64%,在所有小黑麦TwSWEETs家族成员中占比最低,TwSWEET16的β-转角结构占比最高,为5.02%。延伸链在16条TwSWEETs家族成员中的占比有所浮动,在12.37%~25.91%之间。综合分析发现,α-螺旋结构和无规则卷曲结构是小黑麦TwSWEETs家族成员基因结构的主要构成元件。

图1 小黑麦TwSWEETs编码的蛋白质二级结构Fig.1 Protein secondary structure encoded by TwSWEETs in triticale注:蓝色为α-螺旋;绿色为β-折叠;黄色为无规则卷曲;红色为延伸链Note:Blue,Alpha helix;green,Beta turn;yellow,Random coil;red,Extended strand
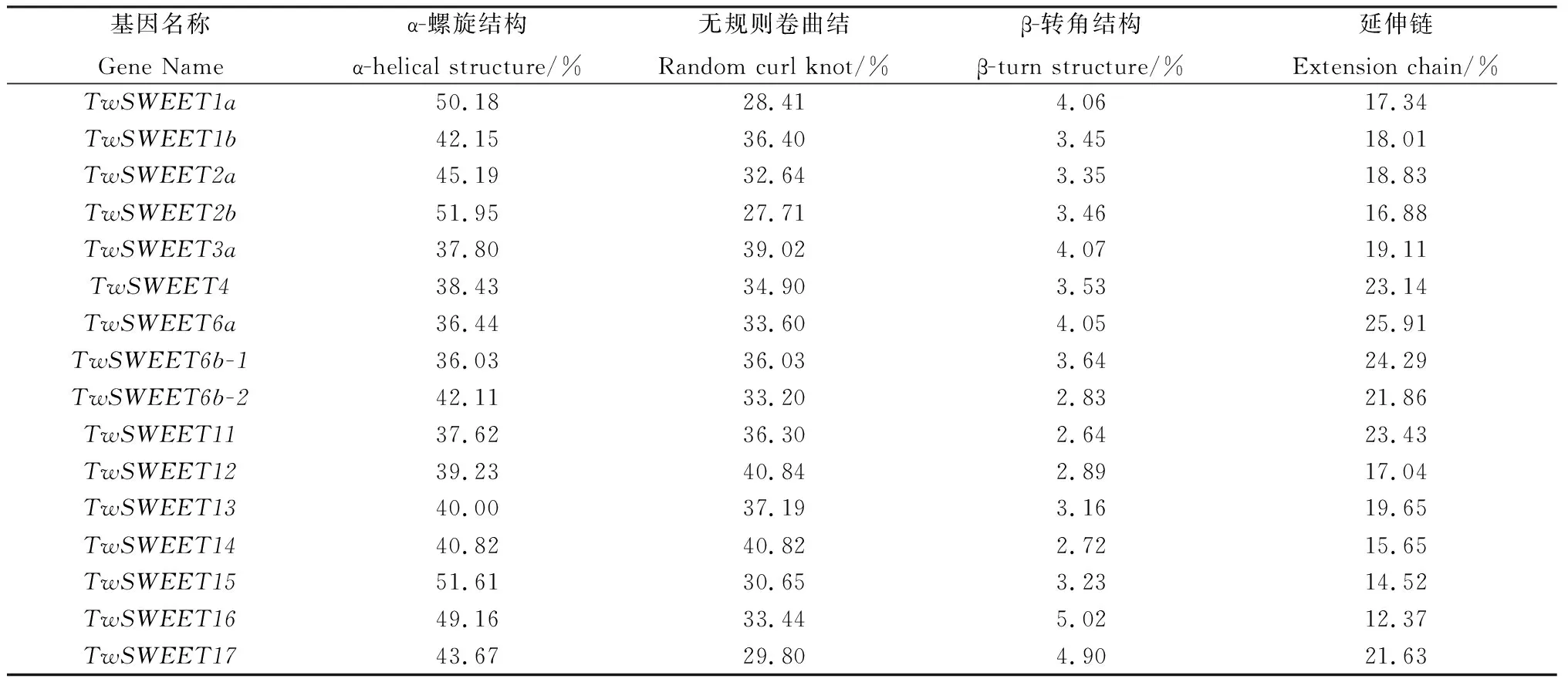
表3 小黑麦TwSWEETs编码的蛋白质二级结构预测Table 3 Prediction of protein secondary structure encoded by triticale TwSWEETs
小黑麦TwSWEETs家族成员蛋白质三级结构预测结果表明(图2),TwSWEET1a和TwSWEET1b的三级结构基本相同,TwSWEET2a和TwSWEET2b的三级结构预测结果也基本一致。TwSWEET6a/6b-1/6b-2的三级结构有较大的相似程度。TwSWEET12/13/14/15/16/17的蛋白质三级结构差异较大,但α-螺旋结构仍然是主要的组成结构原件。
2.3 小黑麦TwSWEETs蛋白序列的保守基序(motif)分析
基于保守基序分析发现,16小黑麦TwSWEETs蛋白由10个motif组成(图3),16条TwSWEETs蛋白质均含有motif 1/2/3/4/5,保守性较强。motif 6在TwSWEET6a/6b-1/6b-2中出现。motif 7在TwSWEET1a/1b/4/6a/6b-1/6b-2/13/14中出现,但位置有所不同。motif 8在TwSWEET4/6a/6b-1/6b-2中出现。
如图4所示,基序的长度范围在8~50个氨基酸之间,其中motif1和motif2的基序长度均为50个氨基酸,且均含多个保守的氨基酸残基位点,如motif 1中的甘氨酸(G,1,3)、脯氨酸(P,15,35)、亮氨酸(L,40)、酪氨酸(Y,36,49)和苏氨酸(T,18);motif 2中的脯氨酸(P,3,20,49)、缬氨酸(V,10,16)、酪氨酸(Y,37)、谷氨酸(E,17)、亮氨酸(L,23)、丝氨酸(S,24)和天冬氨酸(D,43)。motif 3和motif 6的基序宽度均为29个氨基酸,motif4,5,7,8,9,10的基序宽度分别为22,21,8,10,18,17个氨基酸。其中,motif6,motif 8和motif 10含有较多个保守的氨基酸残基位点,如motif6中的赖氨酸(K,1,2,3)、缬氨酸(V,6,23,25,27)和谷氨酸(E,7,28)等;motif8中的甲硫氨酸(M,1)、缬氨酸(V,2)和丝氨酸(S,3)等;motif10中的缬氨酸(V,6,8,9,12)、甘氨酸(G,11,15)和亮氨酸(L,13,14)等。此外,motif3/4/5/7/9所含有的保守氨基酸残基位点较少,其中motif3/4/5各含有1个保守位点,motif7和motif9各含有2个保守位点。motif1/2/6/8/10包含多个保守的氨基酸残基,由此推断它们可能在小黑麦的糖转运过程中发挥重要作用。

图4 MEME程序鉴定的TwSWEETs蛋白的十个基序的序列标志Fig.4 Sequence markers of ten motifs of TwSWEETs protein identified by MEME program注:在每个位点都以字母(氨基酸残基)排列的方式展示。氨基酸堆叠的总高度以位表示基序中该位点的“信息含量”。堆栈中每个字母的高度代表该位置的氨基酸的保守程度。X轴为基序的长度;Y轴为该位点的字母Note:Each site is displayed in alphabetical (amino acid residue) order. The total height of the amino acid stacking represents the information content of the site in the motif. The height of each letter in the stack represents the degree of conservation of the amino acids at that position. The X axis is the length of the motif, the Y axis is the site of the letter
2.4 小黑麦、小麦、拟南芥、水稻和玉米SWEETs糖转运蛋白序列的系统发育分析
利用最大似然法(ML)构建了小黑麦、拟南芥、水稻和玉米的SWEETs蛋白的系统发育树(图5)。结果表明,小黑麦TwSWEETs蛋白家族成员可分为四个主要分支(Clade I,Clade II,Clade III和Clade IV),其中,Clade I包括TwSWEET1a/1b/2a/2b/3a,Clade II包括TwSWEET4/6a/6b-1/6b-2,Clade III包括Tw-SWEET11/12/13/14/15,Clade IV包括TwSWEE-T16和TwSWEET17。除此之外,16条小麦的TwSWEETs与单子叶植物小麦TaSWEETs、水稻OsSWEETs和玉米ZmSWEETs具有较高的同源性,而双子叶植物拟南芥的多条AtSWEETs蛋白独立于TwSWEETs,TaSWEETs,OsSWEETs和ZmSWEETs分布,与单子叶植物中的SWEETs基因家族的亲缘关系相对较远。

图5 小黑麦、小麦、拟南芥、水稻和玉米SWEETs糖转运蛋白序列的系统发育分析Fig.5 Phylogenetic analysis of SWEETs sugar transporter sequences in triticale,wheat,Arabidopsis,rice and maize注:SWEETs蛋白被分为四个分支Note:SWEETs protein is divided into four branches
2.5 TwSWEETs在非生物胁迫下的表达模式分析
2.5.1干旱胁迫 如图6所示,干旱处理后,叶片和根中多个TwSWEETs基因的表达水平出现显著上调或下调。胁迫6 h内,TwSWEET1b/2a/6a基因的表达在叶片中显著上调,TwSWEET3a基因表达未受影响,随着胁迫时间的延长,TwSWEET1b和SWEET6a基因的相对表达量仍显著上调,于胁迫24 h时的相对表达量分别高达4.98和74.65,极显著高于对照水平(P<0.01),TwSWEET12在叶片中的表达量呈现出干旱胁迫延长后表达量显著增强的趋势,而TwSWEET1a/2b/11/13/14/15/16/17在整个胁迫过程中叶片相对表达量均显著低于对照(除TwSWEET14,12 h;TwSWEET17,3 h)(P<0.05)。根系表达模式分析发现,TwSWEET1b和TwSWEET12基因在胁迫12 h内显著下调,24 h时极显著上调表达(P<0.01)。根系TwSWEET4/11基因表达量在胁迫3 h时极显著上调(P<0.01),后随胁迫时间延长出现下调或恢复到与对照组相近水平。TwSWEET6a和TwSWEET16基因的相对表达量在胁迫24 h内均显著高于对照水平,于胁迫 24 h时的相对表达量分别为70.44和3.50。

图6 干旱胁迫下小黑麦TwSWEETs基因的表达模式分析Fig.6 Expression pattern analysis of TwSWEETs genes in triticale under drought stress注:*和**表示胁迫前后差异显著(P<0.05,P<0.01)。下同Note:The difference before and after stress was significant (*P<0.05,**P<0.01). The same as below
2.5.2低温胁迫 如图7所示,低温胁迫3 h时,叶片TwSWEET2a/2b/3a/14/16的相对表达量和对照CK相比显著升高(P<0.05),其中TwSWEET2a/2b/14的相对表达量分别为4.84,10.32,2.32,极显著高于对照水平(P<0.01),且TwSWEET16在低温胁迫24 h内均表现为积极的上调响应,叶片TwSWEET2b/16在胁迫24 h后的相对表达量达到峰值,分别约为对照组CK的35倍和15倍(P<0.01);而叶片TwSWEET1a/11/13/17(除TwSWEET1a,3 h;TwSWEET13,3 h;TwSWEET1a,3 h;TwSWEET17,3/h、6 h;)的表达在低温胁迫下受明显抑制。低温胁迫下各基因在根系中的表达分析发现,TwSWEET1a/2b/6a/11/14/16基因在胁迫期间的多个时间段内绝大多数都表现为上调表达,其中,根系TwSWEET6a和TwSWEET16在胁迫24 h时的相对表达量达到峰值,分别约为对照组CK的25倍和17倍,极显著高于对照水平(P<0.01)。而根系TwSWEET2a/4/12/13/15基因的表达均受到低温胁迫的显著抑制(除TwSWEET15,24 h外)。

图7 低温胁迫下小黑麦TwSWEETs基因的表达模式分析Fig.7 Expression pattern analysis of TwSWEETs genes in triticale under low temperature stress
3 讨论
糖不仅是植物生长和细胞代谢的能量和碳源,也是重要的信号分子[29-30]。SWEETs糖转运蛋白家族不仅可以控制细胞内外及细胞器间糖的供应和分布,影响植物的“库-源”运输,而且在协调植物生长发育和逆境胁迫中也发挥重要作用[31-32]。本研究共鉴定到16条小黑麦TwSWEETs家族蛋白,较小麦、水稻、玉米等禾本科植物的成员数目少一些。一方面可能是因为小黑麦尚无全基因组,试验所采用的数据库仅为转录组数据库,可能查找不全;另一方面可能是由于小黑麦自身在进化和亲本杂交的过程中基因组发生了丢失现象[33]。对TMHs预测发现,11个TwSWEETs蛋白有7个TMHs结构,约占TwSWEETs基因总数的70%。5个TwSWEETs蛋白的TMHs少于7个,其中,TwSWEET1a/1b/6a/6b-2/17具有6个TMHs。研究表明,基因在不断的进化过程中会伴随外显子化、丟失和插入等情况的发生,这可能是造成SWEET基因的TMHs少于7个的原因,Zhang等人[34]对草地早熟禾(Poapratensis)的SWEET家族分析发现,PpSWEETs家族成员存在4~7个TMHs[34-35],与本文的研究结果一致。
本研究基于SWEETs蛋白家族的系统发育分析,可将其根据蛋白质的同源性分为4个分支。前人研究结果表明,SWEETs家族不同分支运输不同的糖。Clade I(SWEET1/2/3)和Clade II(SWEET 4/5/6/7/8)主要用于运输葡萄糖和果糖,也可以运输蔗糖;Clade III(SWEET9/10/11/12/13/14/15)主要用于蔗糖的高效转运[36],最近的一项研究结果表明,如SWEET14和SWEET15能够参与激素信号调控,可调节对赤霉素的反应[37];Clade IV(SWEET16/17)是一种液泡膜转运体,研究发现其主要用于运输叶片和根液泡膜中果糖[38]。本研究结果发现,小黑麦TwSWEETs家族也被分为4个分支,与前人研究结果一致,通常情况下,相似的结构意味着相似的功能,因此可推断出小黑麦中不同蛋白成员转运的糖类及功能不同,但每条蛋白具体的功能还需进一步深入研究。此外,研究发现,小黑麦TwSWEETs与禾本科其他作物同源性较高,且与双子叶植物拟南芥相比,禾本科作物均没有SWEET8和SWEET9,说明SWEET基因家族在单、双子叶植物进化上存在差异。
糖是生物体维持正常生长发育、繁殖、代谢活动不可缺少的基础组分。非生物胁迫会干扰植物体的代谢和光合活动,导致糖稳态被破坏。多项研究结果表明,植物在胁迫环境下,体内会积累大量可溶性糖,以此来降低体内渗透势,维持正常生长,提高了植物抗逆能力[39]。SWEETs糖转运蛋白能够参与细胞器间、细胞间和组织器官间的糖转运过程,同时积极参与植物对非生物胁迫的响应[40]。
姚利娜对茶树中发现,AtSWEET4过表达植株中也积累了大量的葡萄糖和果糖,提高了植物的抗冻性[13]。在本研究中,干旱胁迫3 h时,叶片和根系TwSWEET4均出现显著上调表达,低温胁迫下,TwSWEET4表达均受到抑制,表明TwSWEET4参与了干旱和低温胁迫的应答,但响应机制有所差异。Chen等对拟南芥进行渗透胁迫发现,其蔗糖转运蛋白AtSWEET11/12会在干旱和ABA处理下被迅速磷酸化,该磷酸化会增强SWEETs蛋白的寡聚化和蔗糖转运活性,从而使植物的根中含有更高的蔗糖含量,促进了根部生长,从而增强了植物在干旱胁下干旱抗性和增加了根冠比[31]。本研究结果发现,低温胁迫下叶片TwSWEET11相对表达量相比对照显著下调,而根系中的显著上调,表明根系可能积累了大量蔗糖从而增加了小黑麦的抗寒性。
徐磊等人[40]研究结果表明,小麦TaSWEET6基因在低温、干旱、盐胁迫处理下均上调表达,本研究结果发现,干旱及低温胁迫处理12 h后,TwSWEET6a在叶片及根部的表达水平显著升高,极显著高于对照水平,与小麦中的研究结果基本一致。此外,其他课题组有研究发现,干旱胁迫能够上调拟南芥叶片和根中AtSWEET11/12的表达水平,促进了从叶到根的碳循环[38],本研究中小黑麦叶片TwSWEET12基因在干旱和低温胁迫过程中表现为先降低再升高(低温胁迫时在12 h后相对表达量会再次降低),但是TwSWEET11并没有与TwSWEET12保持显著的一致性,此外叶片中TwSWEET11在干旱和低温胁长时间胁迫后期表达水平持续下调,这表明TwSWEET11/12基因在作物小黑麦中的调控模式有别于模式植物拟南芥。
本研究发现TwSWEET2a/6a/12/16在干旱和低温处理后,叶片及根部表达量会发生急剧升高或下降,可将它们作为研究小黑麦对非生物胁迫胁迫响应的候选基因,如TwSWEET2a/6a/12/16可作为干旱胁迫候选基因,TwSWEET6a/16可作为寒冷胁迫候选基因。本研究为进一步揭示作物逆境生理代谢、信号转导及优良品种选育提供了坚实的基础。
4 结论
本研究从小黑麦转录组数据中共鉴定得到16条TwSWEETs糖转运蛋白。所有TwSWEETs糖转运蛋白均是疏水性蛋白,包含6~7个TMHs,亚细胞定位预测结果显示多数TwSWEETs蛋白定位在质膜上,少数TwSWEETs存在多种定位结果。蛋白质二级和三级结构预测结果显示α-螺旋结构是主要的组成原件。系统发育树分析将其分为四个亚族,家族成员与禾本科多个作物的SWEET蛋白家族同源性高,保守性较强。TwSWEETs基因积极参与了小黑麦对非生物胁迫的响应过程,其中,TwSWEET2a/6a/12/16在干旱或低温胁迫下呈现出显著差异表达,可将它们作为研究小黑麦对环境胁迫反应的重要候选基因。

