87例大血管闭塞急性缺血性卒中患者阿替普酶静脉溶栓后疾病转归的影响因素分析
李小红 刘俊平 李 强 李 敏
1.河南省确山县人民医院(河南驻马店 4632001);2.驻马店市中心医院(河南驻马店 4630002);3.中国人民解放军联勤保障部队第九九〇医院(河南驻马店 4630003)
大血管闭塞急性缺血性卒中(Acute ischemic stroke with large vessel occlusion,AIS-LVO)是卒中主要的病理类型,占据我国脑卒中的70%左右,具有高病死率、高致残率等特点,AIS-LVO患者血管再通与转归之间紧密相关[1-2]。AIS-LVO发病后4.5 h内给予阿替普酶(Recombinant tissue plasminogen activator,rt-PA)静脉溶栓治疗,具安全性、有效性等优点,可改善患者临床症状[3]。研究发现AIS患者接受溶栓治疗后,部分患者依旧表现中/重度残疾,因而早期预测rt-PA静脉溶栓治疗后疾病转归具有重要意义[4]。目前关于rt-PA静脉溶栓治疗后疾病转归影响因素的研究相对较少,因此,本研究主要探讨影响AIS-LVO患者rt-PA静脉溶栓后疾病转归的相关因素,为降低转归不良发生率提供参考依据。
1 资料与方法
1.1一般资料 选取2019年2月至2021年10月本院收治的87例AIS-LVO患者为研究对象,根据出院或溶栓后14d采用改良Rankin量表(mRS)评价患者临床转归[5],≤2分视为转归良好组(50例),>2分视为转归不良组(37例)。转归良好组中男35例、女15例;年龄51~75岁,平均(62.07±3.32)岁。转归不良组中男20例、女17例;年龄52~74岁,平均(62.35±2.45)岁。本研究经本院伦理委员会批准。
1.2纳入与排除标准 纳入标准:均符合AIS-LVO相关诊断标准[6];发病4.5h内接受溶栓治疗;治疗前患者症状无改善;MRI检查证实存在AIS;免疫功能正常;CT血管造影(CAT)确诊为大血管闭塞;前循环闭塞时间≤6h;后循环闭塞时间分别≤24h。排除标准:睡眠/出血性卒中者;合并颅内出血、颅内肿瘤者;既往心肌梗死病史;心、肝等功能不全者;近期接受肝素等抗凝治疗者;合并血液系统疾病者。
1.3方法 rt-PA(德国Boehringer Ingelheim公司,国药准字SJ20160054,规格:20mg/支)0.9mg/kg溶解于生理盐水(100mL),1min内外周静脉推注总剂量10%,持续静脉滴注(总剂量90%)1h,剂量≤90mg,溶栓治疗24h后,经颅脑CT/MRI检查,若无脑出血者给予神经保护、抗血小板药物治疗。
1.4观察指标 (1)收集AIS-LVO患者临床资料:年龄、性别、血压水平、梗死分布、血常规、生化常规[甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、脂蛋白a、C-反应蛋白(CRP)、降钙素原(PCT)、肌酐、血红蛋白]、吞咽功能障碍。(2)美国国立卫生研究院卒中量表(NIHSS)评估神经功能缺损[7]:包括前/后循环、运动、言语、感觉等15项内容,总分为42分,≤8分判定为轻度卒中,>8分判定为中重度卒中。(3)影响AIS-LVO患者rt-PA静脉溶栓后转归不良的单因素分析、Logistic回归多因素分析;(4)受试者工作特征(ROC)曲线分析Logistic回归模型对AIS-LVO患者rt-PA静脉溶栓后转归不良的预测价值。
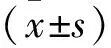
2 结果
2.1rt-PA静脉溶栓后疾病转归情况
87例患者接受rt-PA静脉溶栓治疗后转归良好50例57.47%(50/87)、转归不良37例42.53%(37/87)。
2.2rt-PA静脉溶栓后转归不良的单因素分析
两组年龄、性别、高血压、糖尿病、既往卒中史、吸烟、梗死分布、收缩压、舒张压、淋巴细胞、血红蛋白比较差异无统计学意义(P>0.05)。转归不良组心房颤动、饮酒、TG、TC、LDL-C、脂蛋白a、肌酐、白细胞、中性粒细胞、CRP、NIHSS评分、卒中严重程度、吞咽功能障碍、PCT、嗜酸性粒细胞与转归良好组比较差异有统计学意义(P<0.05),见表1。
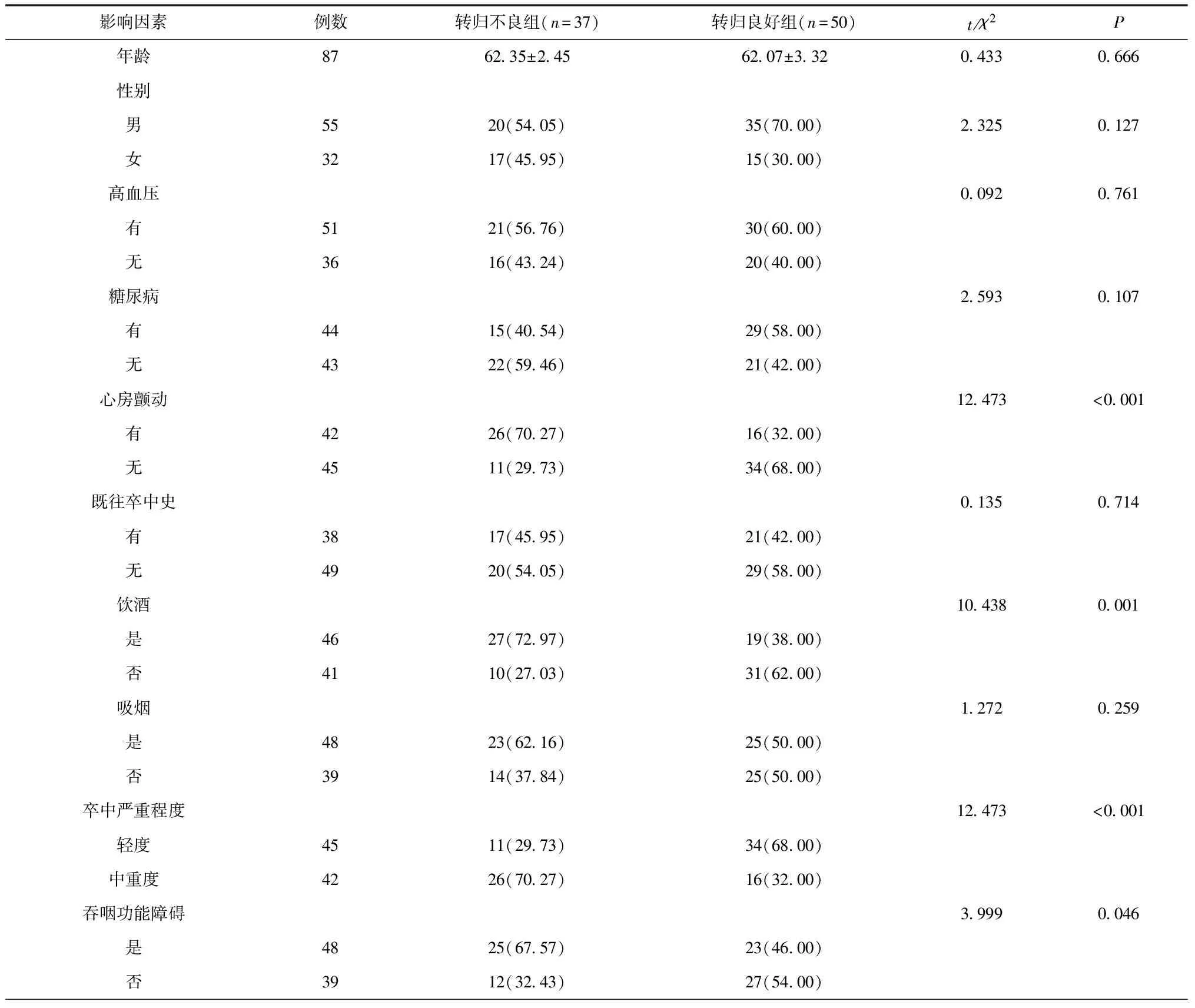
表1 rt-PA静脉溶栓后转归不良的单因素分析
2.3转归不良多因素分析
以转归不良为因变量,纳入单因素分析差异显著指标为自变量,自变量赋值见表2。Logistic回归分析影响rt-PA静脉溶栓后转归不良的相关因素,结果显示,中重度脑卒中、NIHSS评分>6.76分、脂蛋白a>224.98 mg/L、CRP>5.78 mg/L、PCT>0.84 ng/mL、TG>1.63 mmol/L、TC>4.60 mmol/L、LDL-C>2.67 mmol/L、中性粒细胞>4.32×109/L、白细胞>6.13×109/L、嗜酸性粒细胞≤0.16×109/L是转归不良的影响因素,见表3。

表2 自变量赋值
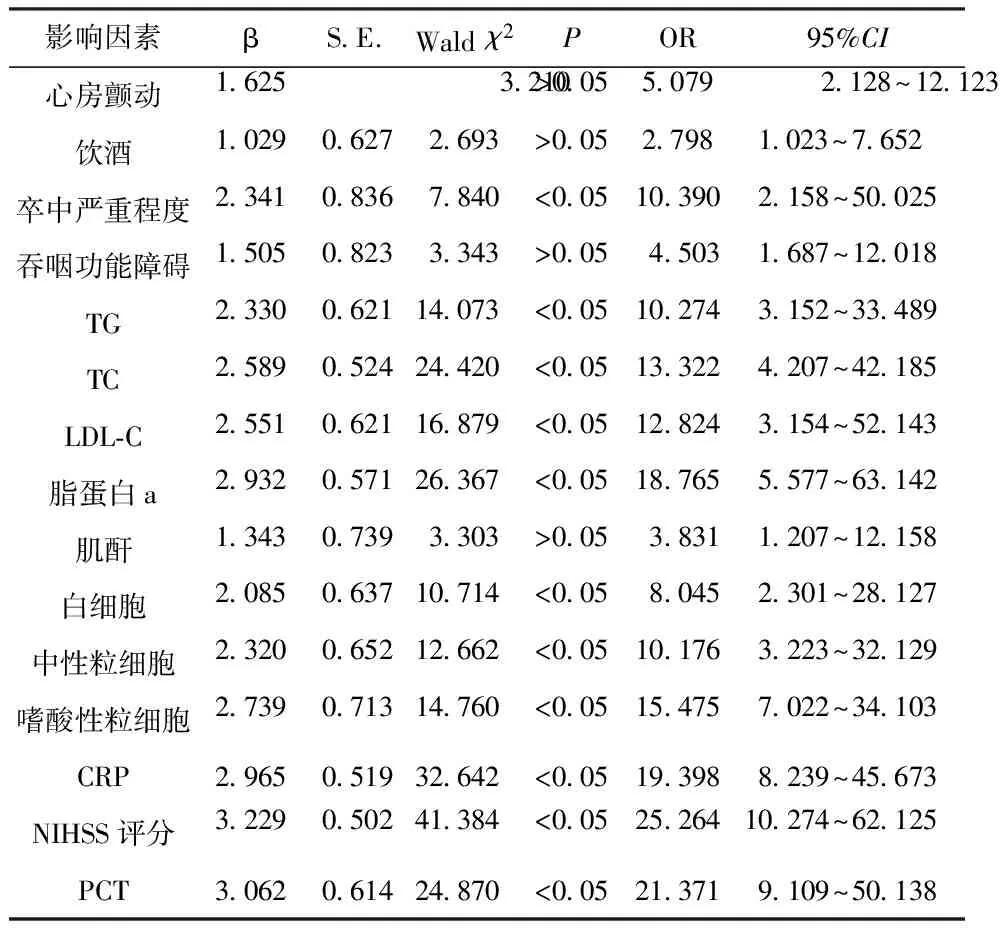
表3 影响转归不良的Logistic多因素分析
2.4Logistic回归模型对患者rt-PA静脉溶栓后转归不良的预测价值
采用Logistic回归模型统计分析数据集,得到患者rt-PA静脉溶栓后转归不良的预测概率P。根据预测值和真实值绘制ROC曲线,结果显示,AUC为0.888(95%CI:0.812~0.927),当Log(P)>4.136时,敏感度为83.78%,特异度为84.00%。
3 讨论
早期AIS-LVO给予rt-PA静脉溶栓治疗可促进脑组织血管再通,恢复前向血流,增强其血液供应能力,治疗效果较好,但仍有部分患者预后不良[8]。本研究结果显示,87例患者接受rt-PA静脉溶栓治疗后转归良好发生率57.47%、转归不良发生率42.53%,与相关研究报道结果相似[9]。因而深入分析影响其转归不良的影响因素有助于改善患者预后。
本研究单因素分析显示,心房颤动、饮酒、TG、TC、LDL-C、脂蛋白a、肌酐、白细胞、中性粒细胞、CRP、NIHSS评分、卒中严重程度、吞咽功能障碍、PCT、嗜酸性粒细胞是影响AIS-LVO患者rt-PA静脉溶栓治疗后转归不良的影响因素。NIHSS用于反映卒中严重程度,分值高低可影响其转归状态,转归良好患者NIHSS评分降低,rt-PA静脉溶栓后轻度卒中患者转归良好比例明显升高[10]。本研究结果显示,NIHSS评分升高、中重度卒中是AIS-LVO患者rt-PA静脉溶栓后转归不良的影响因素。
本研究发现,转归不良组心房颤动、饮酒过度患者比例高于转归良好组,表明伴有心房颤动、饮酒过度患者接受rt-PA静脉溶栓治疗后转归较差。这可能是纤维蛋白、血小板构成动脉粥样硬化形成的血栓,rt-PA可直接靶向纤维蛋白,由于红细胞为主要成分构成心源性栓子导致其对rt-PA不敏感。治疗后应着重关注AIS-LVO患者是否伴有心房颤动,嘱咐其忌酒。中性粒细胞、白细胞升高、嗜酸性粒细胞减少会影响脑卒中患者预后,并可预测急性缺血性卒中严重程度,且与其临床转归有关[11]。分析原因可能在于中性粒细胞、白细胞升高,脑组织等远端组织受到缺血性损伤,进一步影响患者转归状况,嗜酸性粒细胞可影响血管内皮功能,转归不良患者体内氧化应激反应加重,可促进肾上腺素释放,促进细胞凋亡,减少嗜酸性粒细胞。
TG、TC、LDL-C、肌酐水平与动脉粥样硬化、血栓形成密切相关,血脂水平升高可增加血液黏度,降低血脂水平可增强脑组织氧-血供应,改变其低灌注状态,改善神经功能[12]。本研究显示,转归不良组TG、TC、LDL-C、肌酐水平均高于转归良好组。这可能是AIS-LVO患者血脂水平升高导致rt-PA静脉溶栓后转归不良,在生活中应通过控制饮食、作息等改善其血脂水平,以此降低转归不良发生率。脂蛋白a属于大分子脂蛋白,可促进血栓形成,并影响卒中患者rt-PA静脉溶栓治疗后转归[13]。本研究结果显示,转归不良组脂蛋白a水平高于转归良好组,其作用机制可能在于脂蛋白a可竞争性抑制rt-PA对纤维蛋白原的作用,氧化反应条件下,脂蛋白a可结合清道夫细胞受体,促进LDL-C摄取过程,并促进血栓形成,降解抗纤维蛋白。CRP与卒中严重程度呈正相关,并可促进黏附分子释放;PCT属于多肽分子,淋巴细胞、单核细胞等分泌合成PCT,早期AIS患者PCT水平升高,并可作为预测卒中严重程度的标志物[14-15]。本研究结果显示,转归不良组CRP、PCT水平高于转归良好组,表明CRP、PCT水平升高与AIS-LVO患者rt-PA静脉溶栓后转归不良有关。
本研究Logistic多因素分析显示,脂蛋白a、CRP、PCT、TG、TC、LDL-C、中性粒细胞、白细胞、嗜酸性粒细胞、NIHSS评分、卒中严重程度是患者溶栓后转归不良的独立危险因素。本研究进一步分析显示,Logistic回归模型对患者rt-PA静脉溶栓后转归不良具有良好的预测价值。对于AIS-LVO患者,在临床治疗基础上应针对上述影响转归不良的危险因素进行早期干预、防治,应按时复查,改善饮食习惯,积极配合医护人员,遵循医嘱,有助于降低其转归不良发生率。
综上所述,脂蛋白a、CRP、PCT、TG、TC、LDL-C、中性粒细胞、白细胞、嗜酸性粒细胞、NIHSS评分、卒中严重程度是影响AIS-LVO患者rt-PA静脉溶栓后转归不良的影响因素。治疗前医生应完善相关检查,考虑多方面因素以此提高rt-PA静脉溶栓治疗效果,应根据不同患者实际情况制定方案,降低转归不良风险。本研究纳入样本量较小,未分析AIS-LVO病因、转归不良的相关性,下一步将扩大样本量进行深入分析。

