一种固有抗菌的黏附性可注射水凝胶用于牙周炎骨缺损治疗的初步研究
赵洁晨,任 乐,魏 玉,易紫媚,林淑贤,吴珺华
牙周炎是一种微生物和宿主免疫系统之间相互作用引起的慢性炎症性疾病,其对牙齿支持结构造成持续性不可逆转的破坏,是牙齿缺失的首要原因[1]。使用含有抗菌剂的局部给药系统是一种重要的牙周炎辅助治疗手段[2]。作为药物载体的可注射水凝胶由于能注射到不规则的牙周袋内,可保证药物分布均匀,作用时间延长,且具有成本低、生物相容性高等优点,近年来备受关注[3]。但口腔内的潮湿环境及日常咀嚼吞咽等活动常常会导致水凝胶的降解和脱落,使其难以在牙周袋内长时间存留且持续释放有效浓度的药物[4-5]。此外,通过物理相互作用,负载在水凝胶中的药物多会发生突释[6],降低了药物的作用时间和效果,且细菌对传统抗生素产生耐药性也已成为一个亟待解决的问题[7]。
ε-聚赖氨酸(Polylysine,PLL)是一种由微生物产生的天然均聚酰胺聚合物,由25~30个赖氨酸残基组成,对革兰氏阴性菌、革兰氏阳性菌及真菌都具有广谱抗菌活性[8]。聚乙二醇(Polyethylene Glycol,PEG)由于其良好的生物相容性、代谢性以及组织黏附性,近年来被广泛用于制备各种生物材料。PEG基水凝胶通常是基于多臂PEG而开发的[9],因此,本研究拟采用PEG衍生物四臂聚乙二醇琥珀酰亚胺戊二酸酯(4-arm-PEG-SG)和PLL中的氨基发生酰胺化交联形成水凝胶。一方面,4-arm-PEG-SG末端活性酯能与牙周组织的氨基反应,产生强黏附力使水凝胶固定于牙周袋内延长存留时间;另一方面,PLL中游离的赖氨酸残基中的氨基在水凝胶表面产生高密度阳离子表面,形成永久非浸出性杀菌层,从而起到长效杀灭牙周致病菌的作用[10-11]。构建具有固有抗菌黏附性可注射水凝胶可为牙周炎治疗提供新策略。
1 材料与方法
1.1 实验材料及设备
ε-聚赖氨酸(南京轩凯生物科技股份有限公司,中国),4-arm PEG-SG(SINOPEG,中国),牙龈卟啉单胞菌(Porphyromonasgingivalis,P.gingivalis)(北纳生物,中国),厌氧基础琼脂、厌氧基础肉汤(Oxoid,美国),无菌脱纤维羊血(新锐生物,中国),胎牛血清(BI,美国),青-链霉素、α-MEM、磷酸盐缓冲液(Hyclone,美国),CCK-8试剂盒(碧云天,中国),Wistar雄性大鼠(上海雷报生物科技有限公司,中国)。
多功能酶标仪(BioTek,美国),涡旋振荡器、红外光谱仪(Thermo,美国),纯水仪(ELGA,英国),扫描电子显微镜(HITACHI,日本),拉力试验机(GOTECH,中国)。
1.2 方法
1.2.1 PEG-PLL水凝胶制备
使用0.1 mol/L PBS7.4缓冲液配制20、40、60、80 mg/mL不同浓度的PLL溶液。使用纯化水配制200 mg/mL的4-arm-PEG-SG溶液。按照1∶1体积比混合,涡旋仪混合均匀,分别得到样品PEG-PLL-10、PEG-PLL-20、PEG-PLL-30、PEG-PLL-40(PEG-PLL-X,其中X表示PLL的浓度,即PEG-PLL-10表明凝胶中PLL浓度为10 mg/mL)。
1.2.2 PEG-PLL水凝胶的表征测试
1.2.2.1 傅里叶变换红外光谱学(Fourier transform infrared spectroscopy,FTIR)分析 使用溴化钾压片法制备红外样品,测试波数为4 000~400 cm-1,采集样品的吸收光谱。
1.2.2.2 凝胶化时间测定 采用倒置法测试凝胶化时间:从4-arm-PEG-SG与PLL溶液混合时开始计时,直到凝胶倒置不流动所需时间为凝胶化时间。每组测试设置3个样本。
1.2.2.3 吸水溶胀性能测试 将制备的凝胶称重记为Wi,浸泡于37 ℃的PBS中,定时擦干表面水分后称重,记为Wt。每隔24 h更换1次PBS,凝胶的溶胀率(%)=(Wt-Wi)/Wi×100%。
1.2.2.4 力学性能检测 将PEG-PLL凝胶制备成直径10 mm,高度6 mm的圆柱体,通过拉力实验机,以1 mm/min的速度进行压缩实验,作压缩强度-压缩率曲线,并通过15%~25%线性变形区间计算压缩模量。
1.2.2.5 形貌观察 样品通过冷冻干燥法冻干样品,取内部截面,喷金后上样观察水凝胶内部结构。
1.2.3 PEG-PLL水凝胶细胞毒性检测
根据ISO标准(ISO 10993-5)使用水凝胶浸提液评估细胞毒性。首先将无菌水凝胶(凝胶前体溶液用0.22 μm滤器过滤)浸入α-MEM中,以100 mg/mL的浸提比例在37 ℃恒温箱中放置24 h,离心得到的上清液即为浸提液。将人牙周膜成纤维细胞(human periodontal ligament fibroblasts,hPDLCs)以5 000个/孔密度接种于96孔板,每组设5个复孔,培养24 h细胞贴壁后将培养基更换为含10% FBS的浸提液,以培养在普通生长培养基中的细胞作为对照组。CCK-8试剂盒根据制造商的说明分别在第1、3天使用。按CCK-8试剂与α-MEM培养基体积比1∶10的比例配置CCK-8工作液,每孔100 μL。在细胞培养箱中避光孵育2 h后,使用酶标仪测量450 nm处测定吸光度。
1.2.4 PEG-PLL水凝胶抗菌性能检测
使用P.gingivalis测定水凝胶的抗菌性能。将水凝胶前体溶液用0.22 μm滤器过滤后,在96孔板底部原位形成100 μL水凝胶,加入PBS(pH=7.4)冲洗3遍洗去未反应前体材料。然后在水凝胶表面加入浓度为1×106CFU/mL 的100 μL细菌悬液并以不含水凝胶组作为对照。每组重复3次,在37 ℃的厌氧培养箱中培养24 h。然后取出细菌悬液60 μL于新的96孔板内,测量菌液的OD600值。将菌液梯度稀释一定倍数后,取100 μL稀释后的菌液,接种于厌氧基础血平板,培养3 d,对平板上的菌落观察计数。
抗菌率=(对照组细菌浓度-水凝胶组细菌浓度)/对照组细菌浓度×100%。
1.2.5 PEG-PLL水凝胶体外黏附实验测定
将新鲜猪牙龈切成1 cm×2 cm大小,在其中一块牙龈上加入50 μL水凝胶,接着将另一块牙龈按压在其上方,保证两块黏合牙龈组织的重叠区域为1 cm×1 cm。30 min后将黏合组织置于拉力实验机下,以1 mm/min速度进行拉伸实验,直至出现断裂,从而得到最大黏附强度。为模拟生理环境,黏附实验中使用的牙龈组织在整个过程中保持湿润。每组重复3次。
最大黏附强度=断裂拉伸力值/有效接触面积。
1.2.6 PEG-PLL水凝胶治疗牙周炎的体内实验
1.2.6.1 构建动物模型 将大鼠随机分为3组,分别为空白组、单纯牙周炎组、牙周炎+PEG-PLL-20水凝胶组,每组5只。4-0#缝合线浸泡P.gingivalis菌液后,绕大鼠上颌第二磨牙牙颈部2周,并在颊侧打结,每3 d检查缝线是否脱落;正常饮食饲养4周,建立牙周炎大鼠模型。4周后拆除上颌结扎丝线,分别在不同组别上颌第二磨牙牙周袋内注射生理盐水、PEG-PLL-20水凝胶10 μL,未作任何处理者作为空白对照组。每隔1周重复上述操作1次,4周后全麻状态心脏灌流,取大鼠双侧上颌骨4%多聚甲醛溶液固定24 h。所有操作均符合同济大学附属口腔医院实验动物伦理要求。
1.2.6.2 Micro-CT分析 使用Micro-CT对上颌骨游离标本进行扫描,扫描条件:70 kVP,精度14 μm。重建大鼠上颌骨,运用Image J软件分别于近中、中点及远中测量第二磨牙颊、腭侧釉牙骨质界到牙槽嵴顶(cemental enamel junction-alveolar bone crest,CEJ-ABC)的距离。
1.3 统计学分析
采用SPSS 20.0与GraphPad Prism 8.0软件进行统计分析。使用t检验和单因素方差分析对实验结果进行统计,以P<0.05为差异有统计学意义。
2 结 果
2.1 PEG-PLL水凝胶表征
2.1.1 FTIR分析


图1 4-arm-PEG-SG、PLL、PEG-PLL的FTIR红外光谱
2.1.2 PEG-PLL水凝胶凝胶化时间
4-arm-PEG-SG与PLL混合后,能在30 s之内发生凝胶化,凝胶化时间随着PLL含量的提高,无显著性变化(图2)。
2.1.3 PEG-PLL水凝胶溶胀率
PEG-PLL-10随着溶胀时间的延长,质量呈下降趋势,但是质量变化范围在10%以内。随着PLL加入量的提高,凝胶的吸水溶胀能力明显提高,由PEG-PLL-20约10%的溶胀率提高至PEG-PLL-40约60%的溶胀率(图3)。
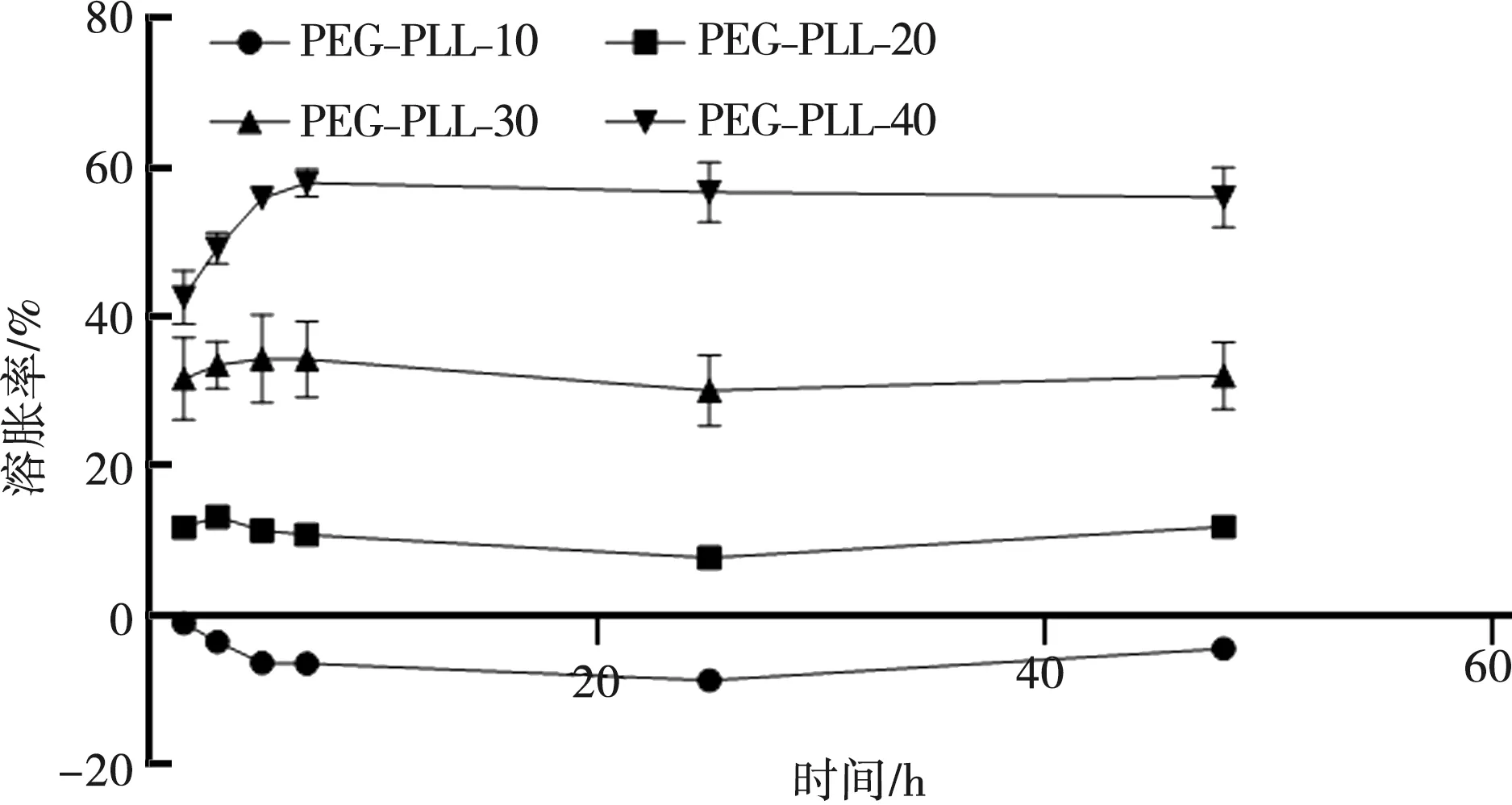
图3 PEG-PLL水凝胶在PBS中溶胀率
2.1.4 PEG-PLL水凝胶力学性能
当PLL浓度在10 mg/mL时,PEG-PLL的压缩模量为237 kPa,当PLL浓度在20 mg/mL时,其压缩模量为263 kPa。而当PLL浓度进一步提高时,凝胶的压缩模量显著性下降(图4),与此同时,断裂压缩率与断裂压缩强度有所提高(图5)。表明PLL浓度的变化对于可以调控凝胶的力学性质。

与对照组相比,**:P<0.01
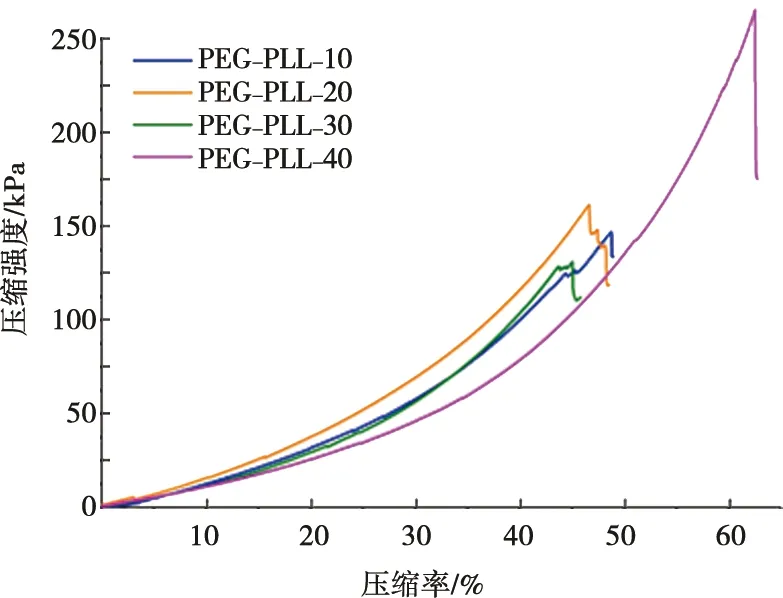
图5 压缩强度-压缩率曲线
2.1.5 扫描电镜表征水凝胶内部结构
PEG-PLL内部为贯穿的多孔结构,孔径在50~200 μm(图6)。随着PLL浓度的提高,PEG-PLL的孔径变化无明显差异(图7)。

图7 水凝胶孔径
2.2 PEG-PLL水凝胶的细胞毒性
与对照组相比,PEG-PLL-10和PEG-PLL-20水凝胶组第1、3天均没有表现出明显的细胞毒性,而PEG-PLL-30和PEG-PLL-40水凝胶组在第3天时表现出一定的细胞毒性,且随着PLL浓度增高,细胞活力越低(图8)。

与对照组相比,*表示P<0.05,**表示P<0.01
2.3 PEG-PLL水凝胶抗菌性能
相较于对照组,随着水凝胶中PLL浓度升高,OD600值逐渐降低(图9)。P.gingivalis平板菌落培养计数随PLL浓度增加而减少,呈现相同的浓度依赖性。对于菌落数计算抗菌率的统计分析结果如图10、11所示,PEG-PLL-20的抗菌率已超过90%。

**:P<0.01

*:P<0.05,**:P<0.01

图11 P.gingivalis平板菌落培养
2.4 PEG-PLL水凝胶组织黏附特性
各组PEG-PLL的黏附强度在10~20 kPa,随着PLL浓度的提高,其黏附强度无显著性改变,表明PEG-PLL凝胶性质的变化对于整体的黏附强度影响不大(图12)。

A:使用猪牙龈组织进行搭接剪切黏附强度测试的代表性图像,红框代表猪牙龈取材部位,蓝框代表黏附范围;B:各组PEG-PLL水凝胶对猪牙龈的黏附强度
2.5 PEG-PLL-GA水凝胶治疗大鼠牙周炎的Micro-CT分析结果
治疗4周后Micro-CT扫描结果如图13所示,相较于空白组,牙周炎组第二磨牙牙槽骨明显吸收,呈凹坑状,根分叉暴露,表明牙周炎模型建立成功;使用PEG-PLL-20水凝胶治疗后,大鼠牙槽骨破坏情况明显好转,牙周炎得到控制。CEJ-ABC距离结果所示,PEG-PLL-20水凝胶处理后CEJ-ABC平均距离较牙周炎组明显减少(图14)。
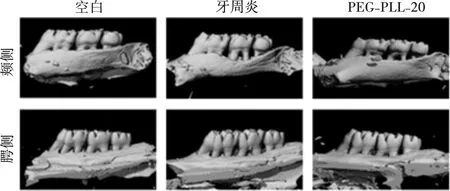
图13 Micro-CT重建结果

与空白组相比,**:P<0.01;与牙周炎组相比,#:P<0.05
3 讨 论
水凝胶因其易于操作、药物分布均匀、良好的生物相容性而被广泛用于局部药物递送系统(local drug delivery systems,LDDS),已有一些水凝胶制剂被开发出来并用于临床牙周炎治疗,比如含有米诺环素、甲硝唑等成分的水凝胶。然而细菌耐药性及弱黏附力限制其运用。

理想的牙周局部给药体系能对组织表面有一定黏附特性,这可以使之与牙周组织紧密接触抵抗外力延长存留时间[15]。PEG-PLL中4-arm-PEG-SG上N-羟基琥珀酰亚胺活性酯与组织上的氨基发生原位的酰胺化反应从而使组织和凝胶黏合在一起[16]。通过使用湿润的猪牙龈模拟体内情况并通过搭接剪切实验检测水凝胶的黏附能力,结果表明水凝胶有着良好的组织黏附性,这提示PEG-PLL水凝胶可能黏附在牙周袋内。此外,还检测了水凝胶的力学性能,发现PEG-PLL水凝胶具有较高的断裂压缩强度和压缩模量,能够抵抗唾液的冲刷以及在咀嚼和吞咽过程中施加的压力,从而延长在应用部位的保留时间[17],我们在其他的实验中使用了临床上常用于牙周炎治疗的制剂派力奥作为对照,然而它对猪牙龈的黏附力约等于0 Pa,未能对组织产生明显的黏附力。
对P.gingivalis的抗菌性实验发现,PEG-PLL的抗菌性能有着浓度依赖性,这是因为水凝胶中的PLL浓度升高,会有更多的氨基暴露于水凝胶表面形成阳离子,阳离子密度越高,接触杀菌的能力越强[18]。除此之外,医用水凝胶最重要的是生物相容性,细胞毒性实验表明,PLL浓度过高会产生一定的细胞毒性。最终水凝胶体系中PLL的浓度为20 mg/mL,此时水凝胶具有良好抗菌性能的同时,没有明显的细胞毒性。PLL是天然合成的抗菌肽,与蛋白质结构相似,另外采用酰胺化反应合成水凝胶避免了使用有细胞毒性的交联剂,提高了水凝胶的细胞相容性[19]。
本研究使用Wistar大鼠结扎P.gingivalis丝线诱导建立大鼠牙周炎模型进一步探究PEG-PLL水凝胶对于牙周炎的治疗效果,结果显示,给予PEG-PLL水凝胶后具有较好的治疗效果,相较于牙周炎组,明显减轻了牙槽骨破坏。这可能与水凝胶在牙周袋内稳定存留,可持续杀灭牙周炎致病菌,维持了一个有利于牙周组织恢复的环境[20]。
综上所述,本研究成功构建了一种具有固有抗菌黏附性可注射水凝胶,可有效减轻牙周破坏程度。此外该水凝胶具有微观多孔结构,不仅利于营养物质的交换,还有利于药物的释放,在牙周炎治疗方面具有良好应用前景。
特别鸣谢:感谢上海其胜生物制剂有限公司和姜芳老师对实验的帮助与指导。

