长链非编码RNA LINC00958在头颈部鳞状细胞癌的表达和初步研究
吉 幻,李 萌,姚恩惠,钟 旖,张雨垚,武和明,李 斌
头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是头颈部最常见的恶性肿瘤,每年发生超过60万例,其5年生存率仅有50%~60%。主要由于大多数患者确诊时已经是中晚期,淋巴结转移率高[1-2]。因此,寻找与HNSCC发生、发展相关的因子,对HNSCC的早期诊断、早期干预以及早期治疗极为重要。
近年来研究发现HNSCC的发生发展与长链非编码RNA(long noncoding RNAs,LncRNA)密切相关[3]。LncRNA是近年来发现的一类长度超过200 bp的RNA,其主要功能是通过调控基因或竞争性靶向miRNA调控肿瘤的生物学过程,可间接或直接发挥抑癌或促癌作用,抑制或加速肿瘤的发生发展[4]。LINC00958在肝癌、肺癌、口腔癌等多种肿瘤中表达上升并调节肿瘤发生发展,然而目前LINC00958在HNSCC中的表达及其对增殖和迁移的影响鲜见报道[5-7]。
本研究旨在探索LINC00958在HNSCC中表达及其与肿瘤预后的相关性,以及其对HNSCC细胞增殖和转移的影响,并验证LINC00958是否可通过调控miR-877-3p影响HNSCC的增殖和转移能力,从而为HNSCC的诊断和临床治疗提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 数据库、组织样本及相关细胞系 基于基因表达水平值的交互式分析平台(Gene Expression Profiling Interactive Analysis,GEPIA),简称GEPIA数据库,可利用癌症基因谱图谱库(The Cancer Genome Atlas,TCGA)的RNA表达谱数据,行差异基因分析、生存曲线分析,或根据病理及癌症分型分析等。收集15对2021年1月至2021年12月于南京医科大学附属口腔医院就诊的HNSCC患者的癌及癌旁正常组织样本。患者均知情同意,本研究经南京医科大学医学伦理委员会批准(PJ2020-116-001)。CAL27、HN4和HN6细胞系为HNSCC细胞系,HOK为人正常口腔黏膜上皮细胞系,均购买于上海细胞系库。
1.1.2 实验试剂及仪器 CCK-8试剂盒(APExBIO,美国);PCR引物(锐博,中国广州);PCR试剂盒、反转录试剂盒(Takara,日本);小干扰RNA(吉玛,中国上海);miR-877-3p mimics(吉玛,中国上海);Dual-Glo Luciferase Reporter Assay(Promega,美国);miRNA PCR引物(锐博,中国广州);GAPDH抗体(Proteintech,中国武汉);E-cadherin抗体、N-cadherin抗体、Vimentin抗体(Cell Signaling Technology,美国)。
1.2 方法
1.2.1 细胞培养和转染 CAL27和HOK使用DMEM高糖培养,HN4和HN6使用DMEM/F12培养。细胞培养箱条件为37 ℃、5% CO2浓度。根据LipofectamineTM2000说明书进行转染。每孔5 μL脂质体,与250 μL培养基轻轻混匀,静置5 min;分别取100 pmol的si-LINC00958、si-NC、miR-877-3p mimic或mimics NC稀释于250 μL OPTI-MEMI中,将两种溶液轻吹混合,静置20 min,转染至六孔板内细胞中,轻振混匀,转染6~8 h后,换成含血清的培养液,按要求培养细胞。
1.2.2 组织总RNA提取 使用微量匀浆器充分研磨癌组织样本及相应癌旁正常组织样本。加入适量预冷Trizol,混匀,孵育10 min,然后4 ℃,12 000 r/min离心10 min,除去不溶解物质。加入适量氯仿溶液,振荡器15~30 s混匀,室温孵育5 min。4 ℃,12 000 r/min离心10 min。上层水相移入无RNA酶的EP管,加入等量异丙醇,混匀,常温放置20 min。4 ℃,12 000 r/min,离心10 min。留沉淀,预冷75%乙醇,加入约1 mL乙醇,混匀。4 ℃,7 500 r/min离心5 min。弃上清液,沉淀内加入预冷的DEPC水,混匀。定量RNA浓度和纯度。
1.2.3 细胞总RNA提取 收集细胞沉淀,沉淀内加入适量Trizol,吹打细胞,孵育10 min。余步骤同1.2.2步骤提取。
1.2.4 实时定量PCR反应 取1.2.2和1.2.3步骤获取的RNA,用反转录试剂盒反转录成cDNA,用PCR试剂盒进行实时定量PCR,LINC00958和miR-877-3p分别以GAPDH和U6作为内参基因,用2-ΔΔCt对目的基因表达进行定量分析。引物序列见表1。

表1 引物序列
1.2.5 CCK-8检测细胞增殖 转染细胞,培养至对数生长期,收集细胞。1 mL培养液重悬细胞,计数,接种于96孔板中,每孔3×103个细胞。于0、24、48、72、96、120 h分别检测。用培养基配制10% CCK-8混合液,每孔100 μL。37 ℃避光孵育2 h,在450 nm处测定吸光度。
1.2.6 Transwell实验 包括细胞迁移实验和细胞侵袭实验。细胞迁移实验:取24孔板,放入小室,小室下方加600 μL含10% FBS的培养液,小室内加入200 μL细胞悬液,将细胞在37 ℃下培养24 h,固定细胞,结晶紫染色, 清洗小室, 自然晾干。 细胞侵袭实验:预先用无血清的培养液按1∶8稀释Matrigel胶,取60 μL稀释胶加到上室中,37 ℃孵育至少30 min,其余步骤同细胞迁移实验。正置显微镜选择适当放大倍数拍照,用ImageJ软件分析。
1.2.7 生物信息学分析 采用以下2个数据库预测LINC00958下游miRNA:DIANA TOOLS(http://diana.imis.athena-innovation.gr)和RegRNA 2.0(http://regrna2.mbc.nctu.edu.tw)。
1.2.8 双荧光素酶报告基因实验 预测LINC00958和miR-877-3p的结合位点。构建包含LINC00958的野生型(WT)序列和突变(MUT)序列,分别插入GP-miRGLO载体,由上海吉玛公司合成,命名为GP-miRGLO-LINC00958-WT和GP-miRGLO-LINC00958-MUT。取对数生长期并状态良好的CAL27和HN6细胞,接种到24孔板中。按照LipofectamineTM2000试剂说明转染,将2 μg GP-miRGLO-LINC00958-WT或GP-miRGLO-LINC00958-MUT,50 nmol miR-877-3p mimics或mimics NC,与2 μL脂质体混合,室温孵育20 min。共转染48 h后,使用Promega公司的Dual-Glo Luciferase Reporter Assay试剂盒检测。
1.2.9 免疫蛋白质印迹(Western Blot) 提取总蛋白,用BCA试剂盒测定蛋白浓度,蛋白进行10%聚丙烯酰胺凝胶电泳,转至PVDF上,用5%脱脂奶粉室温封闭后分别加入一抗4 ℃过夜,洗膜后加入二抗,室温孵育1 h,用ECL化学发光液显色。
1.2.10 细胞核质分离实验 采用Paris Kit试剂盒。收集所需细胞,向细胞沉淀中加入细胞分离液,吹打重悬细胞,放置冰上裂解,离心。离心后上清液即是细胞质,沉淀为细胞核。取上清液至新的EP管,向沉淀加细胞裂解液,涡旋混匀。管内加入适量的2×lysis/Binding Buffer用于裂解细胞核与细胞质中,将无水乙醇分别加入细胞核与细胞质,混匀。标记吸附管,将混合液移入相应的管内,加入Wash Solution 1,离心,加入洗涤液,离心。向吸附管内加入预热的洗脱液,离心。定量检测RNA浓度,置-80 ℃保存。用于后续细胞核质RNA检测实验。
1.3 统计学分析
本研究实验数据均采用均数±标准差显示,采用SPSS 22.0分析数据,实验均独立重复3次。两组间比较采用t检验分析,多组比较采用one-way ANOVA单因素方差分析,多组间两两比较采用Dunnett检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 TCGA数据库中LIN00958在HNSCC组织中的表达和临床意义
分析GEPIA数据库中519例HNSCC组织和44例癌旁正常组织中LINC00958表达发现,与癌旁正常组织相比,LINC00958在HNSCC组织中的表达明显升高(图1A),生存曲线分析发现HNSCC患者组织中LINC00958表达越高,其预后越差(图1B)。

A:组织中LINC00958表达;B:生存曲线分析;*:P<0.05
2.2 LIN00958在HNSCC组织和细胞中的表达
实时定量PCR实验结果显示,相较于癌旁正常组织,LINC00958在HNSCC组织中的表达明显升高(图2A)。在HNSCC细胞系CAL27、HN4和HN6中,LINC00958的表达水平明显高于人正常口腔黏膜细胞系HOK(图2B)。此外,通过检测CAL27和HN6细胞核和细胞质中RNA发现,LINC00958主要表达在细胞质中(图2C、D)。

A:组织中LINC00958表达;B:细胞中LINC00958表达;C、D:LINC00958在CAL27和HN6细胞中分布;**:P<0.01;***:P<0.001
2.3 LINC00958对CAL27和HN6细胞增殖能力的影响
结果显示,将si-LINC00958转染到CAL27和HN6细胞后,CAL27和HN6细胞中LINC00958表达明显降低(图3A)。CCK-8实验检测LINC00958对HNSCC细胞系CAL27、HN6生长的影响。结果表明,与转染si-NC组相比,转染si-LINC00958组的CAL27和HN6细胞吸光度值明显降低(图3B、C)。
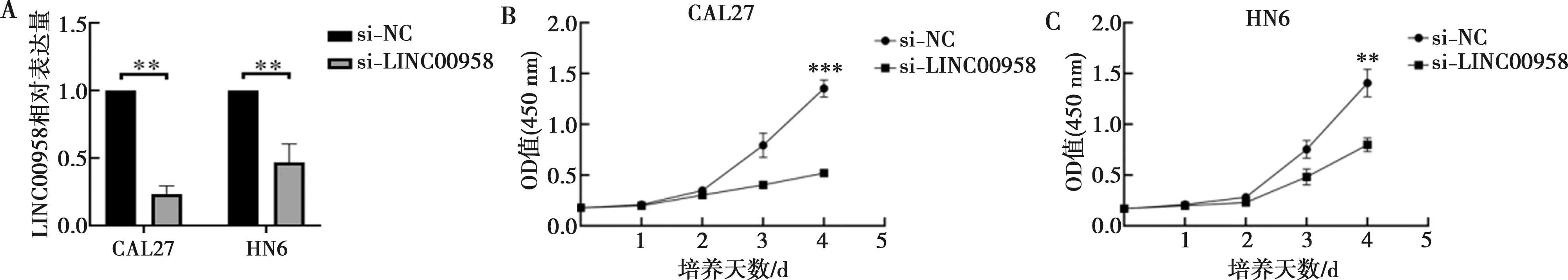
A:si-LINC00958转染效率验证;B:CAL27细胞增殖曲线;C:HN6细胞增殖曲线;**:P<0.01;***:P<0.001
2.4 LINC00958对CAL27和HN6细胞迁移和侵袭能力的影响
细胞迁移和侵袭实验结果显示,与转染si-NC组相比,转染si-LINC00958组的CAL27和HN6细胞在显微镜下穿过小室的细胞数量减少,表现出较弱的迁移和侵袭能力(图4A、B)。
2.5 LINC00958对EMT通路相关蛋白的影响
Western Blot曝光实验结果表明,敲低LINC00958后,N-cadherin、Vimentin(间充质标志物)蛋白表达水平下降,E-cadherin(上皮标志物)蛋白表达增高(图5A、B)。

A:CAL27细胞中E-cadherin、N-cadherin和Vimentin蛋白表达情况;B:HN6细胞中E-cadherin、N-cadherin和Vimentin蛋白表达情况
2.6 miR-877-3p在HNSCC组织和细胞中的表达
实时定量PCR实验结果显示,相较于癌旁正常组织,miR-877-3p在HNSCC组织中的表达含量明显降低(图6A)。在HNSCC细胞系CAL27、HN4和HN6中,miR-877-3p的表达水平明显低于人正常口腔黏膜细胞系HOK(图6B)。
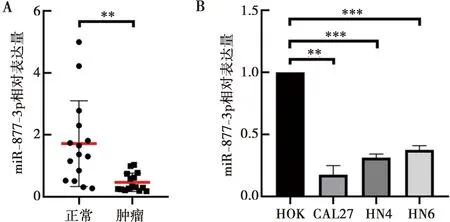
A:miR-877-3p在组织中表达;B:miR-877-3p在细胞中表达;**:P<0.01;***:P<0.001
2.7 LINC00958负向调节miR-877-3p表达
PCR结果显示,敲低LINC00958后miR-877-3p在CAL27和HN6表达量增高,并有显著意义(图7A)。通过预测miR-877-3p与LINC00958的结合位点,构建LINC00958野生型(GP-miRGLO-LINC00958-WT)质粒和LINC00958突变型(GP-miRGLO-LINC00958-MUT)质粒(图7B)。双荧光素酶报告基因实验结果显示:只有在CAL27和HN6细胞中共转染LINC00958野生型质粒(GP-miRGLO-LINC00958-WT)和miR-877-3p mimics,荧光素酶活性才显著降低(图7C)。

′A:转染si-LINC00958后细胞中miR-877-3p的表达;B:LINC00958和miR-877-3p结合位点;C:CAL27和HN6细胞系荧光素酶活性;*:P<0.05;**:P<0.01;ns:无统计学意义
2.8 miR-877-3p对CAL27和HN6细胞增殖能力的影响
PCR结果显示,将miR-877-3p mimics转染到CAL27和HN6细胞系中后,细胞系中miR-877-3p表达明显升高(图8A)。CCK-8实验结果表明,与转染NC组相比,转染miR-877-3p mimics组的CAL27和HN6细胞450 nm吸光度值明显降低(图8B、C)。

A:miR-877-3p mimics转染效率验证;B:CAL27细胞增殖曲线;C:HN6细胞增殖曲线;*:P<0.05;**:P<0.01;***:P<0.001
2.9 miR-877-3p对CAL27和HN6细胞迁移和侵袭能力的影响
细胞迁移和侵袭实验结果显示,与转染NC组相比,转染miR-877-3p mimics组的CAL27和HN6细胞在显微镜下穿过小室的细胞数量减少,表现出较弱的迁移和侵袭能力(图9A、B)。
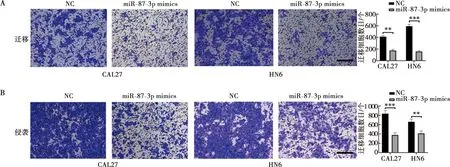
A:镜下迁移实验结晶紫染色后小室图和统计分析;B:镜下侵袭实验结晶紫染色后小室图和统计分析;比例尺=100 μm;**:P<0.01;***:P<0.001
2.10 miR-877-3p对EMT通路相关蛋白的影响
Western Blot曝光实验结果表明,转染miR-877-3p mimics后,N-cadherin、Vimentin(间充质标志物)蛋白表达水平下降,E-cadherin(上皮标志物)蛋白表达增高(图10)。

A:CAL27细胞中miR-877-3p对EMT相关蛋白的影响;B:HN6细胞中miR-877-3p对EMT相关蛋白的影响
3 讨 论
LncRNA属于一类新发现的RNA,其转录本包含200多个不编码蛋白质的核苷酸[8]。近年来研究表明LncRNA的失联在多种癌症的发生和发展中起着至关重要的作用。LncRNA可作为致癌因子,通过与其他RNA的交叉作用和多种基于染色质的机制促进多种癌症的生长或转移。LncRNA可通过调节蛋白质编码能力、在转录水平及转录后水平改变基因表达进而调控恶性肿瘤发生发展过程,影响肿瘤生长、转移等,有望成为治疗恶性肿瘤的靶向分子[4,9]。
研究表明,LINC00958在多种恶性肿瘤中高表达并与肿瘤发生发展有关[10]。据报道,在肺腺癌中,LINC00958作为miR-625-5p海绵,促进细胞增殖、迁移或侵袭能力[6]。LINC00958可通过miR-627-5p促进口腔鳞状细胞癌细胞增殖和迁移[7]。本研究发现,与相邻的正常组织相比,LINC00958在15个HNSCC肿瘤组织中表达量明显上调。后续的研究结果证实,沉默LINC00958可以显著抑制HNSCC的细胞增殖、迁移和侵袭。通过分析GEPIA数据库,结果发现HNSCC患者的LINC00958表达升高提示患者预后不佳。本研究进一步验证了LINC00958在HNSCC进展中的重要作用。
上皮间充质转化(epithelial mesenchymal transition,EMT)和肿瘤发生发展、肿瘤转移等密切相关,其显著标志是上皮标志物(如E-cadherin)的下降和间充质标志物(如N-cadherin、Vimentin)的上升[11-12]。此外,EMT通常和很多转录因子有关,如snail、slug、ZEB1和TWIST等,这些转录因子能通过不同途径抑制E-cadherin表达,影响EMT[13-14]。据报道,LncRNA在调节EMT进程中具有重要作用,有望成为抑制EMT和肿瘤转移的关键分子[15-16]。为了探索LINC00958促进HNSCC发生发展的机制。本研究通过WB实验发现,与NC组相比,转染si-LINC00958后,E-cadherin蛋白表达量显著上升,而N-cadherin和Vimentin蛋白表达水平明显下降,提示LINC00958通过调控EMT影响HNSCC细胞的增殖和转移。
近年来,研究表明LncRNA可以通过竞争与microRNA结合而发挥竞争内源性RNA(competing endogenous RNAs,ceRNAs)的作用[17]。MicroRNA是22 nt左右的小RNA分子,可以通过与靶mRNA结合来沉默基因和抑制翻译。MicroRNA在心血管疾病、视网膜疾病、癌症等多种人类疾病的发生和发展中发挥着重要作用[18-19]。此前已有多种研究表明,LINC00958可通过作用miRNA调节癌症进展。如LINC00958通过浸润miR-625-5p,上调LRRC8E表达,促进宫颈癌细胞增殖和转移[20]。LINC00958通过作用miR-627-5p,调节YBX2表达,促进口腔鳞状细胞癌细胞增殖和迁移[7]。
通过生物信息学研究,我们预测miR-877-3p可能与LINC00958结合。通过qRT-PCR实验证实,与NC组相比,沉默LINC00958后miR-877-3p在CAL27和HN6细胞中的表达明显上调。因此我们推测LINC00958可能负向调节miR-877-3p。通过功能实验,我们证实在HNSCC中miR-877-3p是肿瘤抑制因子,抑制HNSCC细胞增殖和转移能力,其对细胞增殖和转移的作用与LINC00958相反。接下来本研究通过双重荧光素酶报告基因,验证了LINC00958与miR-877-3p存在直接结合。根据这些研究结果,我们认为LINC00958可结合miR-877-3p,在HNSCC发挥致癌基因作用。此外,本研究发现,与NC组相比,过表达miR-877-3p后,E-cadherin(上皮标志物)表达量显著上升,而间充质标志物(N-cadherin和Vimentin)蛋白表达水平明显下降,提示过表达miR-877-3p抑制HNSCC细胞的EMT通路。
综上所述,本研究发现LINC00958在HNSCC中高度上调,LINC00958可结合并负向调节miR-877-3p,通过调控EMT促进HNSCC的增殖、迁移和侵袭能力;LINC00958可能是HNSCC的新型治疗生物标志物。然而,在HNSCC中,LINC00958如何通过海绵作用吸附miR-877-3p来调控下游信号通路的机制有待进一步深入研究。

