治疗黑色素瘤的DC 疫苗研究新进展
张馨月,台宗光,朱全刚,陈中建,鲍蕾蕾 (1.江西中医药大学, 江西 南昌, 330004;.上海市皮肤病医院, 上海, 00443;3.海军军医大学第三附属医院药材科, 上海, 00438)
黑色素瘤由遗传和环境等因素诱导的表皮黑色素细胞恶变引起,是最具侵袭性的皮肤恶性肿瘤[1]。近年来黑色素瘤成为发病率增长最快的恶性肿瘤,发病率的年增长高达3%~5%。我国黑色素瘤年发病率虽然明显低于西方国家,但仍呈现较快的增长势头[2-3]。早期黑色素瘤治疗方式以手术为主,而对于我国黑色素瘤患者而言,由于早期诊断不足、亚型的分布异于西方国家,需要系统治疗的患者群体比例较高。晚期或转移性黑色素瘤的治疗策略包括:化学疗法、放射疗法、靶向疗法和免疫疗法。化疗与放疗因其非特异性和治疗抗性,在晚期黑色素瘤治疗中的意义有限。根据特定突变基因的靶向疗法应用广泛,但易产生耐药性,在治疗的数月内即导致复发[4]。晚期黑色素瘤的发病率较高,在美国癌症新发病例中排名第五。仅在2022 年,美国有99 780 例新发黑色素瘤病例,其中死亡病例7 650 例[5]。由于黑色素瘤较高的发病率以及晚期黑色素瘤的治疗抗性,因此寻找新型有效的晚期黑色素瘤治疗方法成为了目前黑色素瘤治疗学的研究重点。
黑色素瘤是典型的高突变负荷肿瘤,具有高免疫原性特征[6],对免疫疗法较为敏感。在众多免疫疗法中,治疗性疫苗目的在于诱导针对肿瘤表达抗原的免疫识别,可以有效抑制黑色素瘤的转移与复发,并且毒性较低,这种优势是其他疗法所不具备的[7]。随着对肿瘤抗原呈递和免疫反应生物学的理解,研究者开始关注于针对特异抗原的疫苗设计优化。
由于树突状细胞(DC)可产生激活T 细胞的全部信号,在肿瘤免疫反应的启动、编程和调节中起着关键作用,因此肿瘤治疗性DC 疫苗成为了黑色素瘤治疗性疫苗的研究热点。本文将肿瘤治疗性DC 疫苗在黑色素瘤中的研究及应用现状进行归纳整理,并对其局限性以及可能的改进策略进行探讨。
1 肿瘤治疗性DC 疫苗的原理
肿瘤治疗性疫苗通过让免疫细胞识别肿瘤特异性抗原,调动人体的免疫系统来打击肿瘤细胞,在免疫机制上它跟传统的预防性疫苗有相似之处,是一种针对肿瘤的免疫疗法。目前共有4 种类型的疫苗用于治疗黑色素瘤,其中包括基于肿瘤细胞的疫苗、基于肽的疫苗和基于基因的疫苗以及基于DC 的疫苗[8-9]。
DC 作为主要的抗原递呈细胞是近年来肿瘤疫苗的研究热点[10]。由于DC 是促进T 细胞免疫效应的关键一环[11],在针对肿瘤的免疫反应中,DC 采用多种机制摄取肿瘤相关抗原(TAA),通过在淋巴组织中迁移,并调节促炎因子及趋化因子的生成,最终调控T 细胞的归巢,引发适应性免疫[12]。肿瘤抗原和DC 作为基于DC 的治疗性肿瘤疫苗发挥作用的主要成分,在组成疫苗时有两种形式,一种是提取患者体内原代DC,在体外携载抗原后,作为疫苗回输体内。这类负载抗原的疫苗比仅由抗原和佐剂组成的疫苗诱导更强的免疫反应[10]。另外一种是通过诱导 DC 在体内摄取肿瘤抗原[13],由此增强黑色素瘤转移患者的CD8+T 细胞和CD4+T细胞反应[14]。因此,肿瘤抗原和DC 是治疗性肿瘤疫苗发挥作用过程中必不可少的元素。
1.1 肿瘤抗原
肿瘤表面的MHC 抗原引发T 细胞的活化与增殖,从而启动针对肿瘤细胞的免疫反应。MHC I 类抗原呈递通常激活CD8+T 细胞,而MHC II 类抗原呈递激活CD4+T 细胞[14]。通过疫苗诱导的免疫反应使肿瘤得到缓解并形成针对肿瘤的长期免疫记忆,抑制复发以达到产生最佳免疫效应[12]。疫苗佐剂通常会刺激抗原呈递细胞(antigenpresenting cell, APC)上的模式识别受体 (pattern recognition receptor, PRR)。这些PRR 可识别病原体相关分子模式(pathogen-associated molecular pattern,PAMP)或损伤相关分子模式(damage-associated molecular pattern, DAMP)等激活APC,增加抗原传递,从而激活NK、T 细胞等免疫效应细胞。疫苗佐剂与肿瘤相关抗原共同作用可改善特异性免疫反应,从而增强抗肿瘤疗效[15-16]。
1.2 树突状细胞
DC 是最重要的APC[17],包括多种不同功能的亚型。常规DC(cDC)负责呈递抗原,是肿瘤疫苗发挥作用的重要环节。cDC 促进肿瘤部位的CD4+T 细胞和 CD8+T 细胞迁移到淋巴系统并建立免疫记忆[18]。未成熟cDC 最初停留在淋巴组织之外,可通过Toll 样受体 (TLR)信号,响应来自肿瘤细胞的DAMP 成为成熟cDC[19]。成熟cDC 专门从事抗原摄取以及向幼稚T 细胞的呈递抗原,参与形成第一信号(MHC-抗原肽-TCR 复合物)以及第二信号(APCs 膜上的共刺激因子),以激活肿瘤特异性T 细胞[20]。不同亚型cDC 细胞激活的T 细胞不同,cDC1 是主要的cDC 亚型[21],通常将内源性抗原捕获并加工成抗原肽/MHC I 分子以激活CD8+T 细胞,在迁移到淋巴结后cDC1 将产生重要的抗肿瘤细胞因子IL-12;cDC2 主要负责将外源性抗原肽捕获并加工成抗原肽/MHC II 分子以激活CD4+T 细胞,并分泌IL-10、IL-12、IL-23 和TNF-β[22]等细胞因子。
2 黑色素瘤治疗性DC 疫苗的构建策略
目前基于DC 的治疗性肿瘤疫苗构建策略主要有:①常规的肿瘤治疗性疫苗;②靶向体内DC 的肿瘤治疗性疫苗; ③体外DC 过继的肿瘤治疗性疫苗。
常规的肿瘤治疗性疫苗涉及蛋白质或长肽形式的抗原加上有助于 DC 成熟的佐剂,如粒细胞-巨噬细胞集落刺激因子(GM-CSF)[23],但这种方法缺乏靶向性,需使用对DC 具有高亲和力的重组载体或有利于靶向DC 的新型佐剂来增强靶向性。
靶向体内DC 的策略包括向宿主注射与抗原结合的抗DC 抗体(如抗C 型凝集素)并递送适当的成熟刺激物。这种方法会触发并增强免疫,但是由于某些患者的DC 及其受体可能会发生改变,因此易导致免疫耐受[24]。
体外DC 过继的肿瘤治疗性疫苗首先分离患者外周血单核细胞或者骨髓中的CD34+前体细胞,体外诱导分化为未成熟DC,然后加载肿瘤抗原并经促炎细胞因子活化,最后注射回宿主体内激活抗肿瘤特异性免疫[25-26]。
黑色素瘤治疗性DC 疫苗已开展了多项临床试验(表1)。与辐照灭活的肿瘤细胞疫苗相比,治疗性DC 疫苗在黑色素瘤患者中具有更好的预后[27];经过基因修饰而分泌GM-CSF 的DC 疫苗在预防黑色素瘤肺转移方面也优于常规的肿瘤细胞疫苗[28]。
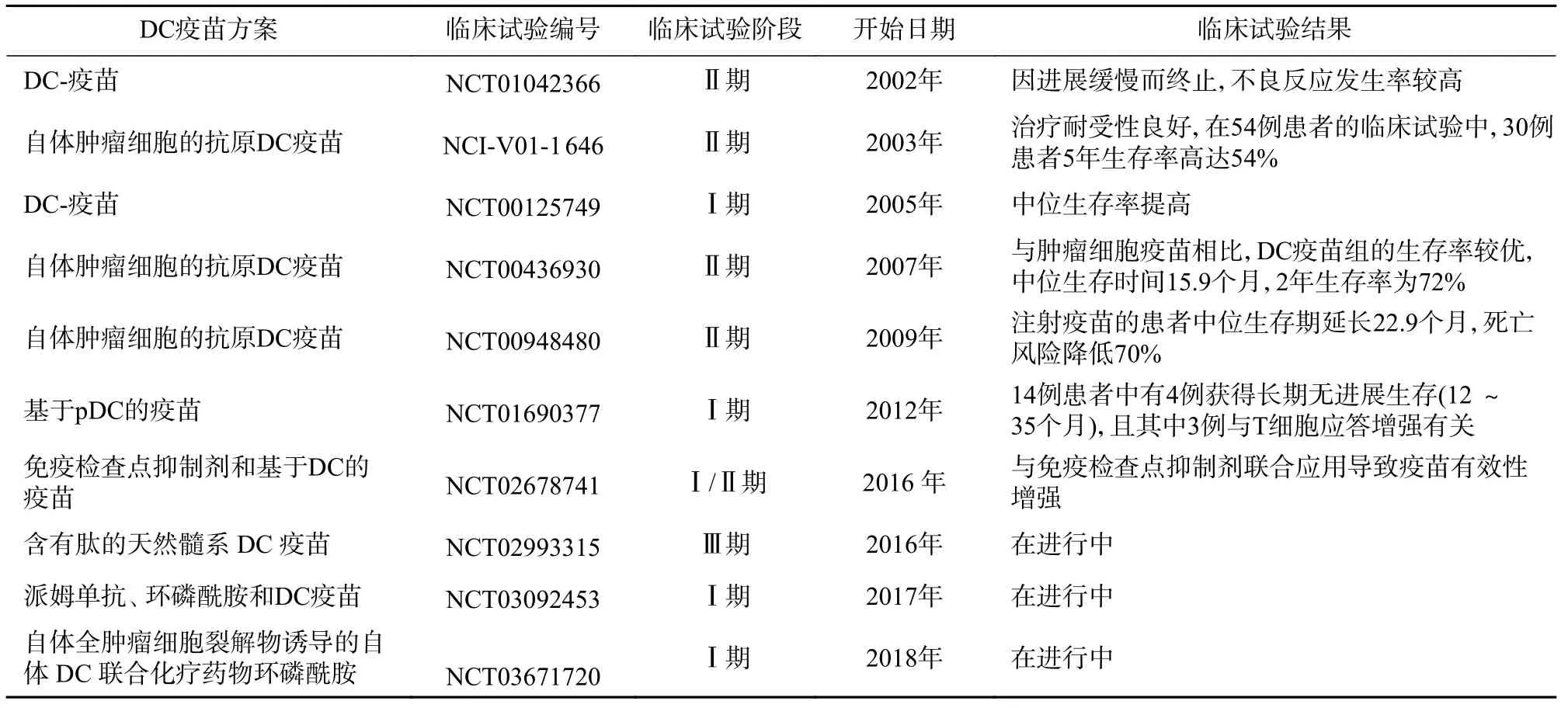
表 1 黑色素瘤治疗性 DC 疫苗的临床试验
3 黑色素瘤治疗性DC 疫苗的优化方向
3.1 促进DC 的成熟及迁移
黑色素瘤的治疗性疫苗的应用已显示出良好前景,但该类疫苗效力的进一步提高仍面临着瓶颈,部分临床试验中产生的令人失望的结果可能是由于DC 不成熟所致。未成熟DC 无法进行有效迁移,而且MHC II 和共刺激分子的表达也会随之减少,导致DC 无法有效刺激 T 细胞,最终降低疫苗疗效。因此,诱导DC 成熟及迁移成为了改进肿瘤治疗性DC 疫苗效力的主要策略。
刺激DC 成熟的一种方法是使用CD40 抗体。CD40 是DC 上的一种共刺激受体,可促进DC成熟和CD8+T 细胞激活。此外,Toll 样受体激动剂可以刺激DC 的模式识别受体以促进抗原加工后呈递给T 细胞。黑色素瘤疫苗佐剂中常用的TLR3 激动剂聚肌苷-聚胞苷酸(poly-I∶C),这种TLR3 激动剂诱导DC 成熟以产生具有更强细胞毒作用的CD8+T 和NK 细胞[15]。将CD40 抗体添加到TLR3 激动剂与新抗原组合的疫苗中可促进新抗原特异性T 细胞在肿瘤微环境中的增殖,该策略仍需要在人体中进行评估[29]。疫苗与PGE2 联用可提高DC 活力及迁移能力。另一方面,PGE2 会抑制DC 分泌IL-12,在缺乏IL-12 的情况下会诱导FoxP3+调节性T 细胞(Tregs)产生,形成免疫抑制的肿瘤微环境[30],该策略不利于疫苗后续的免疫效应。虽然通过淋巴细胞成熟的DC 的迁移能力不如通过PGE2 刺激的DC[30],但这一方法可避免免疫抑制作用,用针对CD3/CD28 的抗体刺激的自体淋巴细胞数量,可以增加IFN-γ 和TNF-α 的产生,进一步刺激DC 表达CD80、CD83 和CCR7,有助于DC 的成熟及迁移。
3.2 改善肿瘤微环境
免疫治疗中另一个不容忽视的问题是肿瘤免疫抑制微环境。CpG 是一种富含胞嘧啶和鸟嘌呤的寡脱氧核苷酸片段,为TLR9 的激动剂,可诱导DC 成熟和增加共刺激标志物以及促炎细胞因子表达,从而改善肿瘤内免疫抑制微环境[15,31]。与cDC相比,pDC 更倾向于增强先天免疫细胞的细胞活性,将pDC 应用于治疗性肿瘤疫苗,也可改善肿瘤免疫抑制微环境。pDC 表达高水平的CXCR3 以及CCR5 配体,可吸引更多的NK 细胞、CD8+T 细胞、CD56+T 细胞和γδT 细胞。黑色素瘤患者在接种受病毒刺激的pDC 疫苗后,免疫效应细胞的数量大量增加,提高了患者总生存率。pDC 与cDC两个DC 亚群结合,将pDC 的对Th1 型化学吸引特性与 cDC 的激活效应T 细胞的特性结合起来,协同提高疫苗效力[32]。
3.3 肿瘤相关抗原递送
使用来自患者自体的肿瘤相关抗原可带来更好的临床结果[33-34]。自体TAA 可以从自体肿瘤细胞的裂解物、mRNA 和自体肿瘤细胞系的mRNA、裂解物中获得。使用患者自体肿瘤衍生突变肽的DC 疫苗增强了T 细胞对TAA 反应的潜力,可识别来自于患者本身全部的肿瘤新抗原[35],大大降低了黑色素瘤转移的可能性。
提高肿瘤治疗性DC 疫苗的疗效也依赖于递送抗原的方法。采用纳米系统递送抗原,可起到延长疫苗的生物活性、增强疫苗的生物利用度、防止抗原降解和可控的抗原释放等作用。纳米系统通过包埋或吸附等方式携载抗原,携载方式的不同会影响DC 亚群的分化[36]。阳离子脂质体是较常用的纳米技术,阳离子脂质体在介导DC 成熟、抗原向MHC I 类分子的呈递中显示出了适用性,可与佐剂或单克隆抗体结合进一步增强疗效[37]。
3.4 免疫联合治疗
疫苗和免疫检查点抑制剂的联合应用将对黑色素瘤产生更好的疗效[38]。针对CTLA-4、PD-1和PD-L1 的单克隆抗体在肿瘤治疗中的临床应用是免疫疗法的一项重大进展。包括伊匹单抗、纳武利尤单抗、帕博利珠单抗和阿替利珠单抗在内的单克隆抗体可阻断抗肿瘤免疫反应的抑制[39]。
与肿瘤治疗性DC 疫苗联合效果较好的是抗CTLA-4 抗体,后者通过解除CTLA-4 对CD28-CD80 共刺激信号的抑制作用来促进初始免疫反应。TriMixDC-MEL 是负载了黑色素瘤抗原的TriMixDC 疫苗,利用电穿孔法导入激活TLR4 的mRNA,可以优化DC的免疫刺激能力[40]。一项临床试验将TriMixDC-MEL 与伊匹单抗(CTLA-4 抗体)联合应用于晚期黑色素瘤患者,该组合在具备良好安全性的同时取得了高效且持久的抗肿瘤免疫效应[41]。利用电穿孔方法制备基于mRNA 的治疗性DC 疫苗可减少生成细胞产品所需的操作,是制备这类黑色素瘤治疗性DC 疫苗常用的方法[41-42]。
4 总结与展望
在多项黑色素瘤的研究中发现,DC 可捕获、处理和呈递抗原,调动免疫细胞参与抗肿瘤,具有启动免疫反应、激活抗肿瘤的T 细胞、调节并维持免疫反应的功能,弥合先天免疫和获得性免疫之间的差距[17,43],这也成为了DC 疫苗的潜在益处。虽然DC 疫苗是抑制黑色素瘤转移的有效手段,但是20 多年前基于DC 的疫苗的首次尝试的结果并不理想。DC 的不成熟以及肿瘤微环境的免疫障碍是DC 疫苗应用中所需要解决的主要问题。为增强其疗效可采用以下方法:适当的疫苗佐剂刺激DC 成熟或迁移、增强效应T 细胞功能的免疫激动剂,选择合适的抗原载体招募更多的免疫细胞以改善肿瘤内部的免疫微环境、采用自体肿瘤作为抗原或改进抗原的递送等。此外,DC 疫苗与免疫检查点抑制剂联合治疗的方法对黑色素瘤也行之有效。
总之,治疗性DC 疫苗在预防或延迟黑色素瘤复发和转移中展现了独特优势,在个性化医疗非常有前景,具备临床安全性上的优势,未来DC 方面疫苗在黑色素瘤以及其他肿瘤治疗领域将有更好的应用。

