基于“肾主骨”理论的FGF23-Klotho轴调控Wnt/ β-catenin信号通路与CKD-MBD的关系探讨
崔师妍,姜 晨*
(1.天津中医药大学第一附属医院,天津 300381;2.国家中医针灸临床医学研究中心,天津 300381)
慢性肾脏病-矿物质和骨异常(Chronic kidney disease-mineral and bone disorder,CKD-MBD)主要是由慢性肾脏病导致的矿物质及骨代谢异常综合征,在临床上常表现为钙、磷、甲状旁腺激素(Parathyroid hormone,PTH)或维生素D的代谢异常;骨转化、矿化,骨容量,骨线性生长或骨强度异常;血管或其他软组织的钙化。目前,慢性肾脏病(Chronic kidney disease,CKD)是全球公共卫生问题,全球约有380万CKD患者[1]。CKD-MBD是伴随CKD患者肾功能下降的常见并发症之一,是 CKD 患者高发病率和高死亡率的主要原因之一[2],严重影响了CKD患者生存质量与临床预后。近期研究发现,其与由骨细胞和成骨细胞分泌的骨成纤维细胞生长因子23(FGF23)及由肾脏高表达的Klotho蛋白、甲状旁腺激素(PTH) 水平及Wnt/β-catenin通路的异常表达有关,而FGF23-Klotho信号轴将肾脏与骨骼的病理紧密连接,这表明FGF23-Klotho轴与“肾主骨”理论的内涵具有密切联系。
中医学“肾主骨”理论认为骨的生理病理特点与肾精的强弱有着密切关系,《素问·上古天真论》言:“肾者主水,受五脏六腑之精而藏之……今五脏皆衰,筋骨解堕”,论述了肾中封藏之精与筋骨正常的生理活动密切相关,若五脏六腑气血调和充盛,肾精封藏有源则筋骨壮盛,若五脏六腑受损,无精以藏则筋骨软弱无力,行步不正。《素问·肾气通天论》载:“肾气乃伤,高骨乃坏”,提示肾气衰弱可导致骨骼病变,这与现代医学所论述CKD患者肾功能下降引起的钙磷代谢紊乱、PTH分泌失调和维生素D代谢紊乱,可导致CKD患者发生矿物质和骨代谢异常相似,其与中医学“肾主骨”理论有内在的一致性。
1 中医学对“肾主骨”理论和CKD-MBD的认识
“肾主骨”理论最早见于《黄帝内经》,其中,《素问·阴阳应象大论》言:“肾主骨生髓”,《素问·六节藏相论篇》亦有论述:“肾者,主蛰,封藏之本,精之处也,其华在发,其充在骨”,表明肾脏与正常的骨骼及骨髓的充养关系密切。在人体正常生理功能维持上,“肾主骨”理论亦发挥着重要作用。例如,《素问·上古天真论》以“女子七岁,肾气盛,齿更发长……三七,肾气平均,故真牙生而长极……七七,任脉虚……故形坏而无子也”,以及“丈夫八岁,肾气实,发长齿更……三八,肾气平均,筋骨劲强,真牙生而长极……五八,肾气衰,发堕齿槁……七八,肾藏衰,形体皆极;八八,则齿发去”,论述了人体生长发育及生殖的一般规律,在这一过程中骨骼也产生相应的变化,体现了“肾精”在人体生长发育及骨骼壮衰中的重要作用。若肾脏渐衰,精气渐少则“形坏”“齿发去”“形体皆极”。《素问·五脏生成篇第十》载:“肾之合骨也,其荣发也,其主脾也”,《中西汇通医经精》言:“肾藏精,精生髓……髓在骨中,髓足则骨强”,说明肾中之精气具有生髓充骨的生理功能,亦说明肾与骨之间具有特殊联系。
中医学并无CKD-MBD的对应病名,但可将其归属于中医学“骨痿”“骨痹”“虚劳”等范畴,与“肾主骨”理论的病理表现具有内在联系。张从正所著《儒门事亲》述:“筋痹不已,而成骨痹。久而不已,内舍其合。”《素问·痹论篇第四十三》言:“骨痹不已,复感于邪,内舍于肾。”从而可知骨病与肾病关系密切,常可相互影响。肾为先天之本,脾为后天之本,《景岳全书》云:“胃为水谷之海,得后天之气也,人之始生,本乎精血之原,人之既生,由于水谷之养,非精血无以立形体之基,非水谷无以成形体之壮。”脾之健运,化生精微,肾中精气亦有赖于水谷精微之充养,方可不断充盈与成熟,是谓“后天养先天”。《灵枢·五癃津液别》亦有论述:“五谷之精液和合而为膏者,内渗于骨空,补益脑髓。”CKD患者病起常以脾肾亏虚、脾肾阳虚为主要证候表现[3]。脾肾亏虚,失于固摄,精微外泻而致气血、骨髓生化无源,故CKD患者临床常见周身乏力、腰膝酸软、尿浊、舌淡苔白,脉弦细等症状,亦提示“肾精”之充盛离不开后天脾胃运化的水谷之精。脾健肾益,“肾精”充足,肾气化生有源,则脏腑、经络、四肢筋骨有养,气血津液运行输布协调,以免水湿、痰浊和瘀血等病理产物附着于骨、阻滞于脉络,避免“骨痿”“骨痹”的发生。《灵枢·本神篇》曰:“精伤则骨酸痿厥”,亦提示精与骨之间存在着密切联系。肾可接受五脏六腑之精而封藏之,将封藏的“精”“髓”,充养于骨,保持骨成分、结构的正常来维持骨的正常生长发育。“肾精”充足则骨髓充盈,濡养筋骨关节,使骨坚固有力,四肢关节活动自如。若肾虚精亏,气血、骨髓生化无源,无以充养四肢百骸,易导致骨质疏松、骨折等骨病的发生。基于此,肾中精气的盛衰与骨骼正常的生理功能密切相关,是导致CKD-MBD的关键所在,这与“肾精”的作用及“肾主骨”理论不谋而合。
基于“肾主骨”理论,多数医家认为CKD-MBD的基本病机包括脾肾亏虚,成骨乏源;久病浊毒内蕴、瘀血阻络损筋伤骨,属本虚标实、虚实夹杂之证,强调以益肾、健脾、壮骨、降浊化瘀为主的治疗原则。例如,李培旭教授自拟肾衰肾性骨病经验方(菟丝子、桑寄生、威灵仙、炒白芍各20g,枸杞子、淫羊藿、补骨脂、骨碎补、巴戟天、炒杜仲、当归各15g,川芎10g)以补肾填精健骨、调补肝肾、强筋壮骨、养血活血止痛,临床获得较好疗效[4]。杨金凤等[5]以补肾壮骨汤辅助治疗合并肾性骨病的维持性血液透析患者,对照组患者予常规西药治疗,治疗组患者在此基础上加用中药补肾壮骨汤,结果显示,治疗组患者治疗总有效率91.43%,且治疗后的血清钙水平明显高于对照组,血磷、PTH水平、SCr、BUN水平均显著低于对照组,差异有统计学意义(P<0.05),提示维持性血液透析配合补肾壮骨汤能较好地改善肾性骨病患者的骨代谢异常和钙磷代谢紊乱状况。马晓燕教授以“肝肾同源”为理论基础论治肾性骨病,常用熟地、山药、山茱萸、牡丹皮、茯苓、菟丝子等以滋补肝肾;用续断、杜仲以补肾强腰;用菊花、钩藤以平肝潜阳等,临床应用亦见不凡疗效[6]。郑新教授认为CKD-MBD的病因病机基本特征是“本虚标风”,提出从“风”论治CKD-MBD,对于证属脾胃虚弱、气血亏虚的CKD-MBD患者,常采用培土宁风法健脾气、充肾精、熄内风,常选用黄芪、党参、白术、当归、鸡血藤等补脾生化气血,从而使肾精得养,髓海得充而“风”自灭[7]。众多医家围绕“肾主骨”理念,根据病理因素不同,治疗以补肾壮骨、益肾健脾、补肾活血等方法,取得较为满意的临床疗效,体现出从肾论治CKD-MBD的合理性与可行性,是对“肾主骨”理论的进一步验证和发展。
2 FGF23-Klotho轴、Wnt/β-catenin通路与CKD-MBD的相关性
FGF23是骨源性多肽激素中FGF19亚家族成员,SUGIURA H等[8]通过动物模型发现,FGF23在CKD动物模型中存在不同程度升高,可能与体内磷、PTH、活性维生素D3(1,25(OH)2D3)水平有关。另有学者提出CKD患者体内钙磷、PTH及维生素D代谢紊乱可刺激FGF23的合成和分泌,并且在CKD早期就可存在FGF23的表达增加[9]。FGF23对磷、PTH及维生素D的合成分泌也具有调控作用[10]:FGF23通过抑制钠磷协同转运蛋白Npt2a和Npt2c的产生及肾小管上皮细胞1-α羟化酶(Cyp27b1)的表达,增加近端肾小管对磷酸盐的重吸收,以此降低血磷水平、减少活性维生素D的生成。ZHANG L N等[11]通过对CKD5期患者行前瞻性观察研究发现,CKD患者血浆FGF23水平高于健康对照组,而严重的继发性甲状旁腺功能亢进患者血浆FGF23水平更高。对CKD患者而言,肾小管功能进行性减退,FGF23对血磷的适应调节能力下降,处于失代偿的状态,血磷始终保持较高浓度,促使FGF23再分泌;高水平的FGF23亦使维生素D水平降低,进一步刺激PTH分泌、甲状旁腺增生,最终导致继发性甲状旁腺功能亢进,影响CKD-MBD的进展。
Klotho蛋白是在肾脏中高表达的保护性抗衰老蛋白。在急性肾损伤、肾纤维化、糖尿病肾病等慢性肾病患者中,随着eGFR的下降,患者全身和肾内Klotho水平急剧下降[12-13]。Klotho蛋白通过与FGF23及成纤维细胞生长因子受体(FGFR)结合,形成高亲和力共受体Klotho/FGFR/FGF23复合物,活化FGF23因子,进而激活FGF信号通路[14],从而降低血磷来纠正电解质紊乱,维持骨代谢稳态。近年来,有研究显示,早期CKD即可发生FGF23-Klotho轴紊乱,表现为血清中Klotho表达降低和FGF23水平增高[15]。CKD患者Klotho的低表达,可导致FGF23与FGFR的亲和力下降,FGF23的降磷通路受阻,血清中FGF23、PTH水平持续性升高,从而参与矿物质代谢紊乱、继发性甲状旁腺功能亢进、血管钙化和心脏肥厚等一系列疾病的进展,继而干扰正常骨形成和吸收过程。KOMABA H等[16]发现骨细胞中存在Klotho,Klotho的骨细胞特异性缺失提升了骨量及骨形成速度,并且对矿物质离子稳态起关键作用,但骨细胞中Klotho的这种骨骼效应会随着肾功能逐渐下降而减弱。这可能是因为CKD-MBD本身的影响或Klotho在骨细胞中下调的影响。
Wnt/β-catenin信号通路通过调节成骨细胞和破骨细胞活性,调控骨形成及骨吸收,是维持骨量的重要因素之一[17]。Wnt/β-catenin可通过T细胞因子(TCF)/淋巴细胞增强因子(LEF)反应元件直接诱导成骨细胞中骨形态发生蛋白BMP-2的表达,增强其转录活性,诱导间充质干细胞向成骨细胞分化。Wnt/β-catenin信号亦可激活Wnt靶基因Runx2的表达来调控成骨细胞及软骨细胞的分化与成熟[18]。Wnt/β-catenin信号通路构成复杂,由众多受体、抑制剂、激活剂、调节剂、磷酸酶等组成,其中最为关键的是β-catenin。β-catenin是维持骨稳态和机械转导所必需的中心分子,骨细胞中β-catenin的丢失或功能获得的异常会导致骨量的减少或增加[19]。另有研究表明,CKD患者血清硬化蛋白 (SOST)及Dickkopf 1(DKK1) 均有不同程度升高[20]。SOST、DKK1为β-catenin的靶向作用蛋白,是Wnt通路的主要抑制剂之一,可参与阻止骨形成[21]。
由此可知FGF23、Klotho水平的变化,FGF23-Klotho轴的紊乱,Wnt/β-catenin信号通路的异常表达在一定程度上影响了正常骨代谢,与CKD-MBD联系密切,是加速CKD-MBD进展的主要因素之一。
3 FGF23-Klotho轴调控Wnt/β-catenin信号通路参与CKD-MBD的进展
有学者称Wnt/β-catenin通路为肾脏-PTH通路的下游通路[22-23]。随着CKD患者肾功能进一步减退,FGF23-Klotho轴紊乱,对钙磷、PTH的调控失代偿,导致不同程度的继发性甲状旁腺功能亢进,PTH持续处于高水平状态,进而影响Wnt/β-catenin信号通路的表达。PTH与PTH受体1 (PTHR1) 结合后与低密度脂蛋白受体相关蛋白6(LRP6)形成复合物,通过募集支架蛋白(Axin),抑制糖原合成酶激酶3(GSK-3)对β-catenin的磷酸化,从而稳定β-catenin,激活β-catenin信号[24],刺激Wnt信号通路来参与骨代谢。ROMERO G等[25]发现β-catenin信号的骨形成卷曲蛋白(FZD)的激活需要接头蛋白(Dvl),而PTH1R中恰好存在Dvl结合基序,PTH1R可不通过Wnt 或 LRP6而直接募集Dvl来激活β-catenin信号通路。PTH还可通过调控SOST、DKK1和β-catenin的表达,影响Wnt/β-catenin信号通路的表达状态,参与骨代谢的调控。PTH可直接抑制骨SOST的转录[26],减少DKK1的表达[27]进而促进Wnt信号传导,增加成骨细胞的数量。但高水平的PTH和SOST在CKD患者中并存,PTH对SOST的抑制效应或可被进行性下降的肾功能所掩盖[28]。
PTH尚可通过骨保护素(OPG)/核因子kappaβ受体活化因子(RANK)/核因子kappaβ受体活化因子配体(RANKL)通路间接参与骨吸收的生理和病理过程。成骨细胞和骨细胞中的PTH受体信号可通过增加RANKL的产生[29],减少成骨细胞中OPG的合成[30],增加 RANKL/OPG 比值,增加破骨细胞的募集,提高破骨细胞的活性,从而刺激骨吸收,导致骨矿物质的流失[31-32],这可能是肾性骨病向高转化型发生的原因之一。OPG既是RANKL的诱饵受体,又是Wnt/βcatenin的靶基因,还是骨吸收的抑制剂[33]。成骨细胞中Wnt/βcatenin的激活会增加OPG表达[34-35],OPG可竞争性阻断RANKL与RANK结合,降低RANKL/OPG比值,抑制破骨细胞进一步分化成熟,减少骨吸收[36-37],进而调控CKD-MBD的发生、发展。CARRILLO-LPEZ N等[38]发现,FGF23也可直接抑制成骨细胞中Wnt信号通路导致骨质的流失。
综上,FGF-23/Klotho轴紊乱可影响PTH水平,异常水平的PTH可通过调控Wnt/β-catenin信号通路相关蛋白及OPG/RANK/RANKL通路的RANKL、OPG受体表达调节骨形成和骨吸收,从而参与CKD-MBD的发生、发展进程。肾-骨轴关系简化图见图1。
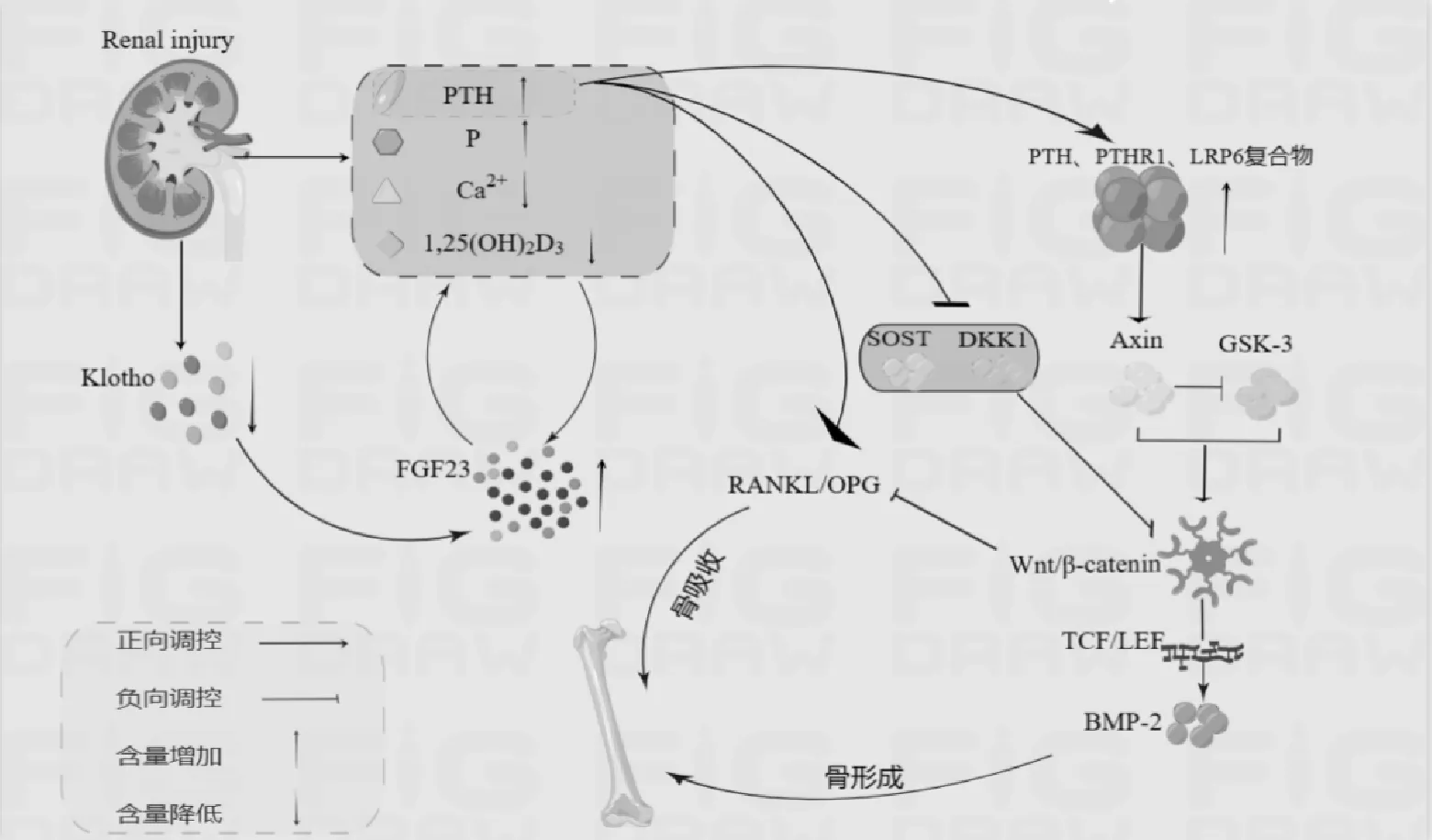
图1 肾-骨轴关系简化图
4 “肾主骨”理论与FGF23-Klotho轴、Wnt/β-catenin信号通路的联系
Klotho是一种抗衰老蛋白,最新研究报告显示,在哺乳动物机体内,若出现Klotho蛋白的缺失,人体立即呈现衰老趋势,包括骨-肾损伤。这与肾藏精,主生长发育和生殖及骨骼壮衰的生理作用相一致。Klotho蛋白通过与FGF23、FGFR 结合,形成高亲和力共受体来参与骨代谢,随着CKD患者肾功能逐渐下降,Klotho水平也随之下降,“肾精”逐渐衰减,累及骨的正常代谢从而造成“骨痿”“骨痹”等骨病,因此可以认为Klotho蛋白或为“肾精”的重要成分组成之一[39]。FGF23是重要的调磷因子,随着CKD患者肾小管功能进行性减退,血磷始终保持较高浓度,促使FGF23过度堆积,这恰与CKD患者素体脾肾亏虚,加之体内水湿停滞、久积成毒成瘀,瘀滞于脏腑、经络、骨骼的基本病机相契合。Klotho蛋白表达降低可诱导FGF23抵抗,对PTH的作用减弱,促进继发性甲状旁腺功能亢进的发生,且高PTH诱导骨释放磷入血,加重钙磷代谢紊乱。FGF23-Klotho轴的失衡是导致肾性骨病的主要原因之一,基于中医学“肾主骨”理论表述该病理机制,即为“肾精”亏虚(Klotho蛋白低表达),脏腑功能失调,引起浊毒内蕴(FGF23的过量蓄积),四肢百骸失于濡养,导致肾“主骨”的异常(异常的骨代谢)。有临床研究表明,补肾中药如骨碎补、牛膝、肉苁蓉、淫羊藿等,可以通过Wnt/β-catenin 信号通路等调节骨形成[40-43],这提示肾脏可通过 Wnt/β-catenin通路起到“主骨”作用。低水平的Klotho,高水平的FGF23、PTH等影响Wnt/β-catenin信号通路活性,从而调控CKD患者骨形成和骨吸收,进而参与CKD-MBD的发生、发展,其主要机制契合中医“肾主骨”理论内涵。
5 结语
由CKD患者肾功能进行性下降引起的FGF23-Klotho轴紊乱、PTH、钙磷水平的变化导致了Wnt/β-catenin信号通路活性改变,从而参与CKD-MBD的进程。CKD-MBD的临床表现不仅仅是异常的骨代谢,亦可表现为心脑血管钙化,导致心脑血管事件高风险,严重威胁CKD患者的生存质量。因此,积极探讨CKD-MBD的发病机制并寻求有效的防治方案,对于延缓患者肾脏病进程和改善预后极为重要。中医学“肾主骨”理论是经典医学理论之一,其理论内涵与CKD-MBD的骨代谢异常有一定的契合点,且从肾论治CKD-MBD亦是诸多医家行之有效的治疗大法。因此,深化对“肾主骨”理论内涵的认识,进一步挖掘中医学经典及从肾论治CKD-MBD的具体机制具有较为重要的临床意义。

