速溶黄大茶辅助降血糖功能及机制研究
李 睿,马 征,李心伟,朱 玉,王一君,罗胜勇*
(1.安徽省医学科学研究院,安徽 合肥 230061;2.安徽医学高等专科学校,安徽 合肥 230601; 3.安徽农业大学 茶树生物学与资源利用国家重点实验室,安徽 合肥 230061)
糖尿病(Diabetes mellitus,DM)是一种由多种病因引起的,以体内糖、脂肪、蛋白质、水和电解质紊乱为特征的代谢性疾病[1],其病因主要牵涉机体胰岛功能的减退及靶组织对胰岛素敏感性的降低。而长期的高血糖则会引起多种并发症,如视网膜病变、肾病以及神经病变等,且病程无法逆转[2]。目前,根据WHO标准,将糖尿病分为四型,分别为Ⅰ型、Ⅱ型、妊娠期及其他特殊类糖尿病。其中Ⅱ型糖尿病为主要的发病类型,发病人数占我国糖尿病总发病人数的95%左右[3]。目前临床对于Ⅱ型糖尿病的治疗仍以口服化学性药物及注射胰岛素为主,但化学性药物普遍存在安全剂量范围小、毒副反应大等不良作用[4],因此寻找一种天然化合物替代化学性药物已成为当今预防和治疗糖尿病发生的一种新思路。
大叶黄茶(Large-leaf yellow tea,LYT)是中国茶叶中的一种特色类型,产自安徽省霍山县,由成熟的叶和茎冲泡而成。已有研究发现,与绿茶或红茶等其他茶相比,LYT在调节血糖方面具有明显优势[5,6]。速溶黄大茶(Instant Huangda tea,IHT)是利用大叶黄茶进行深加工制成的一类保健食品,其口味及便捷性更加符合目前大众的健康饮食需求。为了明确速溶黄大茶的辅助降血糖作用,本研究拟借助地塞米松诱导胰岛素抵抗糖脂代谢紊乱模型,初步探讨速溶黄大茶的降血糖作用及机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 选取SD雄性大鼠80只,体质量(150±20)g,由南通大学提供,合格证号:20200906,饲养于安徽省医学科学研究院屏障实验室内(许可证号:SCXK(皖)2019-008),温度18~24℃,相对湿度40% ~70%,实验期间各组动物按试验方案摄食饮水。
1.1.2 试剂与仪器 速溶黄大茶(IHT),黄色粉末,由安徽农业大学茶树生物学与资源利用国家重点实验室提供(批号:20181115,规格:2.5g/袋,人用量为1袋/d,实验时用蒸馏水配成0.42g/mL母液);醋酸地塞米松注射液(批号:20190912),购于上海通用药业股份有限公司;标准实验鼠粮、高热能鼠饲料(规格:25kg/袋),购于江苏省协同医药生物工程有限公司;大鼠胰岛素(Ins)ELISA试剂盒,购于深圳子科生物科技有限公司;α-葡萄糖苷酶(酶活力为14.72U/mg),购于美国Sigma公司;阿卡波糖(批号:20200115)、对硝基苯基-α-D-吡喃葡萄糖苷(PNPG,批号:20191004),购于北京索莱宝科技有限公司。茶多酚标准品(批号:DSTDC013001)、表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)标准品(批号:DSTDB003601),均购于成都德思特生物技术有限公司。DS-3型血糖仪,购于翔国科技有限公司;DS-671电子秤,购于上海寺冈电子有限公司;IMARK酶标仪,购于bio-rad公司;7020生化分析仪,购于日本日立公司;LC-20AT高效液相色谱仪,购于日本岛津公司。
1.2 实验方法
1.2.1 HPLC测定IHT中EGCG及茶多酚的含量 称取0.2077g IHT溶于甲醇定容至10mL,超声30vmin后,0.45μm滤器过滤,取其中1mL溶液加入甲醇,定容至5mL(稀释5倍);称取茶多酚标准品2.659mg,溶于甲醇定容至10mL;称取EGCG标准品0.495mg,溶于甲醇定容至10mL;分别进样,测定其高效液相色谱。
1.2.2 速溶黄大茶剂量选择及给予方式 IHT人体推荐量为2.5g/d,即42mg/kg。采用大鼠进行实验,以人体推荐量的2.5、5、10倍剂量作为相应剂量,分为105mg/kg、210mg/kg、420mg/kg共3个剂量组。用蒸馏水将IHT溶解成1.05g/100mL、2.1g/100mL、4.2g/100mL共3个浓度。灌胃给予相应浓度IHT,灌胃容积1mL/100g。
1.2.3 对正常大鼠空腹血糖的影响 选取SD大鼠30只,随机分为对照组和IHT组两个剂量组,每组15只。受试样品组给予高浓度(4.2g/100mL)IHT,对照组给予同体积溶剂(蒸馏水)。连续给30d后,禁食4h测空腹血糖值,比较两组空腹血糖值。
1.2.4 模型建立及给予受试样品 选取SD大鼠50只,普通维持料适应饲养3d后,禁食4h,测定空腹血糖值(0h),之后灌胃给予2.5g/kg BW葡萄糖并测定0.5、2h血糖值。以所测值将大鼠分为5组,每组10只,分别为空白对照组、模型组、IHT3个剂量组。3个剂量组灌胃给予相应浓度IHT,空白对照组不进行处理,模型对照组给予同等体积溶剂,连续35d。其中第1周各组给予维持料饲养,1周后模型对照组和3个剂量组更换高脂饲料进行饲喂,2周后模型对照组和3个剂量组在高脂饲料基础上,分别给予0.8mg/kg BW地塞米松腹腔注射,1次/d,连续14d。实验结束,各组动物禁食4h,之后按相应指标检测。实验流程,见图1A。
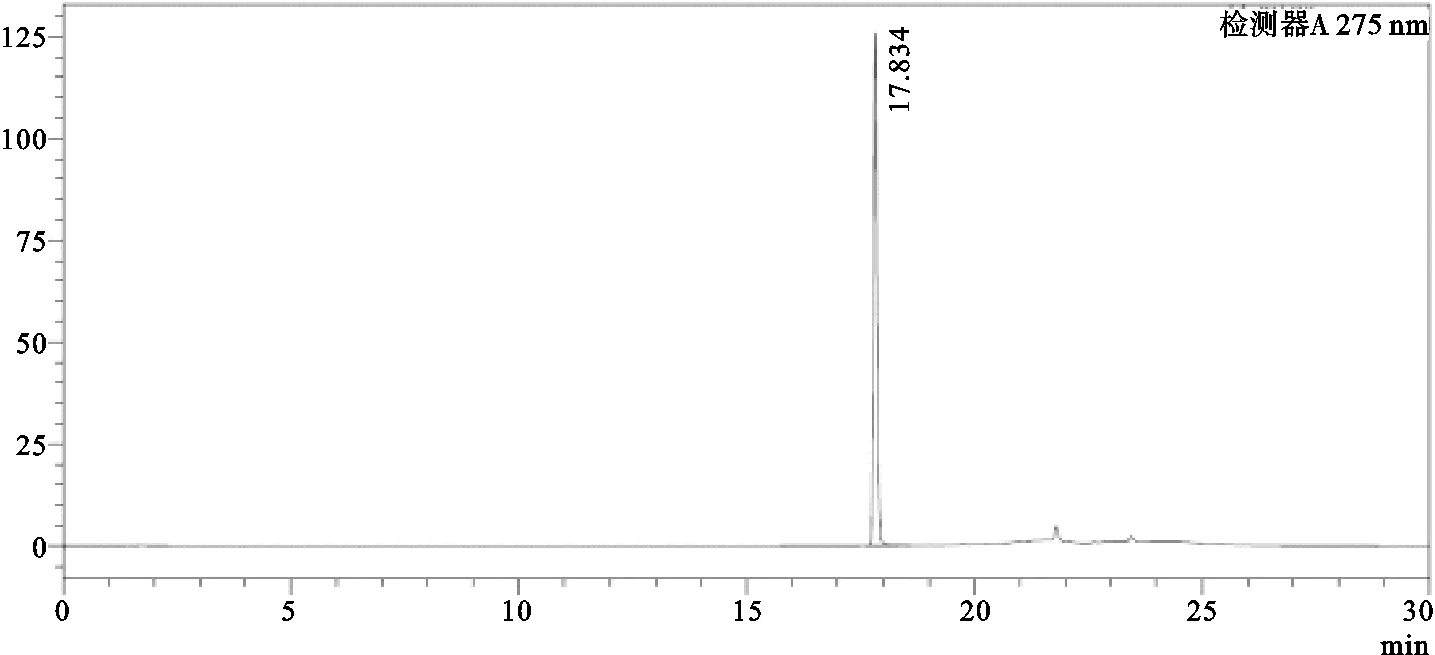
图1 EGCG的HPLC
1.2.5 测定给样后空腹血糖 各组动物禁食4h后,尾部取血,用血糖仪测定血糖值,即为空腹血糖值,比较各组大鼠血糖值及血糖下降的百分率。计算公式:

1.2.6 给样后糖耐量测定 以空腹血糖值作为给葡萄糖前(0h)血糖值,IHT组给予不同浓度IHT,模型对照组给予同体积溶剂,空白对照组不做处理,20min后各组经口给予葡萄糖2.5g/kg BW,测定给葡萄糖后各组0.5、2h的血糖值,若模型对照组0.5h血糖值≥10mmol/L,或模型对照组0.5、2h任一时间点血糖升高或血糖曲线下面积升高,与空白对照组比较,差异有显著统计学意义,则判定糖代谢紊乱模型成立,在此基础上,观察模型对照组与IHT组空腹血糖、给葡萄糖后(0.5、2h)血糖及0、0.5、2h血糖曲线下面积的变化。计算公式:
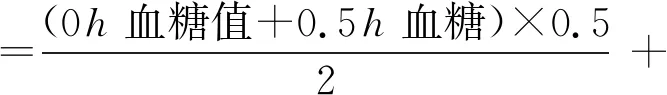
1.2.7 给样后血清中胆固醇、甘油三酯含量测定 各组动物禁食4h,采用7020生化分析仪检测血清中胆固醇、甘油三酯含量。
1.2.8 给样后胰岛素抵抗指数测定 各组动物禁食4h,ELISA法检测血清胰岛素,按下式计算胰岛素抵抗指数:

1.2.9 α-葡萄糖苷酶活性测定 取40μL α-葡萄糖苷酶液(0.04U/mL)和40μL IHT于试管中,其中IHT高、中、低剂量组的浓度分别为4mg/mL、2mg/mL、1mg/mL,将混合物于37℃水浴5min,之后加入20μL PNPG底物溶液(0.5mmol/L),37℃水浴30min,继续加入50μL Na2CO3溶液(0.2mol/L)终止反应,室温5min,采用酶标仪于405nm 处测定吸光度值A(检测结果,见表1)。此外,另设阿卡波糖(1mg/mL)作为阳性对照组,每组设6个复孔,按照下式计算抑制率:
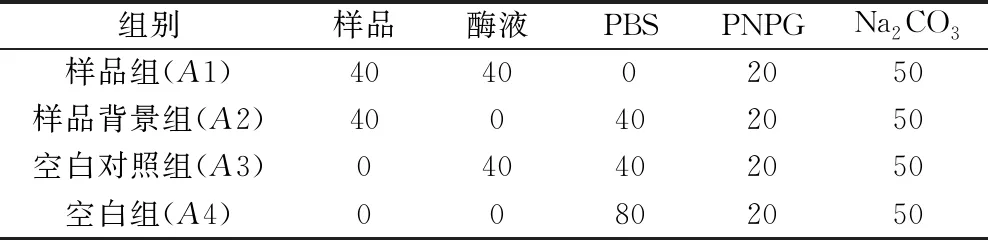
表1 α-葡萄糖苷酶活性抑制试验反应体系 (μL)

1.3 统计学方法

2 结果与分析
2.1 IHT中EGCG及茶多酚含量
结果如图1、图3所示,EGCG的保留时间为17.834min,峰面积为688 318;IHT中EGCG保留时间为17.799min,峰面积为3 483 238;通过计算得IHT中EGCG的含量为30.23mg/g。此外根据图2所示,茶多酚中EGCG的保留时间为17.811min,峰面积为2 058 964,计算可得茶多酚中EGCG的含量为556.86mg/g,由此推算IHT中茶多酚含量约为5.43%。
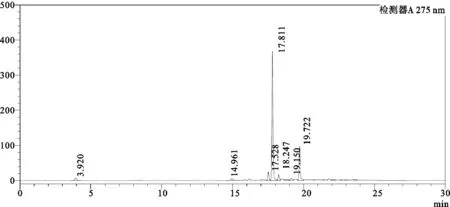
图2 茶多酚的HPLC
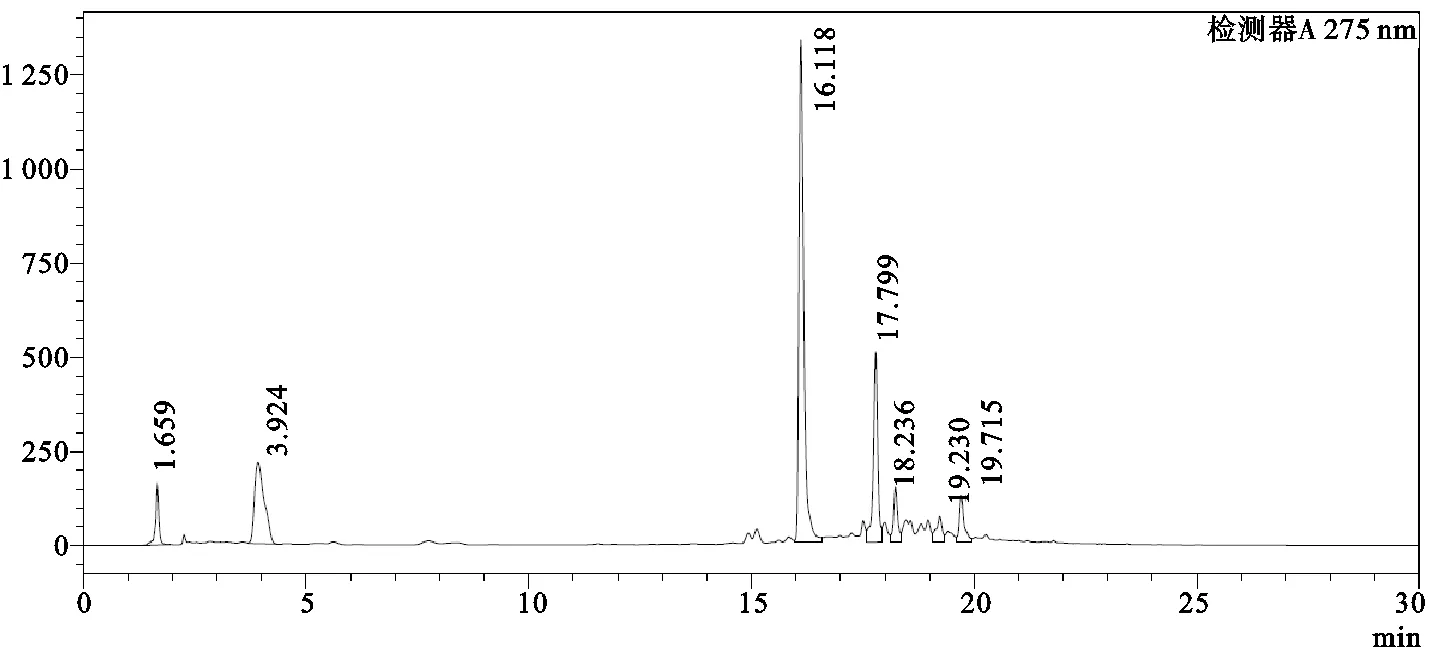
图3 IHT的HPLC
2.2 对正常大鼠空腹血糖的影响
灌胃给予IHT 35d后,与空白对照组相比,IHT高剂量组大鼠空腹血糖无明显差异,可判定IHT对正常大鼠血糖无影响,可以进行后续实验。见表2。
表2 对正常大鼠空腹血糖影响
2.3 对地塞米松诱导胰岛素抵抗糖/脂代谢紊乱模型大鼠体质量的影响
与正常对照组比较,模型组大鼠在给予地塞米松之后体质量呈逐渐下降趋势;与模型组比较,IHT 3个剂量组均能有效逆转模型组大鼠体质量下降趋势。见图4。
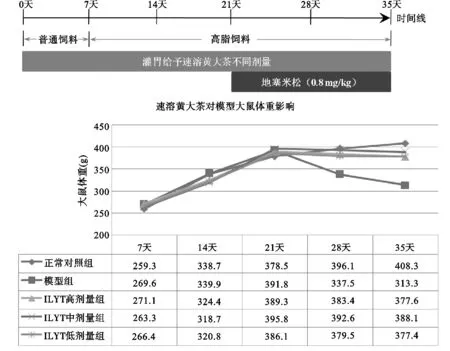
图4 IHT对模型大鼠体质量的影响
2.4 对地塞米松诱导胰岛素抵抗糖/脂代谢紊乱模型大鼠空腹血糖的影响
与空白对照组比较,模型组大鼠空腹血糖及血糖下降率无明显改变(P>0.05);与模型对照组比较,IHT 3个剂量组大鼠空腹血糖及血糖下降率也无明显改变(P>0.05)。见表3。

表3 IHT对模型大鼠空腹血糖的影响
2.5 对地塞米松诱导胰岛素抵抗糖/脂代谢紊乱模型大鼠糖耐量的影响
各组大鼠经灌胃给予葡萄糖后,模型组大鼠0.5h血糖值(13.49mmol/L)≥10mmol/L,且与空白对照组比较,血糖下曲线面积明显升高(P<0.01),可判定糖代谢紊乱模型成立。与空白对照组比较,模型组大鼠血糖在0.5、2h升高(P<0.05),血糖曲线下面积明显升高(P<0.01);而与模型组比较,IHT3个剂量组0.5、2h血糖明显下降,曲线下面积明显下降(P<0.01)。见表4。

表4 IHT对模型大鼠糖耐量的影响
2.6 对地塞米松诱导胰岛素抵抗糖/脂代谢紊乱模型大鼠血清胆固醇、甘油三酯的影响
与空白对照组比较,模型组大鼠血清总胆固醇、甘油三酯明显升高,差异有显著统计学意义(P<0.01)。与模型对照组比较,IHT高、中剂量组血清总胆固醇含量降低(P<0.05),甘油三酯无明显变化(P>0.05);IHT低剂量组血清总胆固醇及甘油三酯含量均无明显改变(P>0.05)。见表5。
表5 IHT对模型大鼠总胆固醇、甘油三酯的影响
2.7 对地塞米松诱导胰岛素抵抗糖/脂代谢紊乱模型大鼠血清胰岛素抵抗指数的影响
与空白对照组比较,模型组大鼠血清胰岛素水平明显升高,胰岛素抵抗指数升高,差异有显著统计学意义(P<0.01)。与模型对照组比较,IHT高、中剂量组血清胰岛素水平降低(P<0.05),胰岛素抵抗指数下降(P<0.05);IHT低剂量组可减少血清胰岛素水平(P<0.01),而对胰岛素抵抗指数无明显影响(P>0.05)。见表6。
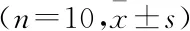
表6 IHT对模型大鼠胰岛素抵抗指数的影响
2.8 对α-葡萄糖苷酶活性的抑制作用
IHT 3个剂量组均能对α-葡萄糖苷酶产生抑制作用(对α-葡萄糖苷酶的抑制率均>50%)。IHT高剂量组与IHT中剂量组对α-葡萄糖苷酶抑制率分别为(62.74±4.17)%以及(61.58±5.93)%,与阿卡波糖对α-葡萄糖苷酶抑制率(60.22±3.56)%,无明显差异(P> 0.05);而IHT低剂量组对α-葡萄糖苷酶抑制率为(54.41±4.04)%,与阿卡波糖相比,有统计学差异(P<0.05)。见图5。
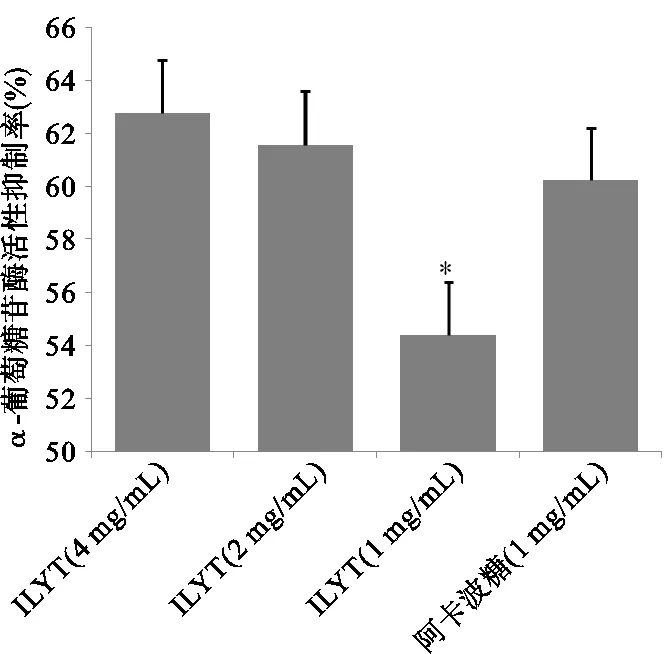
注:与阿卡波糖组比较,*P<0.05。
3 结语
Ⅱ型糖尿病(Type 2 diabetes mellitus,T2DM)是糖尿病中较为常见的一种类型,其临床特征表现为血浆葡萄糖异常升高,其发生机制主要与胰岛β细胞功能障碍和不同程度的胰岛素抵抗引起的糖、蛋白质、脂肪代谢紊乱有关[7-8],而IHT研究主要针对调控Ⅱ型糖尿病。因此,根据以上T2DM的特征,本研究选用了高脂饲料诱导(4周)联合低剂量地塞米松注射(14d)的方法建立Ⅱ型糖尿病大鼠模型[9],结果显示,造模后与正常对照组大鼠比较,模型组大鼠体质量明显降低,血清中总胆固醇、甘油三酯含量明显升高,同时伴随胰岛素抵抗指数增加,此外,模型组大鼠0.5、2h血糖值和血糖曲线下面积均高于正常对照组大鼠,提示大鼠胰岛素抵抗糖/脂代谢紊乱模型建立成功,能够模拟Ⅱ型糖尿病模型,可为后续药物干预提供实验基础。
目前,临床上治疗T2DM的药物主要包括胰岛素及一些口服性降血糖药物,包括磺脲、双胍和糖苷酶抑制剂等,但此类药物在临床应用时存在较多副作用,包括胃肠功能障碍、体质量增加、低血糖和胰岛素抵抗[10],因此,寻找一些毒性和副作用较小的天然产物替代化学性药物治疗发病初期的血糖异常患者有着重要的意义。IHT是一种具有保健作用的食品,茶多酚中的EGCG是其主要组成成分之一。已有研究表明,TP中的EGCG有显著的降低血糖作用[11,12]。本研究发现,与模型组比较,IHT能够明显降低大鼠给予葡萄糖后0.5h及2h的血糖值,且曲线下面积也明显下降,提示IHT能够升高模型组大鼠的糖耐量指标。此外,IHT能够明显降低血清中总胆固醇含量及胰岛素抵抗指数,但是对模型大鼠空腹血糖无明显作用。因此可推测IHT的辅助降血糖作用主要与调控餐后血糖水平有关。
α-葡萄糖苷酶(α-glucosidase)是糖苷水解酶大家族中的一类,其在生物体内分布广泛,主要参与生物体内的食物代谢、多糖和糖蛋白的合成等[13]。当机体摄入食物(淀粉)后,唾液淀粉酶能将多糖消化成寡糖,而α-葡萄糖苷酶则能将进入小肠的寡糖分解为单个葡萄糖,并为小肠吸收,升高餐后血糖水平[14]。因此可以通过抑制小肠内α-葡萄糖苷酶的活性,延缓或降低葡萄糖在肠道内的吸收,调整机体血糖的水平,改善Ⅱ型糖尿病患者的临床症状[15]。此外有文献报道,EGCG能够显著抑制α-葡萄糖苷酶活性[16],本研究也发现IHT3个剂量组均能有效抑制α-葡萄糖苷酶活性(抑制率>50%),且与阳性药物阿卡波糖相比,IHT高、中剂量组对α-葡萄糖苷酶抑制率无明显差异,提示我们IHT对地塞米松诱导胰岛素抵抗糖/脂代谢紊乱模型大鼠辅助降血糖作用与抑制α-葡萄糖苷酶活性有关。
综上所述,IHT作为一种新型保健食品,具有明确的辅助降血糖作用,并具备对Ⅱ型糖尿病预防和治疗的潜力,而其作用机制主要与抑制α-葡萄糖苷酶活性有关。

