超高效液相色谱-荧光法同时测定鸡肉中14种喹诺酮类和16种磺胺类药物残留
王晓茵, 武云龙,, 孙晓亮, 李木子, 宋翠平, 曹旭敏, 霍乃蕊, 赵思俊
(1. 中国动物卫生与流行病学中心, 山东 青岛 266032 ; 2. 山西农业大学动物医学院, 山西 太谷 030800)
我国是肉鸡和蛋鸡饲养大国,2020年产量达1 480余万吨[1],为我国动物蛋白的消费提供了保障。在养殖过程中,为预防和治疗鸡类疾病,提高其生产性能,喹诺酮类药物和磺胺类药物因具有广谱的抗菌特性,被广泛应用于兽医临床[2]。但是,不合理使用甚至乱用和滥用药物,极易在鸡肉中出现药物残留,对人体产生潜在危害[3]。目前,有关这两类药物残留的检测多采用酶联免疫法[4-6]、液相色谱法[7-10]、气相色谱串联质谱法[11,12]和高效液相色谱-串联质谱法[13-16]等。液相色谱法和液相色谱-串联质谱法以其高灵敏度和准确度被广泛应用于动物源性食品的药物残留检测中,但动物源性食品基质复杂,蛋白和脂肪含量高,喹诺酮类[7-9]和磺胺类[12,17]药物多采用分别测定的残留检测方法。由于这两类药物在兽医临床中广泛应用,建立同时测定这两类药物的残留检测方法具有非常重要的理论意义和实际需求。本试验在前期建立的高效液相色谱-荧光法测定磺胺类药物[17]的基础上,创新性地建立了超高效液相色谱-荧光法同时测定鸡肉中14种喹诺酮和16种磺胺类药物残留的方法。
1 材料与方法
1.1 主要试剂 氟罗沙星、诺氟沙星、培氟沙星、环丙沙星、洛美沙星、达氟沙星、恩诺沙星、奥比沙星、加替沙星、沙拉沙星、二氟沙星、噁喹酸、氟甲喹、萘啶酸、磺胺二甲异嘧啶、磺胺吡啶、磺胺噻唑、磺胺二甲基嘧啶、磺胺甲氧哒嗪、磺胺甲噻二唑、磺胺对甲氧嘧啶、磺胺氯哒嗪、磺胺邻二甲氧嘧啶、磺胺甲噁唑、磺胺曲沙唑、磺胺间二甲氧嘧啶、磺胺氯吡嗪、磺胺苯酰、磺胺苯、磺胺溴二甲嘧啶(纯度>97%),Dr. Ehrenstorfer GmbH公司;荧光胺(纯度99%),Sigma公司;乙腈(色谱纯),默克公司;甲酸(色谱纯),上海安谱实验科技股份有限公司;磷酸盐缓冲液(Phosphate Buffered Saline,PBS)盐包,北京索莱宝科技有限公司;试验用水为超纯水。
1.2 主要仪器 1290-Ⅱ超高效液相色谱仪,安捷伦科技有限公司;5804R高速冷冻离心机,Eppendorf公司;MilliQ超纯水仪,Millipore公司;N-EVAP 112氮吹仪,Organomation公司;Oasis HLB 3CC固相萃取柱,沃特世科技(上海)有限公司。
1.3 溶液配制 标准储备液:分别称取标准品适量,用甲醇溶解并定容,配制成100 μg/mL标准储备液,于-20 ℃条件下保存。
混合标准工作液:分别量取30种标准储备液适量,用甲醇配制成1 000 ng/mL混合标准工作液,于-20 ℃条件下保存。
提取溶液(0.01 mol/L PBS溶液,pH=7.4):取2 L/袋的PBS盐包,用水溶解并定容至2 L。
衍生溶液(0.01 mol/L PBS溶液,pH=3.0):将0.01 mol/L PBS溶液,用0.1 mol/L磷酸调pH至3.0。
衍生试剂(1.0 mg/mL荧光胺乙腈溶液):精确称取荧光胺10 mg,用乙腈溶解并定容至10 mL。
甲醇水溶液(20∶80,V/V):准确量取20 mL甲醇和80 mL水,混匀,备用。
1.4 测定方法
1.4.1 色谱条件 色谱柱:Waters UPLC BEH C18(2.1 mm×100 mm,1.7 μm);柱温:30 ℃;流速:0.3 mL/min;进样量:20 μL;检测波长:0~16 min,激发波长280 nm,发射波长450 nm;16~23 min,激发波长320 nm,发射波长360 nm;23~48 min,激发波长405 nm,发射波长495 nm。流动相:A为0.1%甲酸水溶液,B为乙腈。
1.4.2 样品前处理 取均质好的肉糜状鸡肉样品(2.00±0.01)g,于50 mL具塞离心管中,加入提取溶液8 mL,多管涡旋仪混合涡旋5 min,8 000 r/min离心5 min,移取上清液至另一离心管中;将残渣重复提取1次,合并上清液,混匀;取混合好的上清液4 mL,加入经3 mL甲醇、3 mL水活化的HLB固相萃取柱,分别用3 mL水和3 mL甲醇水溶液淋洗,真空抽干后,用3 mL甲醇洗脱,45 ℃水浴氮气吹干,备用。
1.4.3 衍生化反应 将1.4.2处理的样品加入衍生溶液940 μL,涡旋溶解后,再加入衍生试剂60 μL,混匀,4 ℃避光反应1 h,过0.22 μm滤膜,供超高效液相色谱仪测定。
1.4.4 标准曲线绘制 准确移取适量标准工作液,按照1.4.3进行衍生化反应,配制成0.1、0.25、0.5、1、5、10、20、40、100、200和400 ng/mL系列标准溶液,以各药物的峰面积为纵坐标,各标准溶液浓度为横坐标,绘制标准曲线。
1.4.5 检出限和定量限 在鸡肉组织中添加不同浓度的标准工作液,经提取、净化和衍生后测定,以10倍信噪比(S/N)时的添加浓度确定为建立方法的定量限(Limit of quantification,LOQ),3倍信噪比(S/N)时的添加浓度确定为建立方法的检出限(Limit of detection,LOD)。
1.4.6 准确度和精密度 对鸡肉样品分别在定量限、2倍定量限和10倍定量限进行加标回收试验,每个浓度做3个批次,每个批次做6个平行试验,获得平均回收率、批间和批内相对标准偏差(Relative standard deviation,RSD),考察建立方法的准确度和精密度。
1.4.7 实际样品的检测 分别使用标准GB/T 20759—2006[18]和本试验建立的方法对来自青岛市某农贸市场抽取的30份鸡肉样品进行测定。
2 结果
2.1 标准曲线绘制 本试验采用外标定量法,按照1.4.4中标准溶液进行线性回归。如表1所示,30种药物在0.1~400 ng/mL范围内线性关系良好,相关系数均大于0.999。
2.2 检出限和定量限 14种喹诺酮类药物和16种磺胺类药物在鸡肉中的残留定量限为0.5~10.0 μg/kg,检出限为0.2~3.5 μg/kg,具体试验结果见表1。
2.3 准确度和精密度 建立方法的平均回收率、批内和批间RSD如表2所示,30种药物的平均回收率为62.2%~109.0%,批内RSD均小于17.7%,批间RSD均小于16.2%,满足国际上对兽药残留的检测需求。
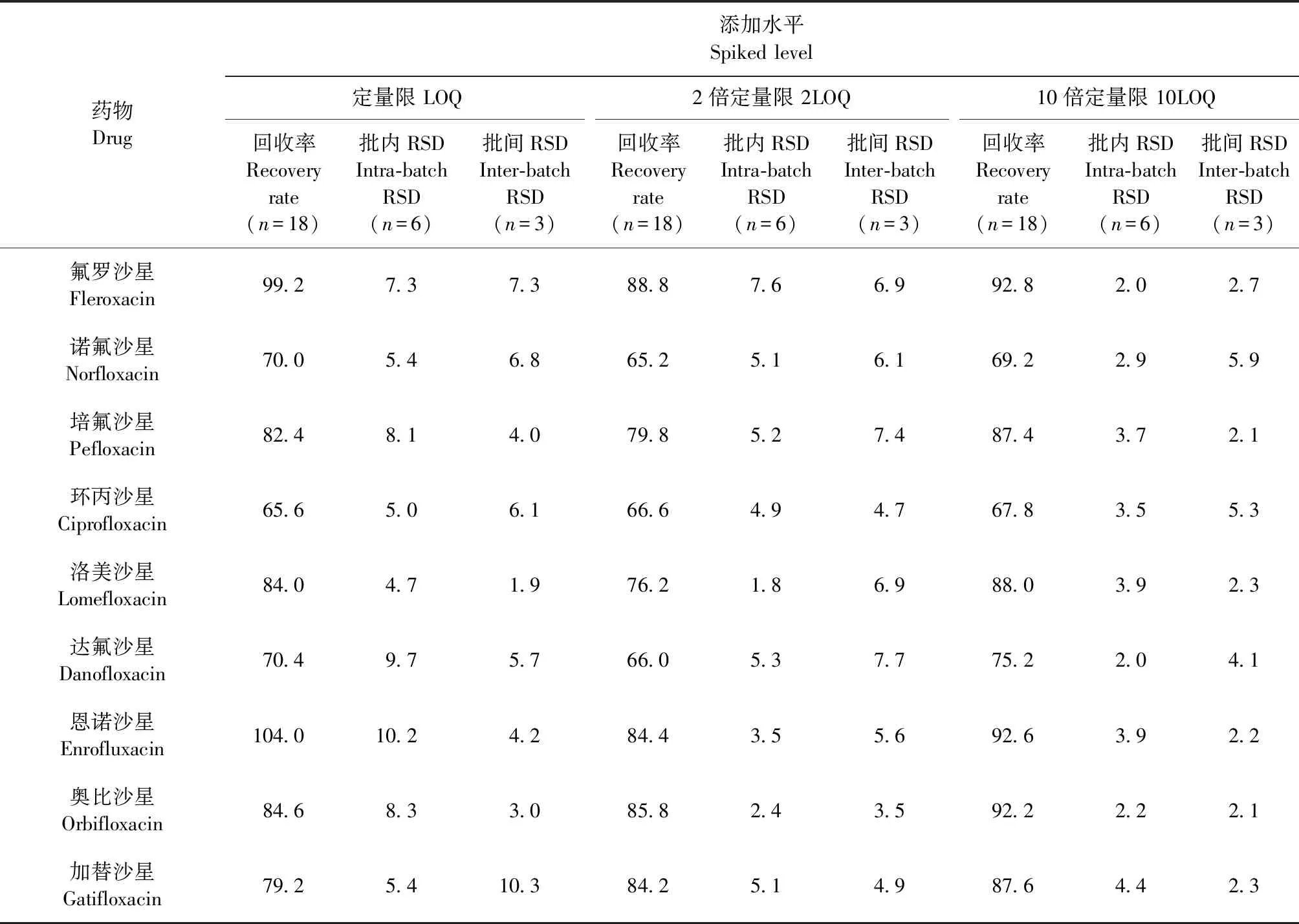
表2 鸡肉中14种喹诺酮和16种磺胺类药物平均回收率、批内和批间相对标准偏差
2.4 实际样品的检测 检测结果显示,有1份样品检出磺胺二甲基嘧啶残留,2种方法测定的样品中磺胺二甲嘧啶的残留量分别为16.8 μg/kg和16.2 μg/kg,二者结果无明显差异,表明本试验建立的方法准确、可靠,可用于基层一线实际样品的检测。
3 讨论
3.1 有机溶剂用量的确定 通过比较20、40、60、100和200 μL不同体积的有机溶剂对喹诺酮类药物的色谱峰型的影响,结果如图1所示,有机溶剂体积≤60 μL时,喹诺酮类药物表现出良好的荧光响应强度。随着有机溶剂体积的增大,喹诺酮类药物峰形变钝,基线严重漂移,药物之间不能完全分离,但不同的有机试剂用量对磺胺-荧光胺衍生物的荧光响应强度无明显影响。因此,本试验选取了60 μL荧光胺乙腈溶液作为最佳有机溶剂用量。

图1 有机溶剂体积对喹诺酮类药物荧光强度的影响
3.2 衍生试剂浓度的影响 荧光胺乙腈溶液的浓度对磺胺-荧光胺衍生物的荧光响应强度有较为明显的影响,如图2所示,随着荧光胺乙腈溶液浓度的升高,衍生化产物的荧光强度逐渐增强,当荧光胺乙腈浓度达到1.00 mg/mL时,磺胺-荧光胺衍生物的荧光强度达到最大并趋于稳定。因此,本试验选取1.00 mg/mL荧光胺乙腈溶液作为最佳衍生试剂浓度。
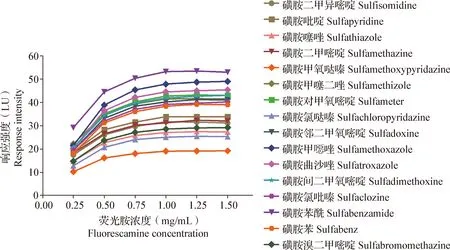
图2 荧光胺浓度对磺胺衍生物荧光强度的影响
3.3 荧光胺衍生化稳定性测定 磺胺-荧光胺衍生产物稳定性较差,室温下放置荧光响应强度逐渐衰弱,对准确定量造成影响。本试验比较了4 ℃和室温条件下进行衍生反应和保存对荧光响应强度的影响,其中,室温条件下衍生产物荧光响应强度在20 min达到峰值,随后开始下降;而4 ℃条件下,衍生产物荧光响应强度在1 h左右到达峰值,且在18 h内较为稳定,未出现明显衰减情况。因此,本试验将样品衍生反应和保存温度调节至4 ℃,可实现批量样品的自动分析工作,大大提高了分析效率。
3.4 色谱条件的优化 为了更好地对30种目标化合物进行定量和定性分析,本试验采用0.1%甲酸水溶液控制流动相pH,优化梯度洗脱条件,使30种待测药物得到较好的色谱峰型和分离效果,空白鸡肉样品中添加30种药物的色谱分离图如图3所示。
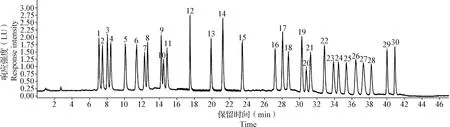
图3 空白鸡肉样品添加30种药物色谱图
3.5 样品前处理条件优化 鸡肉组织中的蛋白质含量高,通过样品净化,降低杂质对目标物的干扰至关重要。文献报道中采用的提取液包括有机溶剂(如乙腈、乙酸乙酯)[19,20]、酸化有机溶剂(如酸性乙腈)[21,22]和缓冲溶液(如磷酸盐溶液)[23]。本试验结果显示,乙腈、乙酸乙酯和酸化乙腈提取的共存物较多,杂质干扰明显,极性低的药物色谱峰变宽,基线严重漂移,影响定量;且有机溶剂会导致鸡肉组织蛋白质迅速变性,需要均质操作,否则容易结块,影响提取,诺氟沙星和环丙沙星等药物的提取回收率低于50%;选用PBS作为提取溶液,固相萃取柱净化,杂质干扰程度降低,可明显改善色谱峰型,30种药物的回收率在62.2%~109.0%范围内。
本试验首次建立了利用荧光检测法同时测定鸡肉中14种喹诺酮类和16种磺胺类药物残留的超高效液相色谱方法,操作简单,重现性好,准确性高,方法的定量限为0.5~10.0 μg/kg,可满足我国以及欧盟等国家的日常监测的要求,适用于鸡肉中喹诺酮类和磺胺类药物残留的高通量筛查工作。该方法极大地提高了工作效率,降低了分析成本,可为基层一线的实际检测提供可靠的技术支持。

