非洲猪瘟病毒p30蛋白在杆状病毒表达系统中的表达与免疫检测
廖欣欣,钟秋萍,史馨瑾,魏常青,孙海伟,刘英楠,敖清莹,谢振华,邬 静,陈鸿军
(1.湖南农业大学动物医学院 畜禽保健湖南省工程研究中心,长沙 410128;2.中国农业科学院上海兽医研究所,上海 200241
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的猪的一种热性、急性、高度接触性传染病[1]。典型的临床症状包括高烧、出血性病变、发紫、食欲不振和共济失调,致死率高达100%[2]。我国辽宁省沈阳市于2018年8月发生首例非洲猪瘟,之后在全国各地共发生非洲猪瘟140余起,116万余头生猪被扑杀,造成我国养猪业的巨大损失[3]。
ASFV是一种具有二十面体形态、体积较大的包膜病毒,平均直径约200 nm。病毒基因组由一个线形、共价封闭式双链DNA分子组成。基因组长度为170~190 kb,编码151~167个开放阅读框[4]。ASFV病毒颗粒包含几个同心结构域:由基因组组成的内部核芯位于病毒粒子的中心部分;核芯外包裹一层较厚的蛋白质(称为核壳);核壳周围包有一层脂质膜,称为内膜;内膜外层即细胞内病毒粒子的最外层,称为衣壳[5]。细胞外的病毒粒子在出芽过程中会获得一个额外的外膜层[6]。ASFV病毒粒子组成中包含超过50种结构蛋白,包括p12、p30、p49、p54、p72等,这些结构蛋白具有各种不同的功能[7]。
p30蛋白由CP204L基因编码,位于ASFV病毒粒子的内膜上,病毒DNA合成开始之前直至病毒生命周期结束,p30蛋白都在持续表达[8]。p30蛋白具有强免疫原性,在ASFV感染过程中可刺激产生高水平抗体应答。p30和p54的重组融合蛋白可诱导中和抗体,可作为ASFV亚单位疫苗的重要靶点[9]。本研究成功表达了ASFV p30真核重组蛋白,为建立非洲猪瘟抗体检测方法奠定了基础,并为ASFV亚单位疫苗研制提供重要靶点。
1 材料与方法
1.1 细胞、质粒和抗体Bac-To-Bac杆状病毒表达系统购自Invitrogen公司;草地贪夜蛾卵巢细胞系(Sf9)及p3×Flag-p30质粒由本实验室保存;小鼠抗ASFV p30多克隆抗体血清和小鼠抗ASFV p30融合蛋白单克隆抗体由本实验室制备。
1.2 主要试剂大肠杆菌DH5α购自Invitrogen公司;IPTG/X-gal购自TaKaRa公司;Trans IT-293转染试剂购自美国Mirus公司;Phanta®Max Super-Fidelity DNA聚合酶和BCA Protein Quantification Kit购自南京诺唯赞生物公司;T4 DNA连接酶购自美国Thermo Scientific公司;BamHⅠ和XhoⅠ购自英国NEB公司;FITC标记兔抗鼠IgG购自美国Sigma公司;HRP标记兔抗鼠IgG购自Jackson公司;4',6'-二脒基-2-苯基吲哚(DAPI)购自美国Molecular Probe公司;山羊抗猪IgG H&L (HRP)购自艾博抗(上海)贸易有限公司。
1.3 引物设计以p3×Flag-p30质粒为模板,设计扩增CP204L基因的上游引物pBamHⅠ-p30-F:5'-CGCGG ATCCAATGGATTTTATTTTAAATATATCCA-3'(下划线部分为BamHⅠ酶切位点),下游引物pXhoⅠ-p30-R:5'-CCGCTCGAGTTAAATGTAGGTGAGAA AAAAG-3'(下划线部分为XhoⅠ酶切位点),引物均由上海捷瑞生物技术有限公司合成。
1.4 p30基因的扩增以p3×Flag-p30为模板进行CP204L全长基因的扩增。反应体系为50 µL。反应条件参考Phanta®Max Super-Fidelity DNA聚合酶说明书。用1%琼脂糖凝胶将PCR产物进行电泳后回收目的片段,PCR产物4℃保存。
1.5 重组质粒pFastBac-p30的构建与鉴定分别用BamHⅠ、XhoⅠ双酶切pFastBac-1和CP204L基因片段,通过电泳验证后,将线性化的pFastBac1载体片段回收,用T4 DNA连接酶连接酶切后的pFastBac1线性载体片段和CP204L片段,将连接产物pFastBac1-CP204L转化至DH5α感受态细胞,液体培养基培养后,利用试剂盒提取重组质粒,并送至北京擎科新业生物技术有限公司测序,获得pFastBac1-p30穿梭质粒。
1.6 转座参考敖清莹等[10]实验方法,将pFastBac1-p30质粒转化至DH10Bac感受态细胞并通过3次蓝白斑筛选。通过PCR鉴定后,获得含重组杆状病毒Bacmid-p30基因组的细菌,提取Bacmid质粒备用。
1.7 重组杆状病毒rBac-p30的获得参照Trans IT-293转染试剂说明书,将重组杆状病毒质粒Bacmid-p30转染处于对数生长期的Sf9细胞,在适合Sf9细胞的培养温度(28℃)下培养,及时观察,在细胞病变明显时,收集细胞液离心后取上清液,即P1代重组杆状病毒rBac-p30,将P1代重组病毒传至第3代,冻存于-80℃备用。
1.8 免疫印迹(Western blot)检测将P3代rBac-p30重组杆状病毒按1 MOI感染Sf9细胞,72 h后分别收集细胞培养上清液和细胞沉淀,并同时收集空白Sf9细胞作为对照,加入蛋白裂解缓冲液后100℃煮10 min,使用鼠抗p30多克隆抗体血清作为一抗,4℃孵育过夜,HRP标记兔抗鼠作为二抗,室温孵育2 h,利用ECL发光成像系统观察结果。
1.9 间接免疫荧光(immunofluorescence assay,IFA)检测参考敖清莹等[10]实验方法,将rBac-p30重组杆状病毒按一定体积感染96孔板中的Sf9细胞,待细胞出现明显病变后,做IFA检测,在倒置荧光显微镜下观察。
1.10 间接酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)检测将P3代重组杆状病毒的Sf9细胞和培养上清液混匀,经超声波裂解,12000 ×g离心5 min,取超声波裂解上清液,冻存备用。用BCA Protein Quantification Kit测定蛋白浓度,采用方阵滴定筛选抗原最佳包被浓度,常规间接ELISA步骤,测定450 nm波长处吸收峰值[8]。
2 结果
2.1 重组质粒pFastBac-p30的构建以真核质粒p3× Flag-p30为模板,利用设计的特异性引物进行PCR扩增,成功扩增出CP204L基因片段(图1),将CP204L片段和pFastBac1载体分别双酶切后用T4 DNA连接酶连接,测序正确后,获得pFastBac1-p30穿梭质粒。

图1 CP204L PCR扩增结果Fig.1 PCR result of CP204L
2.2 重组杆状病毒质粒Bacmid-p30的构建将pFastBac-p30阳性重组质粒转化DH10Bac并进行了3轮蓝白斑筛选后,取第3轮筛选后的白色菌落,用质粒提取试剂盒提取质粒后,用p30特异性引物扩增可获得约606 bp的基因片段,用M13通用引物进行PCR扩增可获得约2906 bp的基因片段(图2),与预期大小相符,表明成功构建重组杆粒Bacmid-p30。

图2 重组杆状病毒质粒Bacmid-p30构建结果Fig.2 Construction results of recombinant Bacmid-P30
2.3 Bacmid-p30转染Sf9细胞将Bacmid-p30转染Sf9细胞,培养72~96 h后,细胞病变主要表现为细胞形状变圆、体积变大、细胞边界变得模糊、胞质中分布大量颗粒样物质,后期开始脱落(图3)。表明重组杆状病毒rBac-p30拯救成功。

图3 sf9细胞病变结果(100×)Fig.3 CPE of sf9 cells (100×)
2.4 重组蛋白的Western blot分析结果将P3代重组杆状病毒rBac-p30感染昆虫细胞,未接毒的Sf9细胞作为空白对照,感染72 h后分别收取细胞上清液和细胞沉淀并加入裂解缓冲液,以小鼠抗p30多克隆抗体血清1∶1000稀释作为一抗进行Western blot检测。结果表明:感染rBac-p30的Sf9细胞裂解上清液和沉淀中均能检测到p30蛋白条带(图4),说明Bac-to-Bac昆虫杆状病毒真核表达系统成功表达出了具有良好免疫原性的重组ASFV p30蛋白。

图4 Western blot检测结果Fig.4 Results of Western blot
2.5 重组蛋白的间接免疫荧光(indirect immunofluorescence assay,IFA)检测结果将重组杆状病毒rBac-p30感染Sf9细胞,培养72 h,观察到明显细胞病变后,使用鼠抗p30融合蛋白单克隆抗体作为一抗,FITC标记兔抗鼠IgG作为二抗,利用IFA检测Sf9细胞。与未感染重组杆状病毒的Sf9细胞相比,感染rBac-p30重组杆状病毒的Sf9细胞出现强烈的亮绿色荧光信号(图5)。结果表明:rBac-p30感染Sf9后能成功表达rp30蛋白,并具有良好的免疫原性。

图5 重组p30蛋白表达的IFA鉴定结果(200×)Fig.5 Results of IFA identification of recombinant p30 protein expression (200×)
2.6 间接ELISA方法的建立经方阵滴定检测,确定重组蛋白的最佳包被浓度为100 ng/孔,以此浓度包被ELISA板,从表1检测结果可见:5种ASFV阳性血清的抗体效价分别为1∶3200、1∶12 800、1∶6400、1∶800、1∶3200。以重组杆状病毒表达蛋白rp30为包被抗原,以检测血清作为一抗,建立的间接ELISA检测方法可以用来区分ASFV阴性血清和阳性血清。
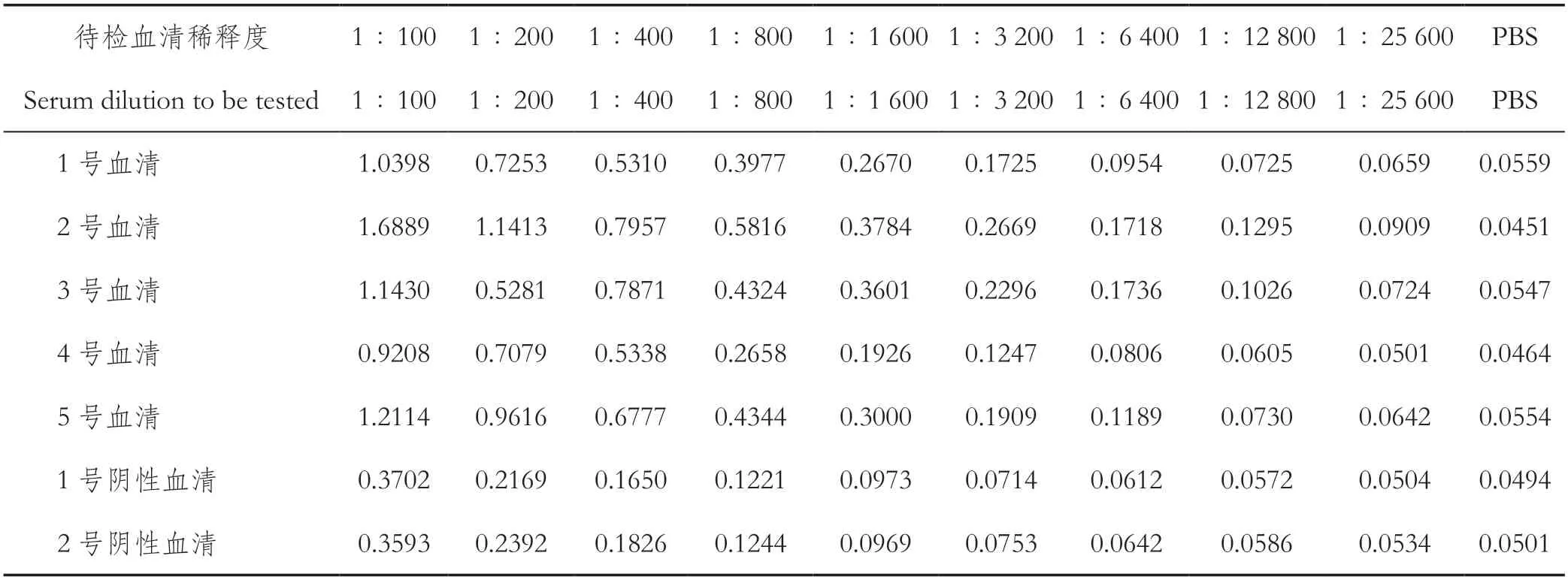
表1 间接ELISA检测结果Table 1 Detection results of indirect ELISA
3 讨论
非洲猪瘟被世界动物卫生组织(World Organisation for Animal Health,OIE)列为必须报告的动物疫病之一;在我国被列为一类动物疫病[4]。ASFV具有高度接触性,传播范围很广[11],对养猪业危害甚大,具有重要的社会经济学意义。
建立快速准确、特异性强、灵敏度高的血清学检测方法对非洲猪瘟监控和防控尤为重要。在非洲猪瘟病毒结构蛋白中,p30、p54、p72和p62被报道是良好的血清学诊断靶标[12]。有研究指出,ASF康复猪可以诱导中和抗体产生,能够中和病毒,抑制病毒附着和内化,其中p54蛋白抗体与p30蛋白抗体分别与抑制病毒附着和内化有关[13]。并且p30蛋白ASFV感染过程中可刺激高水平的特异性抗体应答。利用放射性免疫沉淀技术,确定在感染早期阶段(感染后3~6 d),血液中的特异性抗体主要来自于p30蛋白[14]。因此,p30蛋白常被选作用于建立免疫学检测方法的检测抗原[15]。
杆状病毒表达系统是当今基因工程四大表达系统之一。杆状病毒表达系统相比较于其他表达系统,具有安全性高、外源蛋白表达量高、真核表达环境、表达产物有适当的翻译后修饰等优点[16]。本研究利用分子克隆技术成功构建了重组杆状病毒rBac-p30。利用Western blot技术验证感染重组杆状病毒rBac-p30的Sf9细胞上清液及沉淀均能被阳性血清特异性识别;在IFA实验结果中,感染细胞能与鼠抗p30融合蛋白单克隆抗体发生反应,在荧光显微镜下呈现亮绿色荧光,表明杆状病毒表达系统能成功表达重组p30蛋白,并且表达的重组p30蛋白有良好的免疫原性。利用表达的重组p30蛋白初步建立了检测ASFV抗体的间接ELISA方法。结果显示,该方法具有在临床上用于猪群非洲猪瘟抗体的监测和检测的潜力。本研究结果不仅为ASFV p30蛋白功能进一步深入研究奠定了基础,并且也为建立更好ASFV抗体检测方法和亚单位疫苗的制作提供了重要的靶点。

