运动激素鸢尾素在阿尔茨海默病中的作用机制
韦 涛
(扬州大学体育学院,江苏 扬州 225009)
随着医疗水平的提高和物质条件的改善,全球65 岁及以上人口呈持续增长态势,预计未来几十年内将继续保持这一趋势[1]。 人类寿命的延长不仅导致与年龄相关疾病的流行,包括神经退行性疾病在内,同时也引发相关社会和经济负担的快速累积,这一现象在老龄化人口不断增加的大背景下变得尤为突出[2-3]。 作为最普遍的神经退行性疾病之一,阿尔茨海默病(Alzheimer disease,AD)的病理机制涉及多个分子与细胞水平的紊乱,成为老年人认知功能障碍和生活能力丧失的主要根源[4]。 尽管已取得了一些进展,但对于AD 的病因和发病机制仍存在许多未解开的谜团,并且目前也缺乏有效的治疗方法[5-6]。因此,深入研究AD 相关机制以及寻求创新性治疗策略显得尤为紧迫和重要,这不仅有助于该疾病的预防和早期诊断,还将为AD 的有效管理提供有益的理论和实践支持。
长期缺乏运动是导致全球死亡率上升的主要危险因素之一,特别是在心血管疾病和肥胖等慢性疾病发病率显著增加的情况下[7-8]。 相反,积极参与体育锻炼不仅有助于能量消耗,还能改善机体的代谢过程,从而降低患病风险。 在神经退行性疾病中,认知功能障碍是一种常见的病理现象,但目前缺乏有效的治疗手段。 然而,普遍认为健康的生活方式是预防和管理认知障碍的关键[9]。 研究表明,定期进行体育锻炼可以促进神经可塑性、增强认知功能和心理健康,并对神经发生产生积极影响[10-12]。 一方面,它通过调节脑内的分子和细胞机制,例如神经营养因子的合成与分泌[12]。 特别是脑源性神经营养因子(BDNF)和鸢尾素(Irisin),它们在运动诱导的益处中发挥重要作用。 这些神经营养因子通过促进神经细胞的生长和存活、优化突触可塑性以及调节神经炎症反应等方式,有助于维护和提升大脑的功能[13-14]。 另一方面,体育锻炼可以增加脑血流和供氧量,改善心血管健康和代谢功能,为大脑提供充足的能量和营养物质,进一步增强认知功能[15]。
鸢尾素作为与运动紧密相关的激素,近年来备受关注。 本篇综述广泛回顾了鸢尾素对AD 病理的影响,并探讨了其作为潜在治疗策略的前景。
1 AD 的病理机制
AD 是一种渐进性的神经退行性疾病,占痴呆症的60%~70%,全球约5 500 万人受其影响[16]。 该疾病常表现为情绪变化、行为异常、认知障碍和记忆丧失等症状[17]。作为一种与年龄相关且高度流行的疾病,若未能在未来数十年内找到预防、减缓或治疗的有效方法,AD 患者的数量将继续增加[18]。 从病理学角度观察,AD 并非单一疾病,往往伴随着一种或多种合并症,包括肥胖、心血管疾病、糖尿病以及高胆固醇血症等[19-20]。这些合并症与AD 的发病及病程密切相关,并进一步增加AD患者的疾病负担。
AD 的病理学特征涵盖多个方面,其中包括细胞外淀粉样蛋白-β(Aβ)的过度积聚、细胞内神经原纤维缠结(NFT)、突触丢失、神经炎症以及神经元死亡[21-23]。 这些病理现象在大脑皮层和海马区域尤为明显[24]。 Aβ 是淀粉样前体蛋白(APP)通过β 和γ 分泌酶裂解产生的多肽,含有36~43 个氨基酸[25]。 过度积累的Aβ 会破坏神经元之间的突触传递,从而影响神经功能[18]。 另一特征是微管相关蛋白Tau(MAPT)的异常磷酸化,该蛋白在正常状态结合并稳定微管,而过度磷酸化的Tau 蛋白则会引发轴突转运障碍、细胞骨架蛋白的异常增加和神经退行性变化[26]。 这些蛋白质的异常积聚导致神经细胞死亡,同时激活小胶质细胞和星形胶质细胞,诱发神经炎症。然而,长期的神经炎症反应会加速神经元的死亡,从而形成恶性循环[27]。 此外,大量神经元死亡也是导致AD 患者认知能力下降的原因之一[28]。 AD 是一种动态而复杂的疾病,受多个基因和因素的影响[29]。 除少部分家族性遗传病例外,大多数AD 患者的发病原因尚不明确[30]。 基于目前的研究,可以明确指出氧化应激、神经炎症、 胰岛素抵抗以及葡萄糖代谢失衡等危险因素参与了AD 的发病过程[31-32]。 这些因素相互串扰,形成了一个复杂的病理网络,共同促进了AD 的进展。
2 鸢尾素的来源及其生物学功能
骨骼肌是一类具有分泌功能的器官,与此同时,由肌纤维表达、释放和产生的细胞因子或多肽称为“肌因子”,这些因子在生物体内发挥着自分泌、旁分泌或内分泌作用[33-35]。 当骨骼肌收缩时,肌因子被释放到循环系统中,形成一个信号分子的储存库。 目前已确定的肌因子有数百种,其中包括白介素-6(IL-6)、组织蛋白酶B(CTSB)和鸢尾素等[36]。肌因子的产生使得骨骼肌与其他器官,如肝脏、大脑、脂肪组织、胰腺等之间的相互作用成为可能。
鸢尾素是由Bostrom 及其研究团队于2012 年发现的一种“肌因子”。 研究表明,运动能够刺激过氧化物酶体增殖物激活受体γ 共激活因子-1α(PGC1-α)的表达,并进一步促进纤维连接蛋白III 型结构域蛋白5(Fibronectin type III domain-containing protein,FNDC5)的分泌[37]。 FNDC5 是一种膜蛋白,在水解后会产生一种新的激素,即鸢尾素[38]。 最初在小鼠的骨骼肌中发现了鸢尾素,因为FNDC5 基因主要在肌肉组织中表达[39]。此外,在其他组织和器官中同样检测到FNDC5 的转录本,包括心脏、大脑、睾丸、肾脏、肝脏和胃等[39]。 作为一种调节机体生长发育的肌因子,鸢尾素近年来备受关注。 研究显示,鸢尾素可能在AD 相关病理和代谢过程中发挥作用,并通过多种途径发挥其功能。 具体来说,鸢尾素能够促进白色脂肪棕色化、改善葡萄糖代谢、维持骨骼肌稳态以及减轻炎症反应,这些作用对于改善AD 患者的代谢情况以及降低疾病过程中的炎症损伤具有重要意义[40-42]。 此外,鸢尾素还被认为是运动促进大脑健康益处的重要介质。 具体而言,循环中的鸢尾素能够穿过血脑屏障(BBB),启动海马神经保护程序,上调脑内神经营养因子的表达,促进神经发生并保护神经细胞免受损伤[43]。这些效应可能有助于增强神经元之间的突触连接,进而改善痴呆患者的认知、记忆和学习能力[44]。 作为一种“模拟运动”的干预措施,鸢尾素在治疗AD 等神经退行性疾病中具有巨大潜力。
3 鸢尾素在AD 中的潜在治疗作用
3.1 鸢尾素通过改善胰岛素抵抗和调节能量代谢干预AD
近年来,学术界对于“脑胰岛素抵抗”这一新兴概念进行了广泛讨论。 在该领域的研究中,Kullmann 及其同事指出中枢和外周胰岛素之间存在双向关系,即外周胰岛素抵抗可能干扰脑胰岛素的活性,反之亦然,从而形成恶性循环[45]。 有证据显示,脑胰岛素抵抗可能对脑皮层回路产生影响,其中包括前额叶皮层和海马体,这些回路在调控食物和能量相关行为中发挥核心作用,同时对认知功能和运动的调节也具有重要意义[46]。 一些研究表明,海马胰岛素抵抗可能是AD 认知功能障碍的潜在介质,并认为恢复海马胰岛素活性可能是缓解AD相关认知能力下降的有效策略[47-48]。
脑葡萄糖代谢率的降低是AD 病理生理学的一个主要特征[49]。 研究认为,这种糖代谢异常可能是由于AD 患者出现的胰岛素信号传导受损所致[50-51]。此外,葡萄糖/胰岛素利用效率降低可能会促进淀粉样蛋白衍生物和过度磷酸化tau 蛋白的形成[50,52]。 在糖脂毒性条件下,鸢尾素通过AMPK(AMP-activated protein kinase)途径改善大鼠胰岛细胞瘤细胞(INS-1)的脂质代谢,并减轻胰岛β 细胞的功能障碍[53]。 类似地,鸢尾素通过活性氧(ROS)介导的AMPK 信号通路,参与调节骨骼肌细胞的葡萄糖代谢[54]。 进一步的研究证实,通过向小鼠骨骼肌注射鸢尾素,可以增加ERK1/2 和AMPKα 的磷酸化水平,并提高小鼠比目鱼肌中的糖原储量[55]。 这一结果在C2C12 细胞中也得到了验证[55]。 一项研究对FNDC5 基因敲除小鼠进行了为期20 周的高脂饮食喂养,结果显示FNDC5 基因缺失导致小鼠体重增加、胰岛素抵抗和体内炎症反应[56]。 然而,外源性FNDC5 通过AMPK 途径参与调节巨噬细胞极化,从而减轻了高脂饮食诱导的小鼠胰岛素抵抗和炎症反应[56]。 然而,敲除AMPK 基因削弱了FNDC5/鸢尾素对葡萄糖摄取和脂肪酸β-氧化的影响[57]。 这些数据有力地支持了FNDC5/鸢尾素通过AMPK 途径改善脂质代谢和葡萄糖摄取的可能性。
一项研究发现,脑内皮细胞葡萄糖转运体1(GLUT1)表达的下调会加剧AD 的脑血管变性和神经病理学[58]。 此外,一项针对糖尿病小鼠模型的研究表明,通过长期皮下注射鸢尾素,可以降低空腹血糖水平并改善胰岛素敏感性[59]。 具体而言,鸢尾素通过激活PI3K/Akt/FOXO1 信号通路抑制肝脏中PEPCK和G6Pase 的表达,这在糖异生过程中具有重要作用。 此外,鸢尾素激活PI3K/Akt/GSK3 信号通路诱导糖原合成酶(GS)的磷酸化,从而增加糖原的合成,有利于改善葡萄糖稳态[59]。 在随机对照实验中同样验证了鸢尾素在调节糖稳态和代谢中的作用。 一项研究发现,在肥胖中年男性中,较高水平的FNDC5/鸢尾素与更好的代谢特征以及较低的Ⅱ型糖尿病(T2DM)发展风险有关[60]。 此外,另一项研究发现,在饮食诱导的体重减轻后,较高的鸢尾素基线浓度与血糖和高胰岛素水平更大幅度的下降存在密切联系[61]。 这些研究结果为鸢尾素在治疗代谢相关疾病方面的潜在应用提供了有益的信息。
根据上述内容,我们推测鸢尾素可能通过介导外周胰岛素抵抗的改善来干预胰岛素受体信号传导途径,从而调控脑部胰岛素的活性水平。 这种影响可能会导致脑部神经元对胰岛素的反应发生变化,进而对认知和相关代谢过程产生影响。值得注意的是,鸢尾素/FNDC5 对脑部胰岛素活性调控的具体机制尚不明确,因此仍需要进一步开展分子和细胞水平的实验研究。
鸢尾素/FNDC5 能够有效调节机体的能量代谢。 它通过激活AMPK 信号通路,上调解偶联蛋白1(UCP1)和PPARγ 共激活因子1α(PGC1-α)的表达,进而促进白色脂肪组织(WAT)的“褐变”[62-63]。 此外,研究表明鸢尾素能够诱导3T3-L1 细胞和原代皮下脂肪细胞中UCP1 等产热基因的表达,这一调节作用可能是通过激活p38 丝裂原活化蛋白激酶 (p38 MAPK)和细胞外信号相关激酶1/2(ERK1/2)信号通路来实现的[64]。动物实验进一步验证了这一结论,在饮食诱导的肥胖小鼠体内连续注射重组鸢尾素14 天,能够激活产热基因的表达并促进皮下WAT 的棕色化[65]。 棕色脂肪组织(BAT)富含丰富的线粒体和小的脂滴,具有消耗能量和调节体温的功能[66]。 以上数据表示鸢尾素能够有效激活BAT 的代谢活性,从而增强机体的能量消耗和产热能力。 近期的研究指出,能量衰竭与病理状态及年龄相关的体温调节缺陷密切相关,并且有可能参与了AD的发病机制[67]。 这一发现为进一步探索鸢尾素在能量代谢和脑功能之间的潜在关系提供了新的研究方向。
3.2 鸢尾素通过抑制神经炎症和缓解氧化应激干预AD
近年来,大量的研究数据支持氧化应激在AD 发病机制中发挥关键作用,并有可能成为连接AD 发病理论和机制间的桥梁[68-69]。 研究表明,鸢尾素可通过多种途径对氧化应激进行调节,从而对神经退行性疾病产生积极影响。 具体而言,腺病毒介导的鸢尾素过表达可以上调海马内BDNF 的表达,并通过诱导细胞外信号调节激酶1/2 (ERK 1/2) 的磷酸化抑制Aβ 寡聚体诱导的海马神经元氧化应激[70]。 此外,鸢尾素还能通过PI3K/AKT/mTOR 途径抑制ROS 的生成,保护神经元免受缺血再灌注(I/R)引起的过氧化状态[71]。 氧化应激在神经退行性疾病中的发病过程具有重要作用,直接影响着神经元的生长、突触形成以及神经信号传递等关键过程[72-73]。 研究发现,将重组鸢尾素注入海马齿状回,降低了血浆中脂质过氧化产物丙二醇(MDA)和总氧化状态(TOS)的水平,并提高总抗氧化能力(TAC)的表达[74]。此外,FNDC5/鸢尾素通过激活Akt/GSK3β/Fyn/Nrf2 信号通路,显著降低MDA 水平以及NADPH氧化酶亚基p67phox 的表达,同时增强了谷胱甘肽(GSH)等抗氧化酶的活性,从而保护阿霉素(DOX)诱导的心脏毒性模型小鼠的氧化损伤[75]。 上述结果在H9C2 细胞中得到进一步证实[75]。鸢尾素还可通过AMPK-Sirt1-PGC-1α 途径抑制过氧化氢(H202)处理的正常大鼠肾细胞(NRK)的氧化应激[76]。 类似地,鸢尾素治疗降低了脑梗死周围组织硝基酪氨酸、超氧阴离子和4-羟基壬烯醛(4-HNE)的水平[77]。 这些研究结果揭示了鸢尾素在氧化应激调节方面的重要性,并且可能对神经元的功能和存活产生积极的影响。
神经炎症通常指中枢神经系统(CNS)内的炎症反应,可由多种病理损伤触发。在这个过程中,CNS 内的免疫细胞会释放一系列促炎细胞因子,例如IL-1β、IL-6、TNF-α 等[78]。 作为神经系统中主要的免疫细胞类型,小胶质细胞和星形胶质细胞是神经炎症的首要响应者。 研究发现,鸢尾素预处理星形胶质细胞培养基能有效保护星形胶质细胞免受Aβ 诱导的细胞毒性损伤[79]。 具体而言,鸢尾素给药后降低了星形胶质细胞释放的IL-6 和IL-1β 的水平,并通过抑制IKBα 的磷酸化减少NF-KB 的激活程度(炎症反应的关键介质),从而下调环氧合酶2(COX-2)的表达[79]。 在大脑中动脉阻塞(MCAO)模型中,鸢尾素治疗显著减少Iba-1+(小胶质细胞活化的标志物)和MPO-1+(单核细胞浸润的标志物)细胞数量,并使IL-6 和肿瘤坏死因子α(TNF-α)的表达下调45~60%[77]。 此外,鸢尾素还可以减轻糖尿病小鼠海马组织中SATA、P38 和NF-KB 蛋白的活化,降低IL-1β 和IL-6 的水平,并减少胶质纤维酸性蛋白(GFAP)的表达,从而抑制星形胶质细胞的激活和神经炎症[80]。 促炎因子的产生不仅会导致突触功能障碍和神经元死亡,还会抑制神经发生的过程[81]。另一项研究发现,鸢尾素能够减轻缺血条件下小鼠的神经功能障碍、脑血肿、神经炎症以及神经元凋亡[82]。 从机制上看,鸢尾素治疗增加了整合素αVβ5、p-AMPK 和Bcl-2(一种凋亡抑制因子)的表达水平,同时降低了L-1β,TNF-α,髓过氧化物酶(MPO)和Bax(一种促凋亡蛋白)的表达。这一结果在糖氧剥夺(OGD)诱导的PC12 细胞中得到进一步证实[82]。 此外,鸢尾素通过降低Toll 样受体4(TLR4)和髓样分化初级应答蛋白88(MyD88)的蛋白水平,以及抑制NF-KB 的磷酸化,从而减少了角质形成细胞趋化因子(KC)、单核细胞趋化蛋白1(MCP-1)等促炎介质的产生[83]。这些结果提示鸢尾素能够通过调节相关信号通路抑制炎症因子的表达以及调节免疫细胞的活化。
3.3 鸢尾素是认知功能的重要调节因子
Islam 学者及其研究团队开发了一种FNDC5 全基因敲除的小鼠模型(F5KO 小鼠),旨在深入探讨FNDC5/鸢尾素在运动中的作用[84]。在这项研究中,研究者首先运用Morris 水迷宫(MWM) 测试以评估运动诱导后野生型小鼠 (WT 小鼠)和F5KO 小鼠认知功能的变化。 结果表明,运动对于WT 小鼠的空间记忆和学习能力具有积极影响,然而在F5K0 小鼠中并未观察到类似效果。 进一步的研究通过应用新物体识别测试(NOR)来评估衰老时FNDC5/鸢尾素缺失对记忆的影响,结果发现老年F5KO 小鼠(21—24 月龄)在认知方面表现出比同龄WT 小鼠更为明显的衰退,对新物体没有表现出偏好。 与此同时,另一项研究通过使用FNDC5 中和抗体抑制其在AD 模型中的表达[85]。 数据显示,外周给药FNDC5 中和抗体部分阻断了APP/PS1 小鼠在NOR 测试中的运动保护效应[85]。这些结果提示,FNDC5/鸢尾素在运动对记忆产生积极影响的过程中发挥了中介作用。 为了进一步探究FNDC5/鸢尾素基因敲除对小鼠模式分离功能的影响,研究者采用了情境恐惧辨别学习(CFC-DL)开展实验。模式分离功能是大脑处理记忆的一种方式,它能够将相似但不相同的事件/场景转化为独特的记忆表示[86]。 过去的研究已经指出,运动能够增强小鼠和人类的模式分离功能,但在衰老和AD 早期,这种能力明显下降[87]。 在CFC-DL 测试中,与WT 小鼠相比,F5KO 小鼠区分上下文的时间显著延长。 值得注意的是,通过向小鼠海马齿状回区域注射编码鸢尾素的腺相关病毒(AAV8-FLAG),使得中枢鸢尾素富集,增强了WT 小鼠和F5KO 小鼠在CFC-DL 中的表现力。这表明鸢尾素在模式分离功能中具有潜在的调节作用。 长时程增强(LTP)作为一种突触可塑性的重要形式,通过增强神经元之间的通信,在高级神经功能如学习和记忆方面发挥重要作用[88]。 研究发现,在接受高频刺激60 min 后,F5KO 小鼠的LTP 比WT 小鼠下降了37%。此外,一项研究利用携带FNDC5基因的慢病毒载体对小鼠进行侧脑室输注,并结合运动方案来探究其作用[85]。 结果显示,感染对照慢病毒载体(含有靶向荧光素酶的shRNA) 的APP/PS1 小鼠在运动后LTP 显著增强,而在FNDC5 基因敲低的APP/PS1 小鼠中并未观察到类似的改善。 同时,为了避免基因型偏差,该研究还在C57BL/6 小鼠中进行了验证[85]。 总的来说,鸢尾素作为FNDC5 的活性部分在调节认知功能方面具有重要作用,并介导了运动对突触可塑性和记忆的积极影响。
鸢尾素被视为一种有望改善认知功能的新型神经保护因子,表现出巨大的应用前景。 具体而言,鸢尾素可能通过上BDNF 的表达来影响神经元的形态和连接方式,以促进新的神经回路的形成和稳定[89]。 BDNF 广泛分布于哺乳动物大脑,对神经元生存、分化和功能维持具有重要作用,同时参与多种神经元活动和突触可塑性过程[90]。 因此,鸢尾素可能为AD 患者认知功能的恢复提供了一种新的治疗策略。 以链脲佐菌素(STZ) 诱导的记忆障碍为例,研究发现通过运动或摄入肌肽(L-Carnosine)可以使海马区FNDC5/鸢尾素的表达正常化,并刺激BDNF 的分泌,从而减轻小鼠认知相关的障碍[91]。 已有研究证实,定期从事体育锻炼可以提高血浆中的鸢尾素水平[92]。此外,研究还发现,血浆中的鸢尾素水平与工作记忆、海马神经元增殖以及海马BDNF 水平之间呈正相关[93]。 这些结果揭示了鸢尾素在认知功能和神经健康方面的积极影响。 另外,通过将重组鸢尾素注入小鼠腹腔持续7 天,可以显著上调海马中BDNF、PGC-1α 和FNDC5 的表达,并增加海马CA1 和CA3区的树突长度和树突棘密度[94]。 这种改善能够加强神经元之间的信息传递,从而有助于提高学习和记忆功能。 在AD 模型中,海马和大脑皮层中的BDNF 水平普遍下降,然而通过鼻内给予BDNF 则缓解了APP/PS1 转基因小鼠的认知障碍[95]。 此外,鸢尾素的应用还显示出减轻小鼠抑郁样和焦虑行为的效果,这种改善可能与鸢尾素治疗促进海马区(HP)和前额叶皮质(PFC)中神经营养/生长因子的表达有关[96]。通过shRNA 干扰技术抑制鸢尾素的表达,导致糖尿病小鼠海马组织中BDNF 表达水平的下调,而在鸢尾素给药后则显著改善了这一状况[97]。同时,通过腺病毒介导的外周FNDC5 过表达,显著增加了海马区BDNF、NAPS4、ARC 和C-FOS 等神经保护基因的表达。 神经元分化为大脑提供多样性的神经元和复杂的神经网络机构,对于记忆的形成和维持发挥重要作用。 然而,FNDC5基因敲除抑制了BDNF 和其他神经营养因子的表达,降低了神经元的分化效率[98-99]。 这些结果进一步加深了我们对FNDC5/鸢尾素在AD 认知功能障碍中的潜在作用的理解。
研究数据表明,AD 患者的脑组织、脑脊液以及AD 动物模型中FNDC5/鸢尾素的表达显著下调[85]。 此外,鸢尾素和BDNF在脑脊液中的水平与AD 患者的Aβ 病理和认知能力存在显著相关性[100]。 这些结果进一步支持了鸢尾素在改善认知功能中的作用。 然而,循环中的鸢尾素水平与AD 患者的认知功能之间并未表现出明确的关联性[101]。 这可能暗示其在疾病发展中的作用更多地涉及局部神经元环境。 FNDC5/鸢尾素-BDNF轴的激活对缓解焦虑样行为、减轻社会压力、改善认知和记忆功能均有不同程度的影响。综合而言,FNDC5/鸢尾素可能在促进大脑内神经营养因子的分泌与合成方面具有重要的上游调控作用。
4 总结和未来展望
本文对鸢尾素在AD 发病机制中的作用进行了综合评述,并重点讨论了其对氧化应激、神经炎症、胰岛素抵抗和葡萄糖代谢失衡等AD 危险因素的影响。 作为一种具有多种生物活性的分子,鸢尾素通过对这些因素的综合影响介入AD的病理过程(图1)。首先,鸢尾素表现出强大的抗氧化特性,充当自由基清除剂,以中和过剩的自由基,从而减轻氧化应激对神经元的损伤。 其次,鸢尾素通过抑制神经炎症过程中关键炎症介质(如炎症因子IL-1β、TNF-α 和IL-6 等)的产生,发挥抗炎效应。 此外,鸢尾素还能抑制NF-κB 的活化,调节神经胶质细胞的免疫反应,从而减少炎症对AD 的负面影响。 同时,鸢尾素通过调节AMPK 和PI3K/Akt 等胰岛素信号通路中的关键分子,增强胰岛素信号的传导,从而有助于胰岛素抵抗的改善并维持正常的葡萄糖代谢[102]。最后,鸢尾素在改善学习和记忆方面扮演重要角色。 具体而言,鸢尾素通过调节BDNF 的表达,增强神经元间的连接性和突触可塑性,促进新的神经回路的形成和稳定,从而发挥治疗效应。 在广泛应用的传统运动疗法中,AD 患者通过身体活动和认知功能训练来提升生活质量[103]。然而,对于那些病情较为严重且无法进行常规体育活动的AD 患者而言,鸢尾素作为一种与运动共享益处的药物治疗显得尤为重要。 需要强调的是,鸢尾素作为AD 潜在的治疗策略仍处于初级阶段。 目前,尚缺乏大规模临床试验数据来验证其安全性和有效性,以及明确其在临床应用中的剂量范围和时间窗口。 因此,未来需要进一步研究和验证,以深入探究鸢尾素在治疗AD 方面的潜在价值。
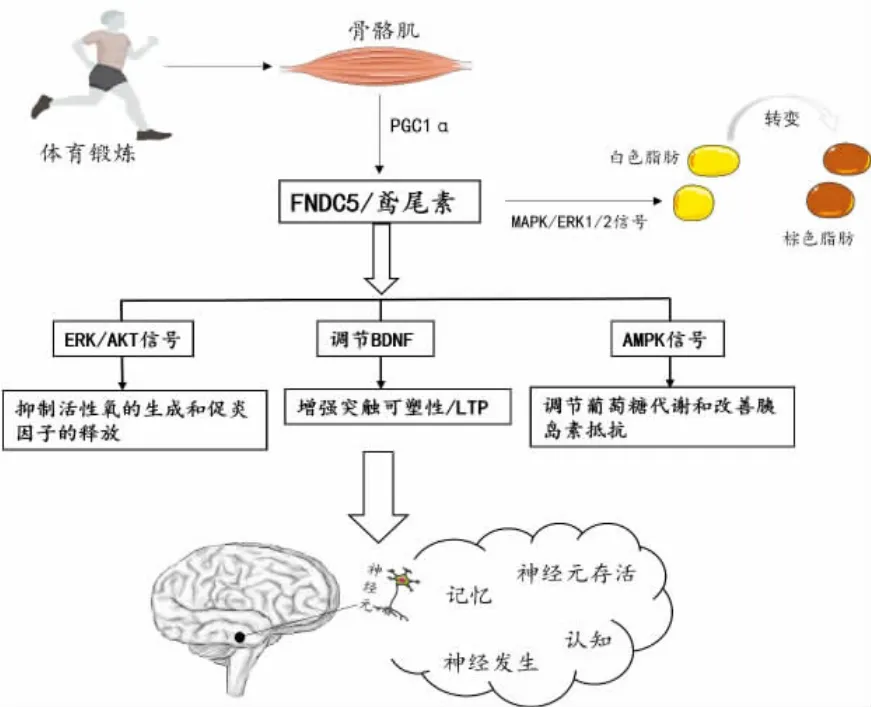
图1 鸢尾素在AD 中的作用机制

