早期肠内营养联合肠外营养在危重症患者中的应用
诸小飞 许晓辰 皇海萍
危重患者机体处于高应激状态,加速分解代谢,同时伴有胃肠道功能紊乱等症状,极易出现营养不良,严重影响患者康复[1]。目前对于危重患者的营养支持方案仍处于探索阶段,对于肠内营养与肠外营养的选择及具体配方,尚无相关指南和标准。对于胃肠道功能尚存的危重症患者,早期启动肠内营养已得到业界认可[2-3]。但此类患者仍存在胃肠道功能紊乱,胃肠道负荷较重,消化吸收有一定困难,仅通过肠内营养进行营养补充并不能满足机体需要[4]。本文观察危重症患者早期肠内营养联合肠外营养的应用效果,以期为临床治疗提供参考。
1 资料与方法
1.1 对象与分组
选取我院2021 年1 月至2023 年1 月收治的危重患者98 例。纳入标准:急性生理和慢性健康状况Ⅱ评分(APACHE Ⅱ)>17 分;营养风险筛查(NRS)评分≥3 分;ICU 入住时间≥3 d;胃肠道功能尚存。排除标准:胃肠道存在如肠梗阻等影响肠内营养的疾病;已接受肠外营养治疗;再次入住ICU;妊娠期或哺乳期。本方案符合《赫尔辛基宣言》要求,患者及家属均签署知情同意书。按照随机数字表法分为对照组与观察组,各49 例。
1.2 治疗方法
对照组仅予肠内营养治疗,每天给予患者立适康营养粉鼻饲,摄入总量为20 ~25 kcal/kg。采用鼻胃管肠内营养泵喂养,每天持续时间约8 h。整个鼻饲过程中每间隔1 h 冲管1 次,每次使用100 mL 温开水冲管;每4 h 回抽胃液1 次,判断鼻胃管位置是否正确、是否存在胃潴留情况。鼻饲过程中可适度抬高患者上半身,预防误吸或反流。观察组予肠内营养联合肠外营养治疗,入组后前3 d 喂养方案同对照组,第3 d 时采用间接能量测定仪器评估患者第4 d 目标能量值,再根据第3 d 实际摄入量计算能量差值,制定第4 d 肠外营养所需量。肠外营养配方为全营养混合液配方,内含氨基酸、脂肪乳、维生素等,其中碳水化合物与脂肪的比例为1 ∶ 1,采用经外周静脉穿刺的中心静脉导管输注。两组进行营养支持治疗的过程中,严密观察患者排便情况,明确是否有腹胀、腹泻等情况发生,出现类似情况减慢喂养速度,并予对症处理。
1.3 观察指标
终点事件主要指患者出院、死亡或转入其他科室,当患者住院时间超过10 d,以第10 d 为终点事件。① 两组终点事件时(治疗后)临床结局,主要指标包括死亡、感染、全身多器官功能衰竭发生情况,序贯器官衰竭评分(SOFA)及APACHE Ⅱ评分。② 两组治疗前与终点事件时(治疗后)仍存活患者的营养指标、免疫指标水平。营养指标主要包括白蛋白(Alb)、血红蛋白(Hb)、前白蛋白(PA),其中Alb 及PA 均采用全自动生化分析仪器测定,Hb 采用血液分析仪器进行测定;免疫功能指标主要包括免疫球蛋白M(IgM)、IgG、淋巴细胞计数,均采用流式细胞仪测定。
1.4 统计学方法
应用SPSS 26.0 统计学软件分析数据。符合正态分布的计量资料(年龄、BMI、APACHE Ⅱ评分、NRS 评分、SOFA 评分、营养指标、免疫指标)以()表示,组间比较采用独立样本t检验;计数资料(性别、并发症发生率)以百分率(%)表示,采用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较
由表1 可见,两组性别、年龄、BMI、 APACHE Ⅱ评分、NRS 评分比较,差异均无统计学意义。

表1 两组一般资料比较
2.2 两组临床结局指标比较
由表2 可见,观察组SOFA 评分、APACHE Ⅱ评分均低于对照组,差异均有统计学意义。对照组发生并发症11 例(22.4%),其中感染6 例,全身多器官功能衰竭5 例;死亡3 例,分别于入组后第2、4、5 d 死亡,均死于全身多器官功能衰竭。观察组发生并发症3 例(6.1%),其中感染1 例,全身多器官功能衰竭2例;死亡1 例,于入组后第6 d 死亡,死于全身多器官功能衰竭。两组并发症发生率比较,差异有统计学意义(χ2= 5.33,P<0.05)。
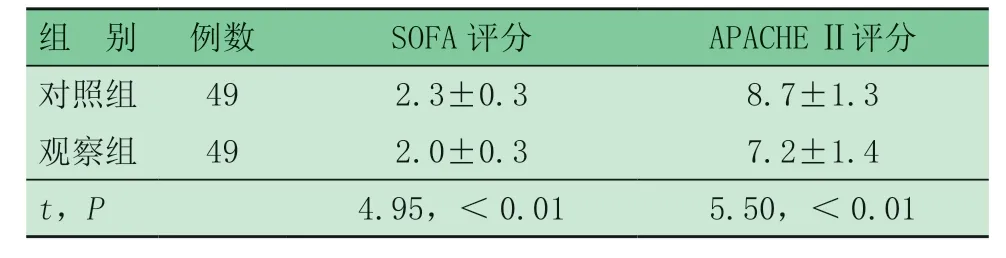
表2 两组临床结局指标比较
2.3 两组存活患者治疗前后营养指标及免疫指标比较
由表3 可见,治疗前两组存活患者营养指标、免疫指标水平接近,差异均无统计学意义。治疗后两组存活患者营养指标、免疫指标水平均较前上升,且观察组高于对照组,组间差异有统计学意义。
表3 两组存活患者治疗前后营养指标及免疫指标比较 ()

表3 两组存活患者治疗前后营养指标及免疫指标比较 ()
组 别 例数 Alb(g/L) Hb(g/L) PA(mg/L) IgM(g/L) IgG(g/L) 淋巴细胞计数(×109/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 46 29.1±5.5 35.0±5.5 89.7±16.0 115.4±22.5 153.6±21.3 177.1±26.0 1.0±0.1 1.2±0.1 12.0±0.9 13.6±1.1 1.1±0.1 1.3±0.1观察组 48 28.8±5.1 39.3±5.7 90.2±17.3 136.8±24.2 154.1±22.1 206.1±27.4 1.0±0.1 1.3±0.1 11.9±0.9 14.4±1.1 1.1±0.1 1.4±0.1 t 0.27 3.72 0.15 4.44 0.11 5.26 0.00 4.85 0.54 3.52 0.00 4.85 P>0.05 <0.01 >0.05 <0.01 >0.05 <0.01 >0.05 <0.01 >0.05 <0.01 >0.05 <0.01
3 讨论
肠内营养的早期启动主要作用在于能够保障患者肠道黏膜的正常生理结构,在喂养的过程中生成正常菌群,进一步刺激胃肠道消化液的产生,促进胃肠道蠕动,加速机体的恢复[5-8]。仅采用肠内营养支持存在最大的问题是不耐受,患者无法完全吸收营养物质。针对单纯肠内营养支持不耐受的情况,可采用肠外营养进行有效的补充[9]。本文结果显示,治疗后两组各项营养指标均较治疗前好转,且观察组显著优于对照组,提示采用肠内营养联合肠外营养在改善患者营养指标方面效果更佳,能够更早的达到患者所需营养目标[10]。
危重症患者因其蛋白质及能量的供应不足和消耗过大,导致参与免疫物质合成的原材料减少,进而影响到机体的免疫功能。本文结果显示,治疗后两组免疫指标水平均较治疗前升高,且观察组优于对照组,提示采用肠内营养联合肠外营养在改善患者胃肠道营养情况的基础上,刺激T 淋巴细胞的增值,促进周围淋巴组织免疫功能的恢复。原因在于仅采用肠内营养支持治疗常因患者不耐受导致机体营养物质吸收不足,且危重患者伴有高应激和高代谢情况,进而影响免疫功能。而肠内营养联合肠外营养治疗,患者机体能够获得更充足的蛋白质等营养物质,免疫细胞合成受到的影响较小,免疫功能恢复速度更快。本文结果显示,观察组并发症发生率、SOFA 评分、APACHE Ⅱ评分均低于对照组,进一步提示采用肠内营养联合肠外营养支持治疗,能够显著改善患者临床结局。
综上所述,对于危重患者在营养支持治疗过程中采用肠内营养联合肠外营养的方式,能够显著改善患者营养状况,提高机体免疫力,改善临床结局。但本方案仍存在一定局限性,本次纳入样本量较小且为单中心研究,整个过程无法完全排除人为干扰因素,今后仍需大样本、多中心的研究继续探讨。

