银蓝调脂胶囊通过调节自噬治疗非酒精性脂肪肝的机制研究
黎敏仪,甘海宁,黄雪君,黄晓丹,卢秀丽,胡子旋,陈玉兴[.广州中医药大学第五临床医学院,广东 广州 50095;2.广东省第二中医院(广东省中医药工程技术研究院),广东 广州 50095;3.广东省中医药研究开发重点实验室,广东 广州 50095]
非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)是全球最常见的慢性肝病,据统计,NAFLD的全球患病率约为25%[1]。在我国,有研究报告[2]显示2018年NAFLD的患病率约为32.9%,因此,对NAFLD 的防治愈发值得我们的重视。NAFLD是一种代谢性疾病,在肝脏中具有明显的脂质沉积,通常与氧化应激、炎症和纤维化以及胰岛素抵抗有关[3]。
近年来,NAFLD 与自噬的关系引起了大量研究者的关注,新出现的证据[4]支持缺陷自噬在NAFLD及其并发症发病机制中的核心作用。自噬是指某些蛋白质和细胞器被具有双层膜的自噬体吞噬,与溶酶体结合形成自噬溶酶体,然后降解并循环内容物的过程,在维持细胞稳态中起着不可或缺的作用。有研究[5]表明,膳食高果糖可通过刺激肌醇需求蛋白(IRE)上调胆固醇调节元件结合蛋白1(SREBF-1)、乙酰辅酶A羧化酶1(ACC1)、脂肪酸合成酶(FAS)等的表达,促进脂肪生成,恢复自噬可以减少肝脏脂质的异常增多。因此,自噬不仅可通过调节脂质代谢减少肝脏脂质沉积,还可以保护肝细胞免受损伤和细胞死亡。
银蓝调脂(YLTZ)胶囊是广东省第二中医院(广东省中医药工程技术研究院)自研调脂中药新药,由化橘红、银杏叶、绞股蓝及酒制蜂胶组成,已取得新药临床试验批件(批件号:2012L01011),并于2018年启动Ⅱ期临床试验。前期研究证实银蓝调脂胶囊有降血脂、抗动脉粥样硬化以及抑制巨噬细胞泡沫化的作用[6-8]。本实验基于调节自噬相关信号通路探讨银蓝调脂胶囊治疗非酒精性脂肪肝的作用机理。
1 材料
1.1 动物C57BL/6 小鼠,雌雄各半,SPF 级,8 周龄,体质量(18±22)g,购自广东省医学实验动物中心,实验动物生产许可证号:SCXK(粤)2018—0002。动物质量合格证号:44007200109999。饲养于广东省中医药工程技术研究院SPF级动物实验室,设施使用许可证号:SYXK(粤)2020—0059。饲养环境:23~28 ℃,相对湿度62%。本实验经广东省第二中医院(广东省中医药工程技术研究院)实验动物伦理委员会批准,批文号:049107。
1.2 药物及试剂非诺贝特胶囊,法国利博福尼制药有限公司,批号:32852。银蓝调脂胶囊,广东省中医药工程技术研究院制剂室生产,批号:20220727,组方为化橘红、银杏叶、绞股蓝及蜂胶;前三药加水煎煮2次浓缩至含生药量0.75 g·mL-1,经50%乙醇沉淀,再真空干燥得约15%的干浸膏;取酒制蜂胶和干浸膏,经粉碎过筛,再加入药用淀粉适量,混匀,干压制粒装入胶囊,使用时按照给药剂量用去离子水配置成所需药液。
高脂高胆固醇饲料(蔗糖20%,猪油15%,胆固醇1.2%,胆酸钠0.2%,酪蛋白10%,磷酸氢钙0.6%,石粉0.4%,预混料0.4%,基础饲料52.2%),购自广东省医学实验动物中心;总胆固醇(Total cholesterol,TC)试剂盒(批号:20220316)、甘油三酯(Triglyceride,TG)试剂盒(批号:20221209)、低密度脂蛋白(Low-density lipoprotein cholesterol,LDL-C)试剂盒(批号:20221114)、高密度脂蛋白(High-density lipoprotein cholesterol,HDL-C)试剂盒(批号:20221221)、谷丙转氨酶(Alanine aminotransferase,ALT)测试盒(批号:20221002)、谷草转氨酶(Aspartate aminotransferase,AST)测试盒(批号:20221002)、载脂蛋白A1(ApoA1)测试盒(批号:20221105)、载脂蛋白B(ApoB)测试盒(批号:20221018)、载脂蛋白E(ApoE)测试盒(批号:20221006),均购自南京建成生物工程研究所;小鼠丙二醛(Malondialdehyde,MDA)ELISA试剂盒(批号:417220614)、小鼠超氧化物歧化酶(Superoxide Dismutase,SOD)ELISA 试剂盒(批号:535220614)、小鼠谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)ELISA 试剂盒(批号:312220614)、小鼠肿瘤坏死因子alpha(Tumor Necrosis Factor alpha,TNF-α)ELISA 试剂盒(批号:569220614)、小鼠白细胞介素6(Interleukin-6,IL-6)ELISA 试剂盒(批号:385220614),以上试剂均购自天津安诺瑞康生物技术有限公司;FAS 抗体(批号:2)、ACC1 抗体(批号:8),购自美国Cell Signaling Technology;SREBF-1 抗体(批号:PAC868Mu01),购自武汉云克隆科技股份有限公司;自噬相关蛋白5(ATG5)抗体(批号:GR43598-14),购自英国Abcam公司;GAPDH 抗体(批号AC221016006)、Beclin1 抗体(批号:AC221230028)、自噬相关蛋白3(ATG3)抗体(批号:AC221230006)、自噬相关蛋白7(ATG7)抗体(批号:AC221230031)、P62抗体(批号:AC23022 1044),均购自武汉塞维尔生物科技有限公司。
1.3 仪器Varioskan Flash 型全波长多功能酶标仪,美国Thermo 公司;5418 型小型高速冷冻离心机,德国Eppendorf 公司;JJ3000 型电子天平,常熟市双杰测试仪器厂;BSA2245型电子天平,德国Sartorius公司;ini-protean Teral Cell垂直电泳槽、PowerPac Basic电泳仪,美国Bio-Rad 公司;GenScript eBlot L1快速湿转仪,中国Make research Easy 公司;Tanon 5200 Multi 多功能成像系统,中国Tanon公司。
2 方法
2.1 剂量换算银蓝调脂胶囊每粒含0.50 g 生药量,根据每天3次,每次4粒的服用量,则人临床用量为6.00 g·d-1,参考《中药药理研究方法学》中剂量换算方法“体表面积比”换算得出小鼠临床等效剂量为0.78 g·kg-1,作为银蓝调脂胶囊中剂量;银蓝调脂胶囊高剂量、低剂量分别为2 倍、1/2 倍临床等效剂量,即为1.56、0.39 g·kg-1。非诺贝特胶囊的人临床剂量为200 mg·d-1,换算得出小鼠临床等效剂量为26.00 mg·kg-1。
2.2 分组、模型复制、给药及取材60只雌雄各半的C57BL/6 小鼠适应性喂养1 周后,按体质量随机选取10 只作为正常对照组,喂食普通饲料;其余50 只喂食高胆固醇鼠饲料12 周。模型复制成功后,将喂食高脂饲料的小鼠随机分成模型组、非诺贝特组(26.00 mg·kg-1)及银蓝调脂胶囊高(1.56 g·kg-1)、中(0.78 g·kg-1)、低(0.39 g·kg-1)剂量组,每组10 只。各给药组给予相应药物灌胃,正常组、模型组灌胃给予等量蒸馏水,连续给药30 d[9]。末次给药1 h后,各组小鼠以3%异氟烷吸入麻醉,摘取各组小鼠眼球进行取血,以4 ℃、3 000 r·min-1离心10 min(离心半径10 cm),吸取上清。取血后各小鼠颈椎脱臼处死,解剖取肝脏组织,拍照、称质量后,摘取肝脏左叶部分置于10%甲醛溶液中保存,剩余肝脏编号置于-80 ℃冰箱储存。
2.3 检测指标
2.3.1 体质量、肝脏系数及形态观察 动物在进行实验前称量体质量并记录,取血后迅速分离肝脏,称质量、拍照,计算脏器系数。脏器系数=脏器质量(mg)/体质量(g)
2.3.2 血清指标的检测 血清样品分别按照试剂盒说明书操作要求进行血脂(TG、TC、LDL-C、HDL-C)、肝功能(ALT、AST)、抗氧化功能(SOD、MDA、GSH-Px)、抗炎因子(IL-6、TNF-α)的检测,采用Varioskan Flash 全波长多功能酶标仪测定并记录数据。
2.3.3 肝脏脂质代谢的检测 每只小鼠称取肝脏0.10 g 剪碎,加入冷冻PBS 0.90 mL 充分研磨,置冷冻离心机以4 ℃、5 000 r·min-1离心10 min(离心半径10 cm)。取上清液按说明书进行蛋白浓度及ApoA1、ApoB、ApoE 的检测,采用Varioskan Flash 全波长多功能酶标仪测定并记录数据。
2.3.4 HE 染色检测肝组织病理学 置于福尔马林溶液中的肝脏,经过修整后进行脱水、透明、浸蜡包埋、切片脱蜡、HE染色后制成的病理切片,图像采集后用ImageJ 软件对比分析,并对比各组之间的组织病理学差异。
2.3.5 油红O 染色检测肝组织病理学 新鲜的肝脏,经过修整后冰冻切片,油红O染色后观测制成的病理切片,图像采集后用ImageJ 软件对比分析,并对比各组之间的组织病理学差异。
2.3.6 Western Blotting 蛋白免疫印迹法检测肝组织中脂肪生成和自噬相关蛋白 取肝组织充分研磨,加入ripa 裂解液提取总蛋白,BCA 检测蛋白浓度并配平。制得SDS-PAGE 凝胶,加入样品进行电泳。将凝胶中的蛋白质转移到PVDF 上,5%脱脂奶粉室温封闭结束后加入相对应的一抗,在4 ℃下过夜孵育,TBST 洗涤3 次,每次10 min。加入二抗在室温摇床孵育1.5 h,再次洗膜后置ECL 暗室化学发光显影,凝胶成像分析系统摄像分析。采用ImageJ 软件检测所得蛋白图像的目标条带以及相应内参条带灰度值,计算蛋白表达。蛋白表达=目标蛋白灰度值/内参蛋白灰度值。
2.4 统计学处理方法采用SPSS 26.0 统计学软件进行数据分析,计量资料结果以均数±标准差(±s)表示。组间计量资料采用单因素方差分析进行比较,P<0.05 为差异有统计学意义。结果分析图使用GraphPad Prism 8.0 软件制作完成。
3 结果
3.1 小鼠肝脏大体形态观察结果结果见图1。正常对照组小鼠肝脏呈红褐色,质地柔软且弹性良好,边缘清晰;模型组小鼠肝脏接近黄色,质感厚重偏硬且无弹性,边缘钝;与模型组比较,非诺贝特组和银蓝调脂胶囊高、中、低剂量组肝脏恢复偏红色,质地软恢复弹性,质感偏细腻。

图1 各组小鼠肝脏大体形态观察结果Figure 1 Observation of the general morphology of mice livers
3.2 银蓝调脂胶囊对NAFLD 小鼠体质量和肝脏系数的影响结果如表1所示,与正常对照组比较,模型组小鼠的体质量、肝质量、肝脏系数明显升高(P<0.01);与模型组比较,非诺贝特组及银蓝调脂胶囊高、中、低剂量组小鼠体质量、肝质量、肝脏系数均明显降低(P<0.01)。
表1 银蓝调脂胶囊对非酒精性脂肪肝(NAFLD)小鼠体质量、肝质量及肝脏系数的影响(±s,n=10)Table 1 Effects of Yinlan Tiaozhi Capsules on body mass,liver mass and liver coefficient of NAFLD mice(±s,n=10)
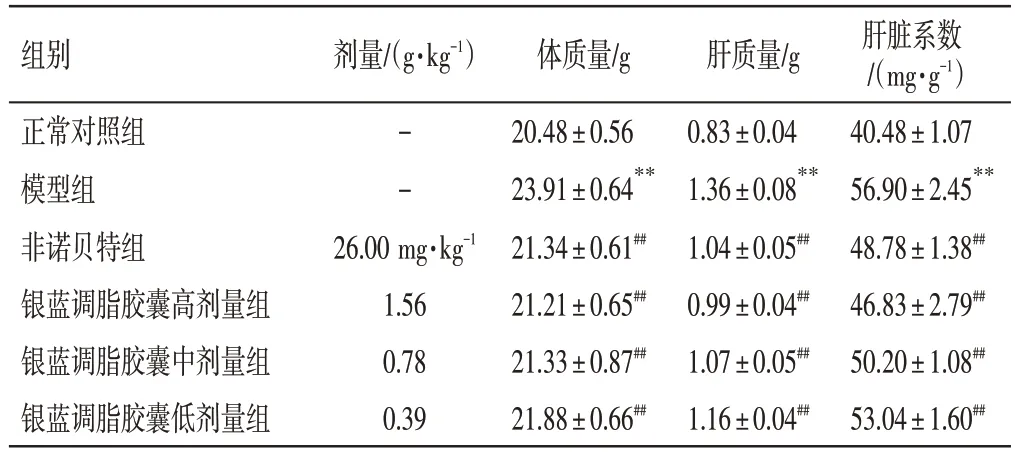
表1 银蓝调脂胶囊对非酒精性脂肪肝(NAFLD)小鼠体质量、肝质量及肝脏系数的影响(±s,n=10)Table 1 Effects of Yinlan Tiaozhi Capsules on body mass,liver mass and liver coefficient of NAFLD mice(±s,n=10)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01
肝脏系数/(mg·g-1)40.48±1.07 56.90±2.45**48.78±1.38##46.83±2.79##50.20±1.08##53.04±1.60##组别正常对照组模型组非诺贝特组银蓝调脂胶囊高剂量组银蓝调脂胶囊中剂量组银蓝调脂胶囊低剂量组剂量/(g·kg-1)--26.00 mg·kg-1 1.56 0.78 0.39体质量/g 20.48±0.56 23.91±0.64**21.34±0.61##21.21±0.65##21.33±0.87##21.88±0.66##肝质量/g 0.83±0.04 1.36±0.08**1.04±0.05##0.99±0.04##1.07±0.05##1.16±0.04##
3.3 银蓝调脂胶囊对NAFLD 小鼠血脂的影响结果如表2所示,与正常对照组比较,模型组小鼠的TC、TG、LDL-C含量均明显升高,HDL-C含量明显降低(均P<0.01);与模型组比较,非诺贝特组及银蓝调脂胶囊高、中、低剂量组小鼠TC、TG、LDL-C含量均明显降低(P<0.01),HDL-C含量均明显升高(P<0.01)。
表2 银蓝调脂胶囊对非酒精性脂肪肝(NAFLD)小鼠血脂的影响(±s,n=10)Table 2 Effects of Yinlan Tiaozhi Capsules on blood lipids in mice with NAFLD(±s,n=10)
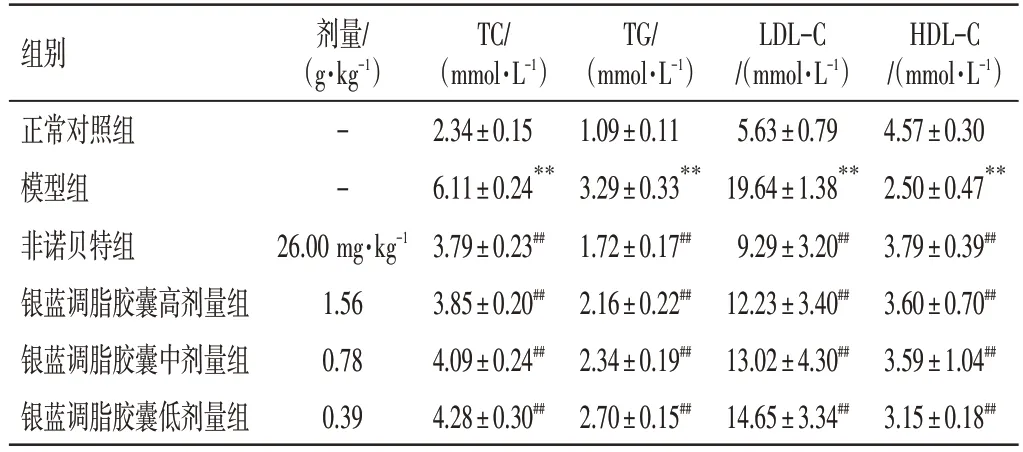
表2 银蓝调脂胶囊对非酒精性脂肪肝(NAFLD)小鼠血脂的影响(±s,n=10)Table 2 Effects of Yinlan Tiaozhi Capsules on blood lipids in mice with NAFLD(±s,n=10)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01
HDL-C/(mmol·L-1)4.57±0.30 2.50±0.47**3.79±0.39##3.60±0.70##3.59±1.04##3.15±0.18##组别剂量/(g·kg-1)正常对照组模型组非诺贝特组银蓝调脂胶囊高剂量组银蓝调脂胶囊中剂量组银蓝调脂胶囊低剂量组--26.00 mg·kg-1 1.56 0.78 0.39 TC/(mmol·L-1)2.34±0.15 6.11±0.24**3.79±0.23##3.85±0.20##4.09±0.24##4.28±0.30##TG/(mmol·L-1)1.09±0.11 3.29±0.33**1.72±0.17##2.16±0.22##2.34±0.19##2.70±0.15##LDL-C/(mmol·L-1)5.63±0.79 19.64±1.38**9.29±3.20##12.23±3.40##13.02±4.30##14.65±3.34##
3.4 银蓝调脂胶囊对NAFLD 小鼠肝功能的影响结果如表3所示,与正常对照组比较,模型组小鼠的ALT、AST 含量均明显升高(P<0.01);与模型组比较,非诺贝特组及银蓝调脂胶囊高、中、低剂量组小鼠ALT、AST含量均明显降低(P<0.01)。
表3 银蓝调脂胶囊对非酒精性脂肪肝(NAFLD)小鼠谷丙转氨酶(ALT)、谷草转氨酶(AST)的影响(±s,n=10)Table 3 Effects of Yinlan Tiaozhi Capsules on ALT and AST in NAFLD mice(±s,n=10)
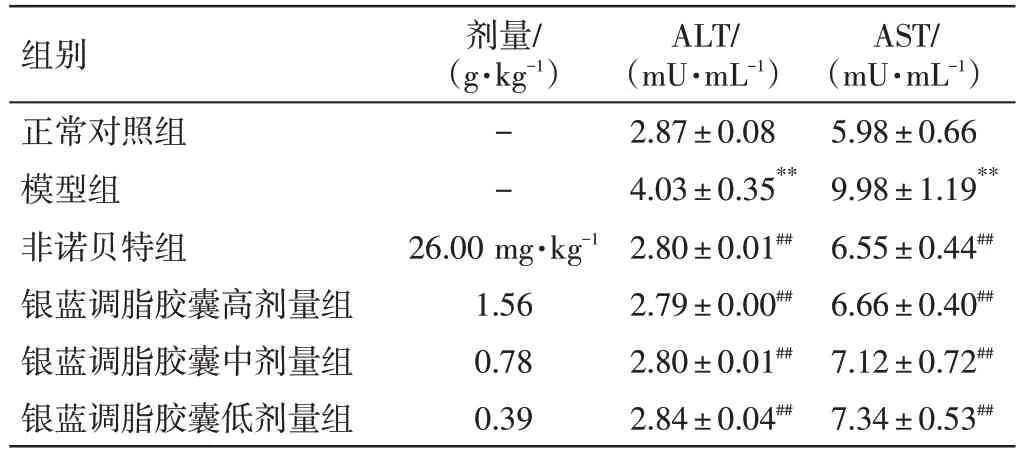
表3 银蓝调脂胶囊对非酒精性脂肪肝(NAFLD)小鼠谷丙转氨酶(ALT)、谷草转氨酶(AST)的影响(±s,n=10)Table 3 Effects of Yinlan Tiaozhi Capsules on ALT and AST in NAFLD mice(±s,n=10)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01
AST/(mU·mL-1)5.98±0.66 9.98±1.19**6.55±0.44##6.66±0.40##7.12±0.72##7.34±0.53##组别正常对照组模型组非诺贝特组银蓝调脂胶囊高剂量组银蓝调脂胶囊中剂量组银蓝调脂胶囊低剂量组剂量/(g·kg-1)--26.00 mg·kg-1 1.56 0.78 0.39 ALT/(mU·mL-1)2.87±0.08 4.03±0.35**2.80±0.01##2.79±0.00##2.80±0.01##2.84±0.04##
3.5 银蓝调脂胶囊对NAFLD 小鼠抗氧化功能的影响结果如表4所示,与正常对照组比较,模型组小鼠的SOD、GSH-Px 含量明显降低(P<0.01),MDA含量明显增多(P<0.01);与模型组比较,非诺贝特组及银蓝调脂胶囊高、中、低剂量组小鼠SOD、GSH-Px 含量均明显升高(P<0.01),MDA 含量均明显减少(P<0.01)。
表4 银蓝调脂胶囊对对非酒精性脂肪肝(NAFLD)小鼠SOD、MDA、GSH-Px 含量的影响(±s,n=10)Table 4 Effects of Yinlan Tiaozhi Capsules on the content of SOD,MDA,GSH-Px in NAFLD mice(±s,n=10)
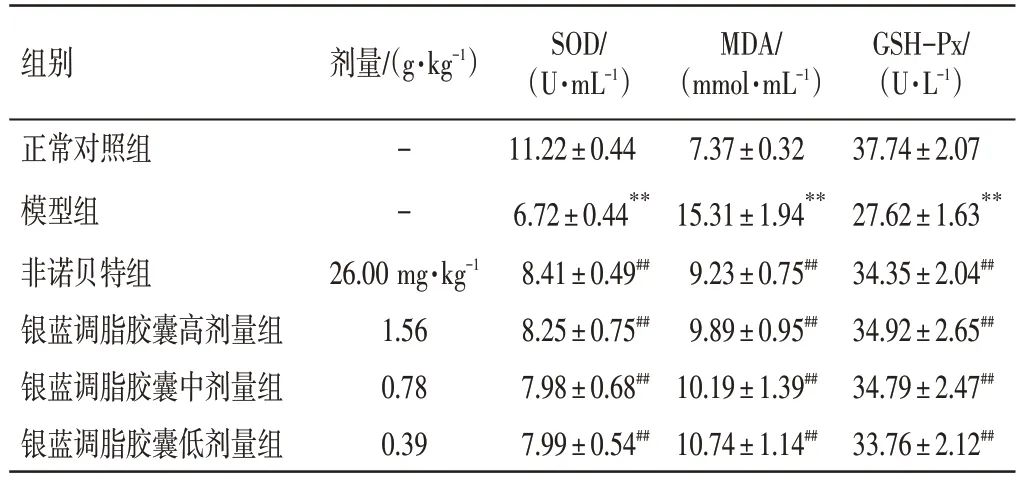
表4 银蓝调脂胶囊对对非酒精性脂肪肝(NAFLD)小鼠SOD、MDA、GSH-Px 含量的影响(±s,n=10)Table 4 Effects of Yinlan Tiaozhi Capsules on the content of SOD,MDA,GSH-Px in NAFLD mice(±s,n=10)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01
GSH-Px/(U·L-1)37.74±2.07 27.62±1.63**34.35±2.04##34.92±2.65##34.79±2.47##33.76±2.12##组别剂量/(g·kg-1)正常对照组模型组非诺贝特组银蓝调脂胶囊高剂量组银蓝调脂胶囊中剂量组银蓝调脂胶囊低剂量组--26.00 mg·kg-1 1.56 0.78 0.39 SOD/(U·mL-1)11.22±0.44 6.72±0.44**8.41±0.49##8.25±0.75##7.98±0.68##7.99±0.54##MDA/(mmol·mL-1)7.37±0.32 15.31±1.94**9.23±0.75##9.89±0.95##10.19±1.39##10.74±1.14##
3.6 银蓝调脂胶囊对NAFLD 小鼠抗炎作用的影响结果如表5所示,与正常对照组比较,模型组小鼠的IL-6、TNFα 含量明显升高(P<0.01);与模型组比较,非诺贝特组及银蓝调脂胶囊高、中、低剂量组小鼠IL-6、TNF-α含量均明显降低(P<0.01)。
表5 银蓝调脂胶囊对非酒精性脂肪肝(NAFLD)小鼠IL-6、TNF-α 含量的影响(±s,n=10)Table 5 Effects of Yinlan Tiaozhi Capsules on the contents of IL-6 and TNF-α in NAFLD mice(±s,n=10)
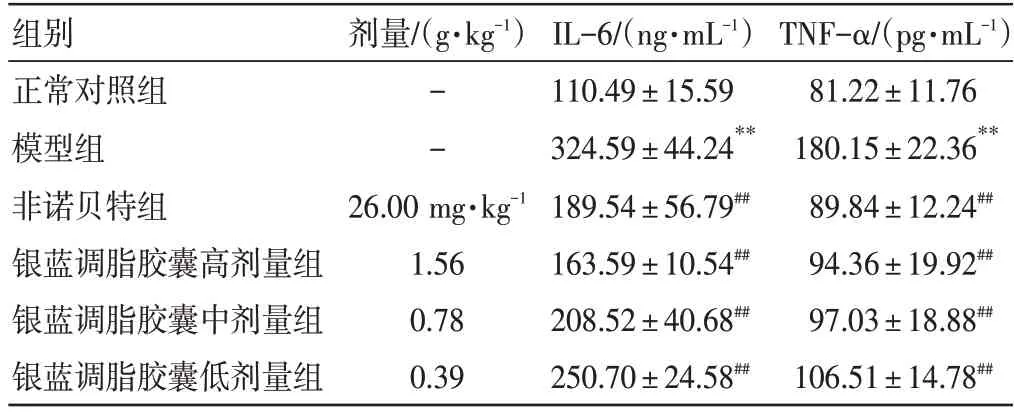
表5 银蓝调脂胶囊对非酒精性脂肪肝(NAFLD)小鼠IL-6、TNF-α 含量的影响(±s,n=10)Table 5 Effects of Yinlan Tiaozhi Capsules on the contents of IL-6 and TNF-α in NAFLD mice(±s,n=10)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01
TNF-α/(pg·mL-1)81.22±11.76 180.15±22.36**89.84±12.24##94.36±19.92##97.03±18.88##106.51±14.78##组别正常对照组模型组非诺贝特组银蓝调脂胶囊高剂量组银蓝调脂胶囊中剂量组银蓝调脂胶囊低剂量组剂量/(g·kg-1)--26.00 mg·kg-1 1.56 0.78 0.39 IL-6/(ng·mL-1)110.49±15.59 324.59±44.24**189.54±56.79##163.59±10.54##208.52±40.68##250.70±24.58##
3.7 银蓝调脂胶囊对NAFLD 小鼠肝脏脂质代谢的影响结果如表6所示。与正常对照组比较,模型组小鼠肝脏的ApoA1 含量明显降低(P<0.01);与模型组比较,非诺贝特组及银蓝调脂胶囊高、中剂量组小鼠肝脏ApoA1 含量均明显升高(P<0.05)。与正常对照组比较,模型组小鼠肝脏ApoB、ApoE含量明显升高(P<0.01);与模型组比较,非诺贝特组及银蓝调脂胶囊高、中、低剂量组小鼠肝脏ApoB、ApoE含量均明显降低(P<0.01)。
表6 银蓝调脂胶囊对对非酒精性脂肪肝(NAFLD)小鼠肝脏脂质代谢的影响(±s,n=10)Table 6 Effects of Yinlan Tiaozhi Capsules on liver lipid metabolism in NAFLD mice(±s,n=10)
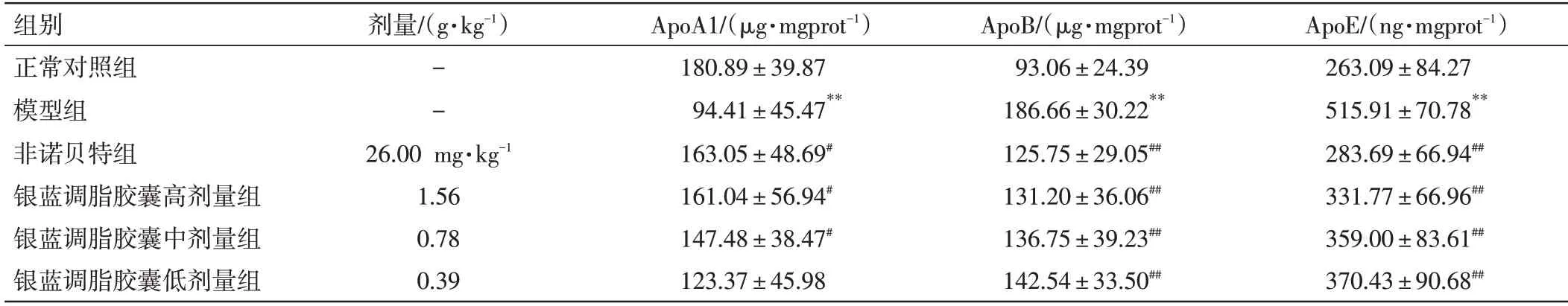
表6 银蓝调脂胶囊对对非酒精性脂肪肝(NAFLD)小鼠肝脏脂质代谢的影响(±s,n=10)Table 6 Effects of Yinlan Tiaozhi Capsules on liver lipid metabolism in NAFLD mice(±s,n=10)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
ApoE/(ng·mgprot-1)263.09±84.27 515.91±70.78**283.69±66.94##331.77±66.96##359.00±83.61##370.43±90.68##组别正常对照组模型组非诺贝特组银蓝调脂胶囊高剂量组银蓝调脂胶囊中剂量组银蓝调脂胶囊低剂量组剂量/(g·kg-1)--26.00 mg·kg-1 1.56 0.78 0.39 ApoA1/(μg·mgprot-1)180.89±39.87 94.41±45.47**163.05±48.69#161.04±56.94#147.48±38.47#123.37±45.98 ApoB/(μg·mgprot-1)93.06±24.39 186.66±30.22**125.75±29.05##131.20±36.06##136.75±39.23##142.54±33.50##
3.8 小鼠肝脏HE 染色、油红O 染色及脂滴面积定量结果结果见图2。HE 染色结果显示,正常对照组肝细胞为类八角形且形态正常,呈放射状规则排列,边界清晰无圆形空泡样。模型组肝细胞排列紊乱疏松,细胞间有大量空泡样及边界模糊,炎细胞浸润,出现弥漫性肝细胞脂肪样变。非诺贝特组与银蓝调脂胶囊高、中、低剂量组肝细胞排列较为整齐,结构变清晰,炎细胞浸润减少,脂肪空泡的大小和数量均有不同程度减少,病变减轻。油红O染色结果显示,正常对照组肝脏只有少量零星且呈点状散在的染红的脂肪沉积,颜色浅淡。模型组肝脏内可见分布密集的脂滴,红色较重,形状大而圆且部分脂滴连成片状。与模型组比较,非诺贝特组及银蓝调脂胶囊高、中、低剂量组脂肪染色面积、红色脂滴数量及红色深度均有不同程度的减轻。
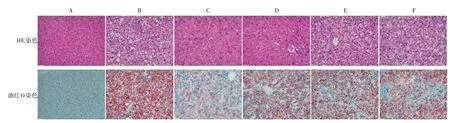
图2 各组小鼠肝脏HE 染色和油红O 染色病理观察结果(×200)Figure 2 Pathological observation results of HE staining and oil red O staining in mice liver(×200)
见表7。与正常对照组比较,模型组大鼠肝脏脂滴空泡面积比、油红O 染色面积比明显升高(P<0.01);与模型组比较,非诺贝特组及银蓝调脂胶囊高、中、低剂量组小鼠肝脏脂滴空泡面积比、油红O染色面积比均明显降低(P<0.01)。
表7 银蓝调脂胶囊对非酒精性脂肪肝(NAFLD)小鼠肝脏脂质代谢的影响(±s,n=10)Table 7 Effects of Yinlan Tiaozhi Capsules on liver lipid metabolism in NAFLD mice(±s,n=10)
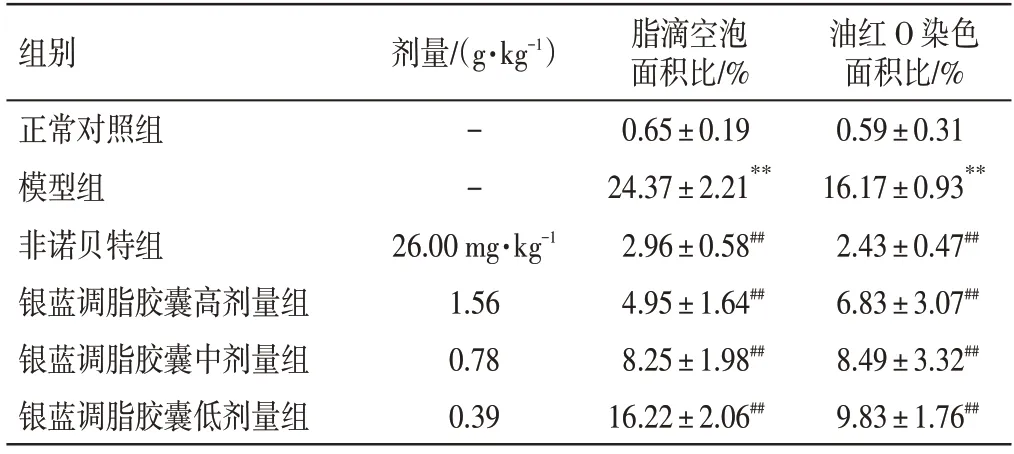
表7 银蓝调脂胶囊对非酒精性脂肪肝(NAFLD)小鼠肝脏脂质代谢的影响(±s,n=10)Table 7 Effects of Yinlan Tiaozhi Capsules on liver lipid metabolism in NAFLD mice(±s,n=10)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01
油红O 染色面积比/%0.59±0.31 16.17±0.93**2.43±0.47##6.83±3.07##8.49±3.32##9.83±1.76##组别正常对照组模型组非诺贝特组银蓝调脂胶囊高剂量组银蓝调脂胶囊中剂量组银蓝调脂胶囊低剂量组剂量/(g·kg-1)--26.00 mg·kg-1 1.56 0.78 0.39脂滴空泡面积比/%0.65±0.19 24.37±2.21**2.96±0.58##4.95±1.64##8.25±1.98##16.22±2.06##
3.9 银蓝调脂胶囊对NAFLD 小鼠肝脏脂类代谢相关蛋白表达的影响见图3。与正常对照组比,模型组小鼠肝脏ACC1、FAS、SREBF-1 蛋白表达量均升高(P<0.01)。与模型组比较,非诺贝特组及银蓝调脂胶囊高、中、低剂量组小鼠肝脏ACC1蛋白表达量均明显降低(P<0.01);非诺贝特组及银蓝调脂胶囊高、中剂量组小鼠肝脏FAS 、SREBF-1蛋白表达量均明显降低(P<0.01)。
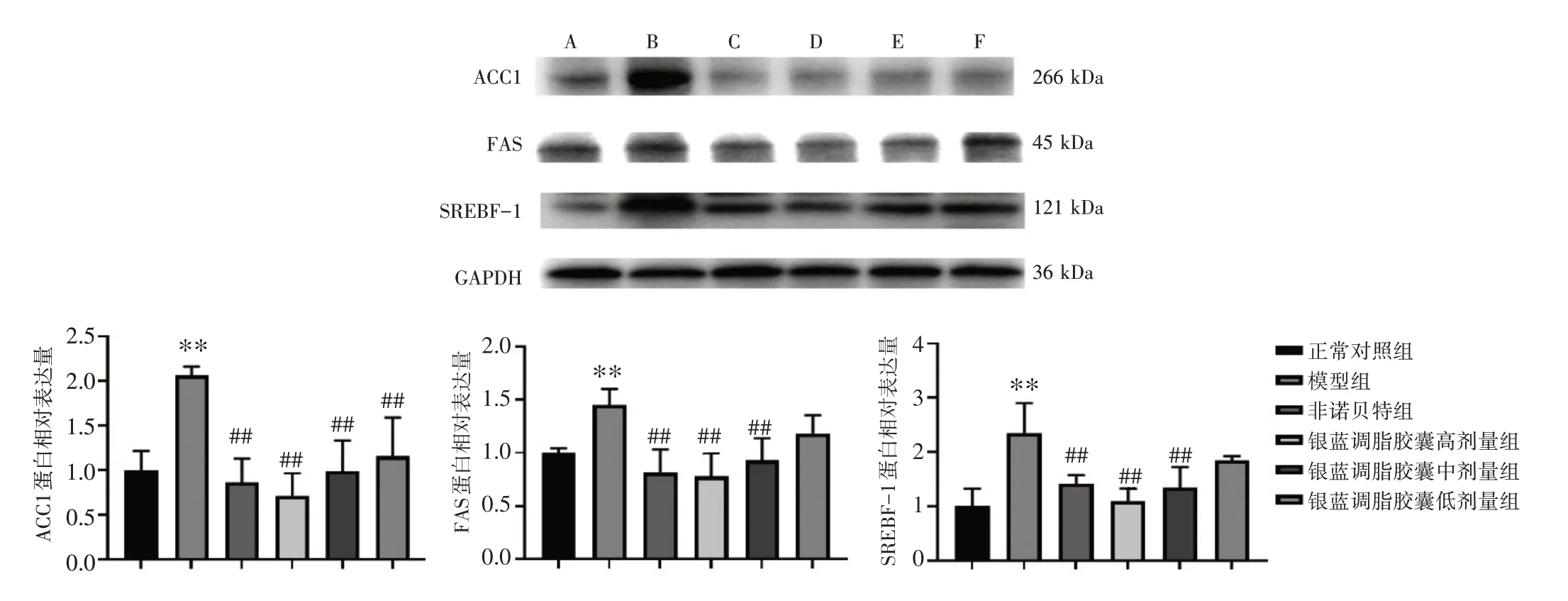
图3 银蓝调脂胶囊对非酒精性脂肪肝(NAFLD)小鼠肝脏ACC1、FAS、SREBF-1 蛋白表达的影响(±s,n=10)Figure 3 Effects of Yinlan Tiaozhi Capsules on the protein expressions of ACC1,FAS and SREBF-1 in the liver of NAFLD mice(±s,n=10)
3.10 银蓝调脂胶囊对NAFLD 小鼠自噬相关蛋白表达的影响见图4。与正常对照组比,模型组小鼠肝脏ATG3、ATG5、Beclin1 蛋白表达量降低(P<0.05,P<0.01);ATG7 蛋白表达量有降低的趋势,但差异无统计学意义(P>0.05);P62 蛋白表达量明显升高(P<0.01)。与模型组比较,非诺贝特组及银蓝调脂胶囊高剂量组小鼠肝脏ATG3、ATG7 蛋白表达量均升高(P<0.05,P<0.01);银蓝调脂胶囊中、低剂量组小鼠肝脏ATG3蛋白表达量有升高趋势,但差异无统计学意义(P>0.05)。与模型组比较,非诺贝特组及银蓝调脂胶囊高、中剂量组小鼠肝脏ATG5蛋白表达量均明显升高(P<0.05,P<0.01);银蓝调脂胶囊低剂量组小鼠肝脏ATG5蛋白表达量有升高趋势,但差异无统计学意义(P>0.05)。与模型组比较,非诺贝特组及银蓝调脂胶囊高、中、低剂量组P62蛋白表达量均明显降低(P<0.05,P<0.01)。
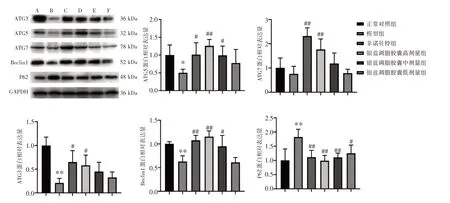
图4 银蓝调脂胶囊对非酒精性脂肪肝(NAFLD)小鼠肝脏ATG3、ATG5、ATG7、Beclin1、P62 蛋白表达的影响(±s,n=10)Figure 4 Effects of Yinlan Tiaozhi Capsules on the protein expressions of ATG3,ATG5,ATG7,Beclin1 and P62 in the liver of NAFLD mice(±s,n=10)
4 讨论
非酒精性脂肪性肝病(NAFLD)是指排除酒精以及其他损伤肝脏因素作用下产生的肝脏病变疾病,主要特征是肝细胞内脂肪堆积和沉积过多,其与一系列代谢合并症密切相关,如肥胖、2型糖尿病、高血压、心血管疾病和高胆固醇血症等,代谢合并症数量的增加不仅增加了NAFLD 的患病率,而且还使患者患进行性肝病的风险更高[10-12]。目前市面上针对非酒精性脂肪肝的发病机制有不同的药物研究如调节代谢药物、抵抗氧化应激和炎症药物、针对肠道药物、抗肝纤维化药物等,通过不同的作用靶点对疾病进行治疗[13]。本课题组前期研究[6-8]发现,银蓝调脂胶囊作为调脂中药新药,能明显降低高脂饲料饮食所致的高脂血症,且在巨噬细胞泡沫化中具有抑制作用,可通过激活LXR 信号通路促进胆固醇逆转运并抑制炎症,从而调节血脂,抗动脉粥样硬化。
在本实验中,我们通过高脂饮食喂养建立小鼠NAFLD 模型,发现模型组小鼠血清HDL-C 含量降低,TC、TG、LDL-C、IL-6、TNF-α、ALT 和AST水平升高;对肝脏的观察发现模型组小鼠肝脏形态肥大,颜色偏黄,边缘钝化,质感厚重;HE病理切片观察到模型组肝细胞排列紊乱,胞浆疏松,部分细胞几乎呈空泡样,炎细胞浸润,出现弥漫性肝细胞脂肪样变,油红O 结果亦显示小鼠肝脏脂质增加,这些都提示NAFLD模型建立成功,也证明NAFLD的主要病理特征除了肝细胞发生脂肪变性外,还有肝组织的代谢性炎症。本实验通过对小鼠血脂指标、肝功能的检测并观察肝脏病理形态变化,评估银蓝调脂胶囊的药效,发现NAFLD 小鼠的血脂水平、肝功能、肝脏组织病理变化、脂肪变性和炎症水平等都得到了不同程度的改善,表明银蓝调脂胶囊能减少NAFLD 肝脏的脂质堆积,降低肝脏的脂毒性、减轻肝脏炎症损伤。
在肝细胞中脂质的过度积累会使机体自由基过饱和,发生过氧化反应,导致脂质代谢发生紊乱,进而引发肝细胞氧化损伤[14]。MDA 是自由基氧化最终产物,具有细胞毒性,因此可通过MDA 了解脂质过氧化的水平,间接评估组织受损程度[15]。SOD是人体内最重要的、最高效率的自由基清除剂,可维持机体代谢平衡,防止机体过氧化损伤[16]。GSH-Px 也是机体内广泛存在的一种重要的过氧化物分解酶,同样是反映机体抗过氧化能力的重要指标之一[17]。本实验的结果显示,银蓝调脂胶囊可降低NAFLD 小鼠血清中MDA 水平,增强SOD 及GSH-Px 活性,具有一定的抗氧化作用,能减轻NAFLD 肝脏的氧化应激损伤。
载脂蛋白是一种能够结合和运输血脂到机体各组织进行代谢及利用的蛋白质,其中ApoA1 主要在肝脏和小肠合成,90%存在于高密度脂蛋白中,是运载高密度脂蛋白的一种工具,也是组成HDL-C 的一种成分,与HDL-C呈明显正相关;ApoB主要由肝脏合成,是LDL-C 的主要结构蛋白,二者呈正相关[18];ApoE 主要在肝脏和脑组织合成,与脂蛋白代谢有密切相关性,往往与血浆TG 含量呈正相关[19]。本实验的结果显示,银蓝调脂胶囊可升高NAFLD 小鼠肝脏中ApoA1水平,降低ApoB、ApoE水平,能调节肝脏脂质代谢,从而改善血脂水平。
本研究基于胆固醇合成代谢信号通路采用Western Blot 法检测了小鼠肝脏中相关蛋白的表达水平。肝脏中SREBF-1 作为一种转录因子,可以调控多个脂质合成相关基因,介导脂肪肝发生的进展,FAS和ACC1作为SREBF-1的下游基因,参与到脂质合成的过程中[20]。Western Blot 结果显示,模型组小鼠肝脏脂质合成因子SREBF-1、FAS、ACC1 表达增加,促进肝脏脂肪酸积聚和TG合成,导致肝脏脂质堆积过多而形成脂肪肝。而给予银蓝调脂胶囊干预后,小鼠肝脏中SREBF-1 及其下游因子FAS、ACC1表达量对比模型组得到不同程度减少,证明银蓝调脂胶囊能够抑制NAFLD 小鼠肝脏的脂质合成,减少肝脏脂肪累积,改善肝损伤与脂质代谢。
自噬是一种细胞内降解途径,将细胞质组分靶向于溶酶体降解,用于清除细胞内蛋白质聚集体和损伤的细胞器,并回收材料和产生能量来维持细胞和组织的稳态,其调节失调已被证明参与了多种人类疾病的发病机制[21]。自噬通过调控肝脏脂质沉积、氧化应激、炎症反应,减少肝细胞损害,从而保护肝细胞:在NAFLD 初期,肝细胞自噬水平上调,从而维持细胞内环境平衡、减轻细胞损伤和炎症反应、减少细胞内脂质堆积,延缓疾病进程;在慢性阶段或长期高脂饮食后,雷帕霉素靶蛋白被过度激活,自噬水平下调,自噬-溶酶体蛋白水解功能明显下降,因此脂质代谢异常且活性氧聚集从而加速了疾病的进行性发展。因此,诱导自噬可以缓解NAFLD的疾病发展[22]。Beclin1、ATG3、ATG5、ATG7 等因子是已知重要的的自噬相关基因,其中Beclin1 参与自噬的启动、自噬体膜的形成和成核阶段,而ATG3和ATG5是细胞自噬通路上的关键因子。在自噬体的形成过程中,ATG12-ATG5系统和LC3两个泛素样结合系统负责自噬体膜延伸;同时,ATG7作为类E1泛素活化酶,对于激活泛素样蛋白ATG12与ATG5的结合也是必不可少的,并调节前LC3脂质化以增加囊泡膜的伸长[23]。P62 是一种连接泛素化蛋白酶体系统(UPS)和自噬途径的受体蛋白,用作自噬活性的报告基因,P62 选择性与泛素化蛋白结合并转运至自噬体,之后自身随泛素化蛋白一起通过自噬途径降解[24],因此,P62的蛋白水平与选择性自噬的活性呈负相关。在本实验中,与正常对照组比较,模型组小鼠肝脏中Beclin1、ATG3、ATG5、ATG7 等蛋白的表达量明显降低,而P62明显升高;经过银蓝调脂胶囊干预后,Beclin1、ATG3、ATG5、ATG7 等蛋白的表达量明显升高,而P62明显降低,变化趋势与非诺贝特组一致。研究结果提示,自噬在NAFLD 中发挥重要的作用,银蓝调脂胶囊可通过激活自噬进一步调控肝脏脂质沉积、炎症反应,减少肝细胞损害,从而保护肝细胞。
总而言之,本研究表明,银蓝调脂胶囊可明显改善高糖高脂饮食诱导NAFLD 小鼠的肝损伤和肝脂代谢水平,通过自噬相关蛋白的检测证实,银蓝调脂胶囊可激活自噬通路改善NAFLD 小鼠模型的脂肪变性。此研究结果扩大了我们对银蓝调脂胶囊在NAFLD 中药理作用的认识,此为通过激活自噬从而治疗NAFLD 提供了理论依据,但是其确切的机制需要进一步研究。

