可原位释放一氧化氮的聚多巴胺纳米复合物的制备及其应用
任 蓉,王 颖,王 通,修梦婷,朱利民
(东华大学 a.生物与医学工程学院, b.上海纳米生物材料与再生医学工程研究中心, 上海 201620)
气体治疗作为一种新兴的治疗手段,可为攻克癌症提供新思路。气体治疗常用的内源性活性分子主要有CO、H2S和NO等[1-5],其中NO是自然界中最小、最简单的生物活性分子之一。研究证实,除参与调解多细胞活动[6-8]以外,NO与许多疾病的发生和发展密切相关[9-10],且高浓度的NO对肿瘤细胞具有明显的抑制作用[11]。然而,由于NO在体内自由扩散迅速,半衰期短[12],常常在肿瘤部位缺乏有效积累,致使治疗效果不佳。L-精氨酸(L-arginine, L-Arg)作为天然的NO供体,可在诱导型NO合成酶(inducible nitric oxide synthase, INOS)存在的情况下持续释放NO。此外,L-Arg还可被活性氧(reactive oxygen species, ROS),如H2O2、单线态氧(1O2)等氧化生成NO[13-15],这为NO气体的原位释放提供了新思路。
由于独特的理化性质,聚多巴胺(polydopamine, PDA)在生物医学领域得到广泛应用[16-18]。在弱碱性环境下,多巴胺可以自聚合,并在众多材料表面形成PDA层。PDA的制备方法也在不断发展和改进,这使得PDA被塑造成各种形态[19-21]。Lee等[22]开发了一种含有儿茶酚胺官能团的多巴胺表面改性技术,研究指出PDA作为外壳几乎可以包裹在任何固体材料表面。事实上,PDA除了包覆纳米颗粒(nanoparticles, NPs)以外,还可以制成纳米载体。
本研究利用PDA结构与富π电子的三甲基苯(1,3,5-trimethylbenzene, TMB)分子之间的π-π堆积作用合成介孔聚多巴胺(mesoporous polydopamine, MPDA)纳米颗粒,并以其为载体负载L-Arg和光敏剂IR780,制备可原位释放NO的纳米复合物。在波长为808 nm的近红外激光(NIR)照射下,IR780可以产生1O2,1O2进而将L-Arg氧化生成NO,最终实现NO的原位释放。
1 试验部分
1.1 试剂与仪器
盐酸多巴胺(DA·HCl)、Pluronic F127、羟甲基氨基甲烷(Tris)和TMB,阿拉丁生化科技股份有限公司;IR780,北京百灵威科技有限公司;无水乙醇、二甲基亚砜(DMSO)、氨水、戊二醛和丙酮,国药集团化学试剂有限公司;1,3-二苯基异苯并呋喃(DPBF),上海麦克林公司;维生素C(Vc),上海源叶生物科技有限公司;DMEM高糖培养基、磷酸盐缓冲液(PBS)、胰蛋白酶、胎牛血清(FBS)和青霉素-链霉素溶液,美国赛默飞世尔科技公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT),美国Sigma公司;活性氧探针(DCFH),一氧化氮荧光探针(DAF-FM DA),4′,6-二脒基-2-苯基吲哚(DAPI),南京凯基生物技术公司;人骨肉瘤细胞(143B),中国科学院生物化学与细胞生物学研究所。所用药品均为分析纯,所用水均为超纯水。
GL124-1SCN型分析天平,德国Sartorius公司;C-MAGHS10型磁力搅拌器,德国IKA公司;SCQ-5201C1型超声波清洗机,上海声彦超声波仪器有限公司;FD-1 D-50型冷冻干燥机,北京博医康实验仪器有限公司;JEM-2100型透射电子显微镜,日本JEOL公司;Tristar 3000型全自动快速比表面积与孔隙度分析仪,美国麦克仪器公司;ZS90型马尔文纳米粒度电势分析仪,英国马尔文公司;UV3600型紫外可见分光光度计,日本岛津公司;CLARUSSQ8-STA8000型热重分析仪,美国珀金埃尔默公司;ADR-1860型激光器,上海熙隆光电科技有限公司;FV1000型共聚焦激光扫描显微镜,日本奥林巴斯公司;DMi8型倒置荧光显微镜,德国Leica公司。
1.2 试验方法
1.2.1 MPDA的制备
将0.2 g Pluronic F127和0.2 g TMB加至50 mL含超纯水和无水乙醇的混合溶液中,搅拌30 min。然后,将10 mg Tris溶解于10 mL超纯水中,再加至上述混合液中。加入60 mg DA·HCl,搅拌反应24 h后,以13 000 r/min转速离心10 min(离心半径为6.79 cm),用体积比为2∶1的乙醇和丙酮洗涤3次,得到MPDA。最终产品于-45 ℃冷冻干燥48 h以供进一步使用。
1.2.2 精氨酸-聚多巴胺(A-MPDA)的制备
将L-Arg粉末溶于50 mmol pH=8.5的Tris缓冲液中,质量浓度为1.0 mg/mL。然后与适量的MPDA粉末混合,得到MPDA质量浓度为0.2 mg/mL的混合溶液。以300 r/min转速搅拌溶液24 h,再经13 000 r/min转速离心(离心半径为6.79 cm)获得A-MPDA,并将其超声分散于PBS溶液中。
1.2.3 精氨酸-IR780-聚多巴胺(AI-MPDA)和IR780-聚多巴胺(I-MPDA)的制备
将30 mg IR780溶解于100 μL DMSO中,再滴加到棕黑色A-MPDA悬浮液中,避光条件下搅拌(转速为300 r/min)过夜。以13 000 r/min转速离心(离心半径为6.79 cm)去除下层游离的IR780,收集洗涤后的AI-MPDA,于-45 ℃冷冻干燥48 h备用。AI-MPDA的合成示意图如图1所示。同时,将30 mg IR780溶解于100 μL DMSO中,再滴加到MPDA悬浮液中,避光条件下搅拌(转速为300 r/min)过夜。以13 000 r/min转速离心(离心半径为6.79 cm)去除下层游离的IR780,收集洗涤后的I-MPDA,于-45 ℃冷冻干燥48 h备用。
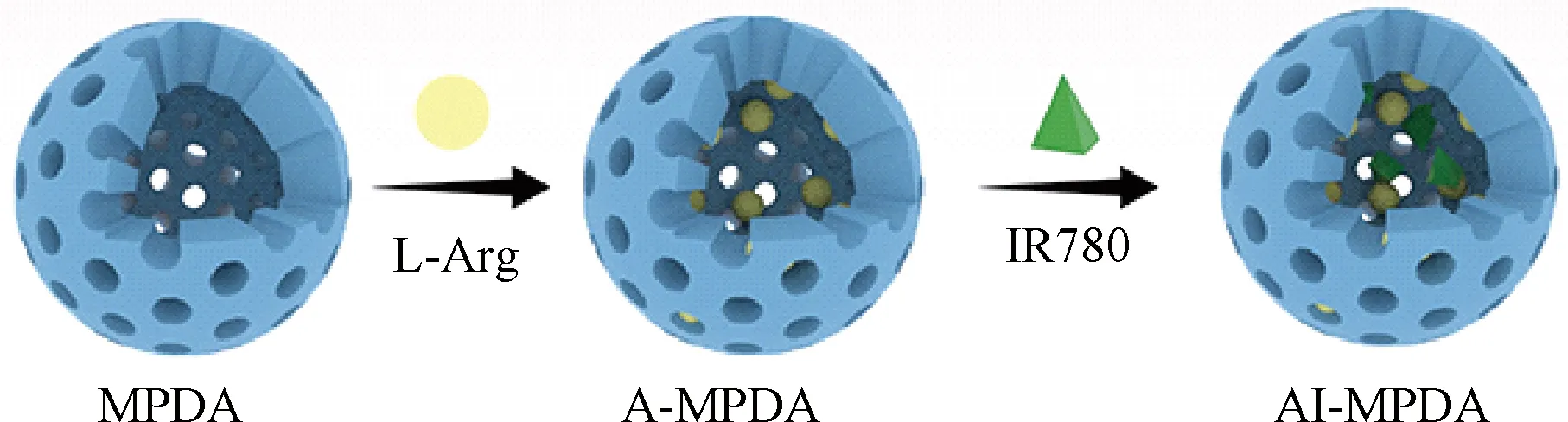
图1 AI-MPDA NPs的制备示意图Fig.1 Schematic diagram of preparation of AI-MPDA NPs
1.2.4 IR780负载量的测定
用PBS分别配制质量浓度为2、4、6、8、10 μg/mL的IR780溶液,用紫外可见分光光度计在λ=780 nm处测定溶液的吸光值,并绘制IR780溶液吸光度-质量浓度标准曲线。
取1 mL未纯化的AI-MPDA溶液,以13 000 r/min转速离心5 min(离心半径为6.79 cm),吸取上清液,并稀释至合适的质量浓度,用紫外-可见分光光度计测定溶液的吸光度值,再根据标准曲线计算复合物中IR780的含量。根据式(1)和(2)计算材料的载药率L和包封率E。
(1)
(2)
式中:m0为IR780的投药量,g;m1为上清液中IR780的质量,g;m为A-MPDA的质量,g。
1.3 材料表征
1.3.1 透射电子显微镜(TEM)分析
分别吸取质量浓度为0.2 mg/mL的MPDA和质量浓度为0.2 mg/mL的AI-MPDA乙醇溶液,滴加到铜网上,自然干燥至液滴消失后继续烘干,然后通过透射电子显微镜对样品进行形貌分析。
1.3.2 稳定性分析
取质量浓度为0.5 mg/mL的MPDA和AI-MPDA水溶液,室温下静置24 h,观察纳米颗粒在水溶液中的聚集情况。
1.3.3 比表面积与孔隙度(BET)分析
取200 mg冷冻干燥得到的MPDA粉末,通过全自动快速比表面积与孔隙度分析仪测定样品的比表面积与孔径。
1.3.4 纳米粒度和电势分析
分别取经PBS溶解的质量浓度为0.5 mg/mL的MPDA、AI-MPDA溶液各2 mL,超声处理5 min,然后分别转移到比色皿中,用马尔文纳米粒度电势分析仪检测不同样品的粒径。
同时,利用纳米粒度电势分析仪对MPDA及其修饰物的表面电势进行表征。分别取800 μL PBS溶解的质量浓度为0.5 mg/mL的MPDA、A-MPDA和AI-MPDA样品置于Zeta电位样品池,分析不同样品的Zeta电位。
1.3.5 热重分析
在氮气气氛下使用热重分析仪,将1~5 mg样品以10 ℃/min的速率从50 ℃加热到600 ℃进行热重分析。
1.3.6 UV-Vis分析
分别取PBS溶解的质量浓度为50 mg/L的L-Arg、MPDA NPs、IR780、AI-MPDA NPs溶液各800 μL,超声5 min使其充分溶解,然后分别转移到比色皿中,通过UV-3600型紫外可见分光光度计于200~1 000 nm波长区间检测样品的紫外吸收值。
1.4 AI-MPDA的体外细胞摄取
将143B细胞接种于35 mm共聚焦培养皿中,并在37 ℃、体积分数为5%的CO2环境中培养24 h。设置4组试验,即对照组PBS、IR780、AI-MPDA NPs、AI-MPDA NPs+NIR(近红外激光照射)。用未添加FBS的DMEM培养基培养4 h(其中AI-MPDA NPs+NIR组在培养2 h后,用808 nm近红外光照射5 min,然后再培养2 h),然后去掉培养基,用PBS溶液洗涤两次。用戊二醛溶液在4 ℃下固定细胞,15 min后吸弃戊二醛溶液,用PBS溶液洗涤两次,在黑暗中用DAPI染色液染色5 min,再用PBS溶液洗涤3次,通过共聚焦激光扫描显微镜(CLSM)记录图像。
1.5 AI-MPDA的体外ROS生成
将143B细胞接种于6孔板,并在37 ℃、体积分数为5%的CO2环境中培养24 h。设置4组试验,即对照组PBS、IR780+NIR、I-MPDA+NIR和AI-MPDA+NIR。将PBS溶液及其溶解的药物添加到每个孔的培养基中,持续孵育4 h。吸去药物溶液后,每孔加入1 mL配置好的DCFH染液。于37 ℃温育20 min(其中NIR组在温育10 min后,用808 nm近红外光照射5 min,然后再温育5 min),然后吸去染色液,采用PBS溶液洗涤3次,通过倒置荧光显微镜记录图像。
1.6 AI-MPDA的体外NO生成
将143B细胞接种于6孔板,并在37 ℃、体积分数为5%的CO2环境中培养24 h。设置4组试验,即对照组PBS、A-MPDA NPs+NIR、AI-MPDA NPs+NIR和AI-MPDA NPs+Vc+NIR。将PBS溶液及其溶解的药物添加到每个孔的培养基中,持续孵育4 h。吸去药物溶液后,每孔加入1 mL配置好的DAF-FM DA染液。然后于37 ℃温育20 min(其中NIR组在温育10 min后,用808 nm近红外光照射5 min,然后再温育5 min),然后吸去染色液,使用PBS溶液洗涤3次,通过倒置荧光显微镜记录图像。
2 结果与讨论
2.1 材料的制备及性质
2.1.1 MPDA和AI-MPDA的TEM分析和稳定性分析
MPDA和AI-MPDA的TEM图如图2所示。由图2(a)可以看出,MPDA具有较为均匀的球形形貌和不规则的介孔结构,肉眼观察到其粒径约为180 nm;由图2(b)可以看出,AI-MPDA的介孔结构逐渐变得模糊,粒径略微增大,约为200 nm,说明成功合成纳米颗粒。此外,将MPDA和AI-MPDA的水溶液静置24 h后,均没有观察到明显的聚集现象(见图3),说明制备的纳米颗粒具有良好的分散性和稳定性。

图2 MPDA和AI-MPDA的TEM图像Fig.2 TEM images of MPDA and AI-MPDA

图3 MPDA和AI-MPDA在水中的数码照片Fig.3 Digital photos of the MPDA and AI-MPDA in water
2.1.2 MPDA的BET分析
MPDA的氮气吸附-脱附曲线和孔径分布曲线如图4所示,其中,图4(b)纵轴标题中的r=dV/dD。由图4(a)可知,MPDA的氮气吸附-脱附曲线为典型的Ⅳ型等温线,表明存在介孔。此外,由图4(b)可知,MPDA在9~80 nm内存在较宽的孔径分布。这是因为纳米颗粒的孔径分布不规则,且在合成的过程中产生了大小不规则的空腔。制备的MPDA纳米颗粒的比表面积为40.80 m2/g,总孔容为0.44 cm3/g。
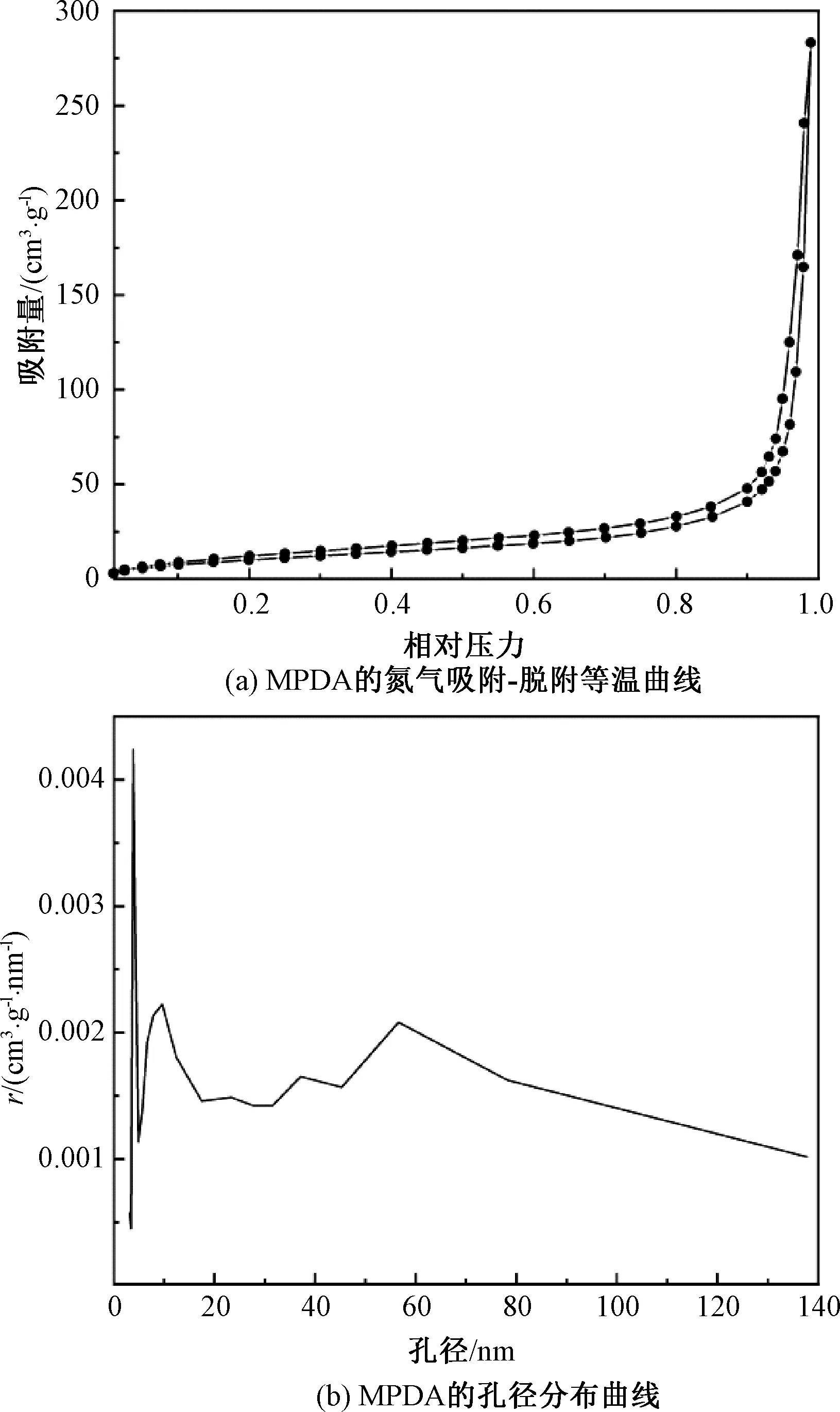
图4 MPDA的氮气吸附-脱附等温曲线和孔径分布Fig.4 Nitrogen adsorption and desorption isothermal curve and pore size distribution of MPDA
2.1.3 MPDA和AI-MPDA的粒径和电势分析
MPDA和AI-MPDA的粒径分布如图5所示。由图5可知,制备的MPDA纳米载体的粒径约为180 nm。经过一系列修饰后,AI-MPDA的粒径略大于MPDA,约为200 nm,能通过肿瘤的高渗透强滞留(enhanced permeability and retention,EPR)效应,促使AI-MPDA在肿瘤部位聚集。
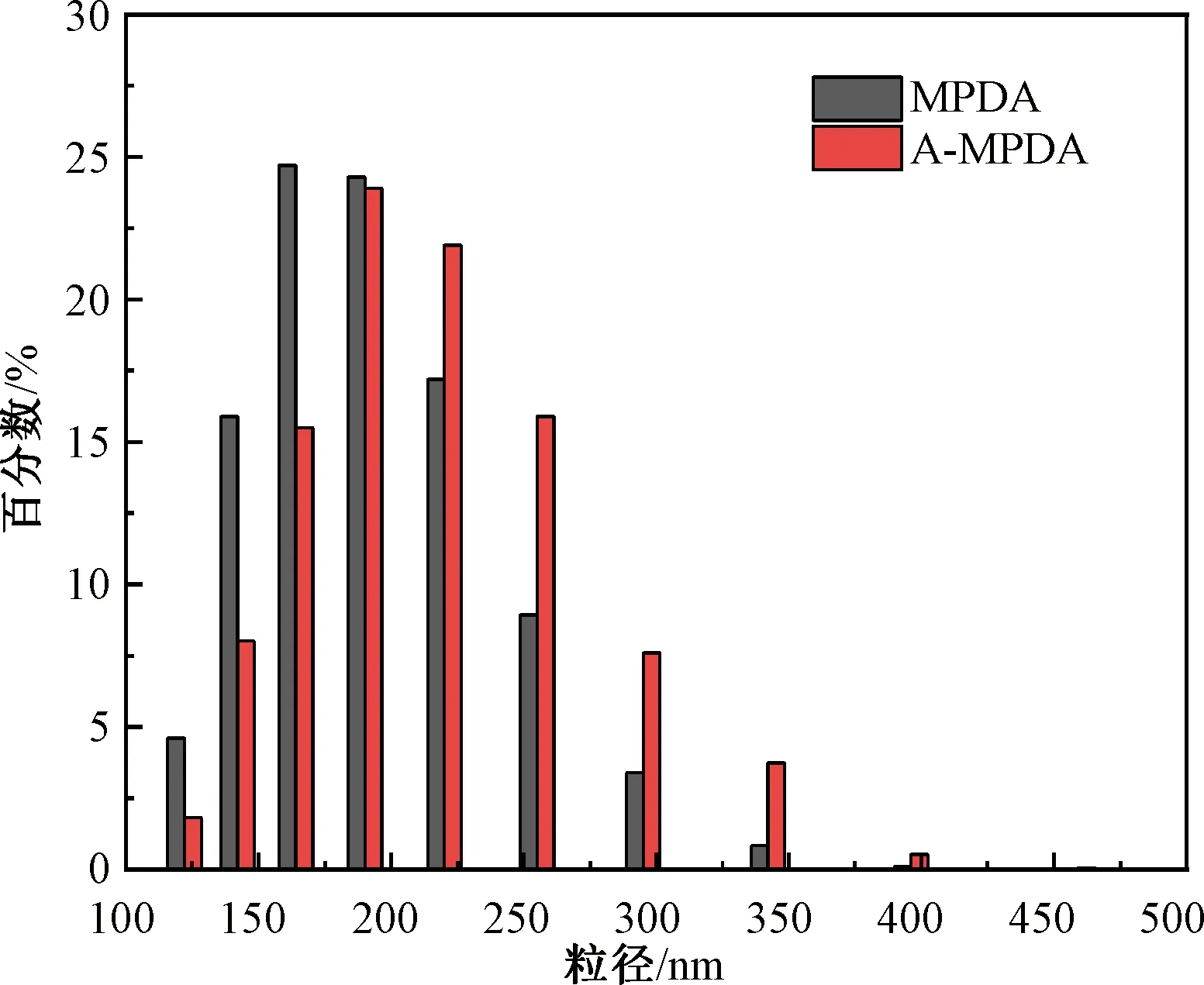
图5 MPDA和AI-MPDA的粒径分布Fig.5 Particle size distribution of MPDA and AI-MPDA
通过Zeta电势的变化来验证纳米颗粒的制备结果。MPDA、A-MPDA和AI-MPDA的表面电势如图6所示。由图6可知,MPDA的电势约为-24.6 mV,加入L-Arg后,A-MPDA的电势变为-10.6 mV,负载IR780后的电势较A-MPDA升高了约3 mV。电势的变化表明成功制备出AI-MPDA纳米颗粒。
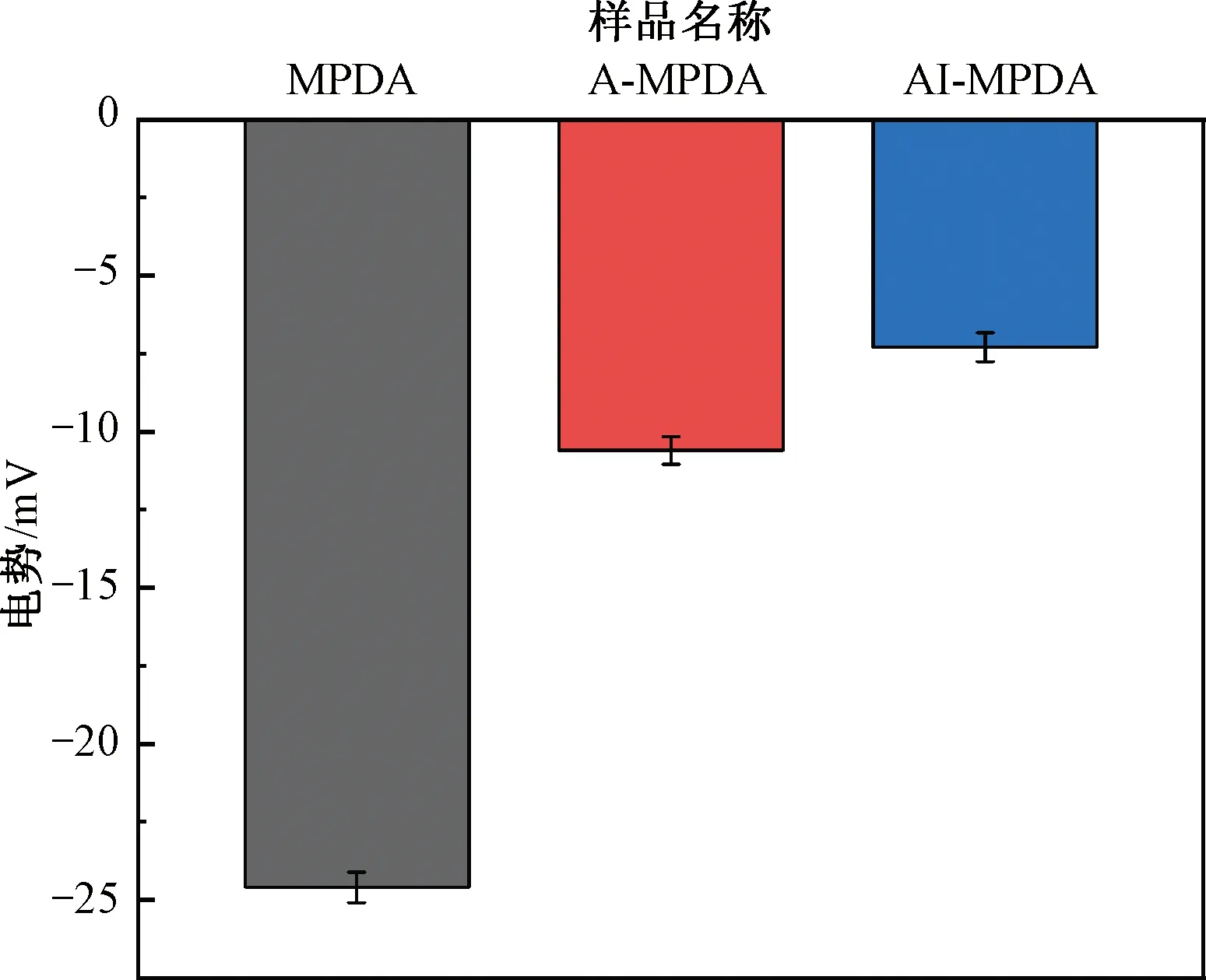
图6 MPDA、A-MPDA和AI-MPDA的表面电势Fig.6 Zeta potential of MPDA, A-MPDA and AI-MPDA
2.1.4 IR780、L-Arg的负载和UV-Vis分析
证实成功合成MPDA后,利用纳米载体进行载药。将载药试验得到的上清液中的IR780的吸光值代入到IR780标准曲线(y=0.040 3x+0.155 1,R2=0.999 3)中求IR780的负载量,再将IR780负载量代入式(1)和式(2),计算得出载药率为19.88%、包封率为99.00%。
MPDA和A-MPDA的热重分析曲线如图7所示。MPDA加热到600 ℃时失重率为45.7%,而A-MPDA加热到600 ℃时的失重率为53.2%。这主要归功于L-Arg发生的热解反应。证实L-Arg成功负载在MPDA上。计算得出L-Arg的负载率约为7.5%。
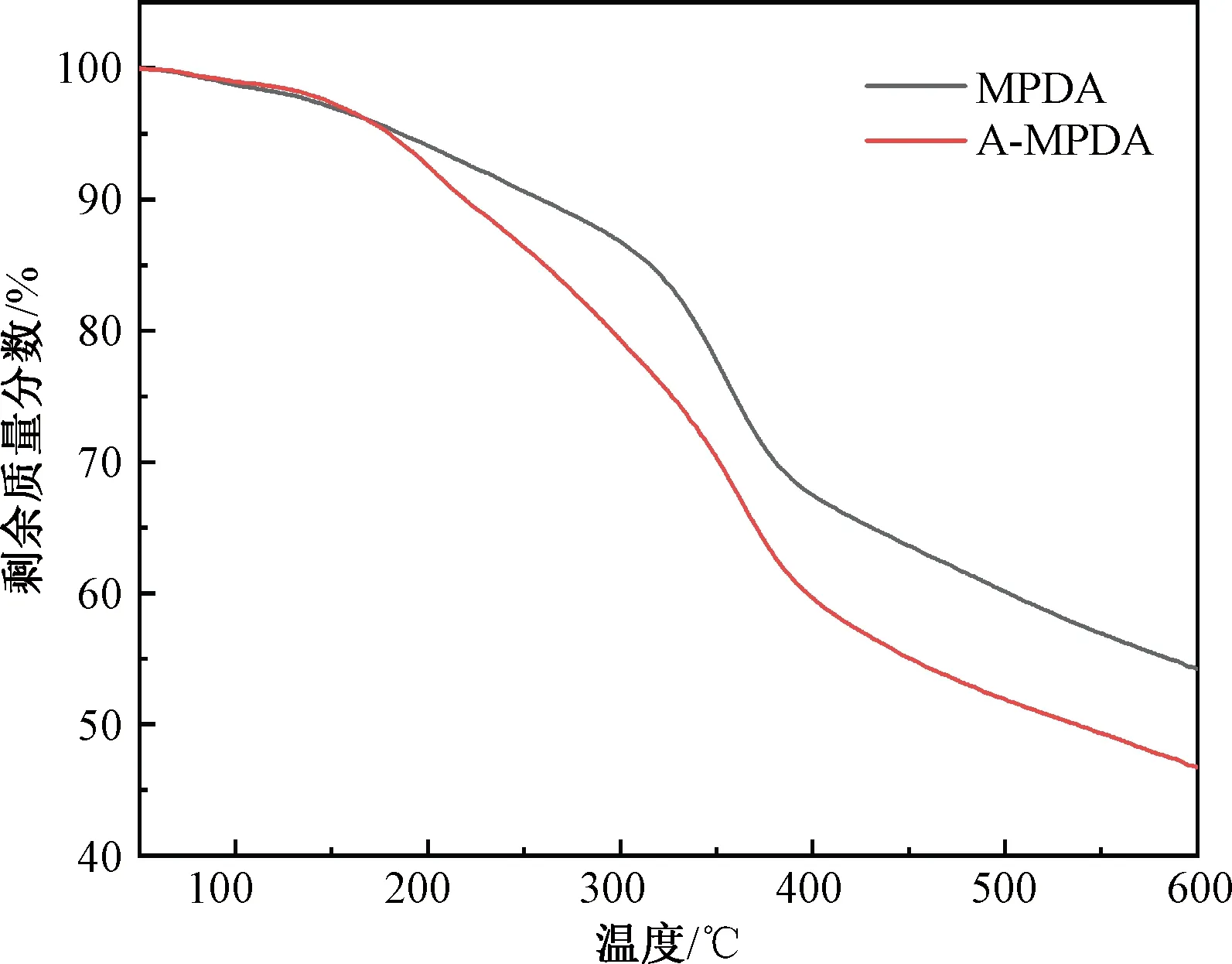
图7 MPDA和A-MPDA的热重分析曲线Fig.7 TGA curves of MPDA and A-MPDA
MPDA、L-Arg、IR780和AI-MPDA的紫外-可见光吸收光谱如图8所示。由图8可知,在600~800 nm处出现游离IR780的特征吸收峰,相应地,AI-MPDA在700~900 nm处有较宽的吸收峰。IR780的典型吸收峰位于740和810 nm处,这可归因于IR780聚集体形成的红移现象[23],说明成功制备得到AI-MPDA纳米颗粒。
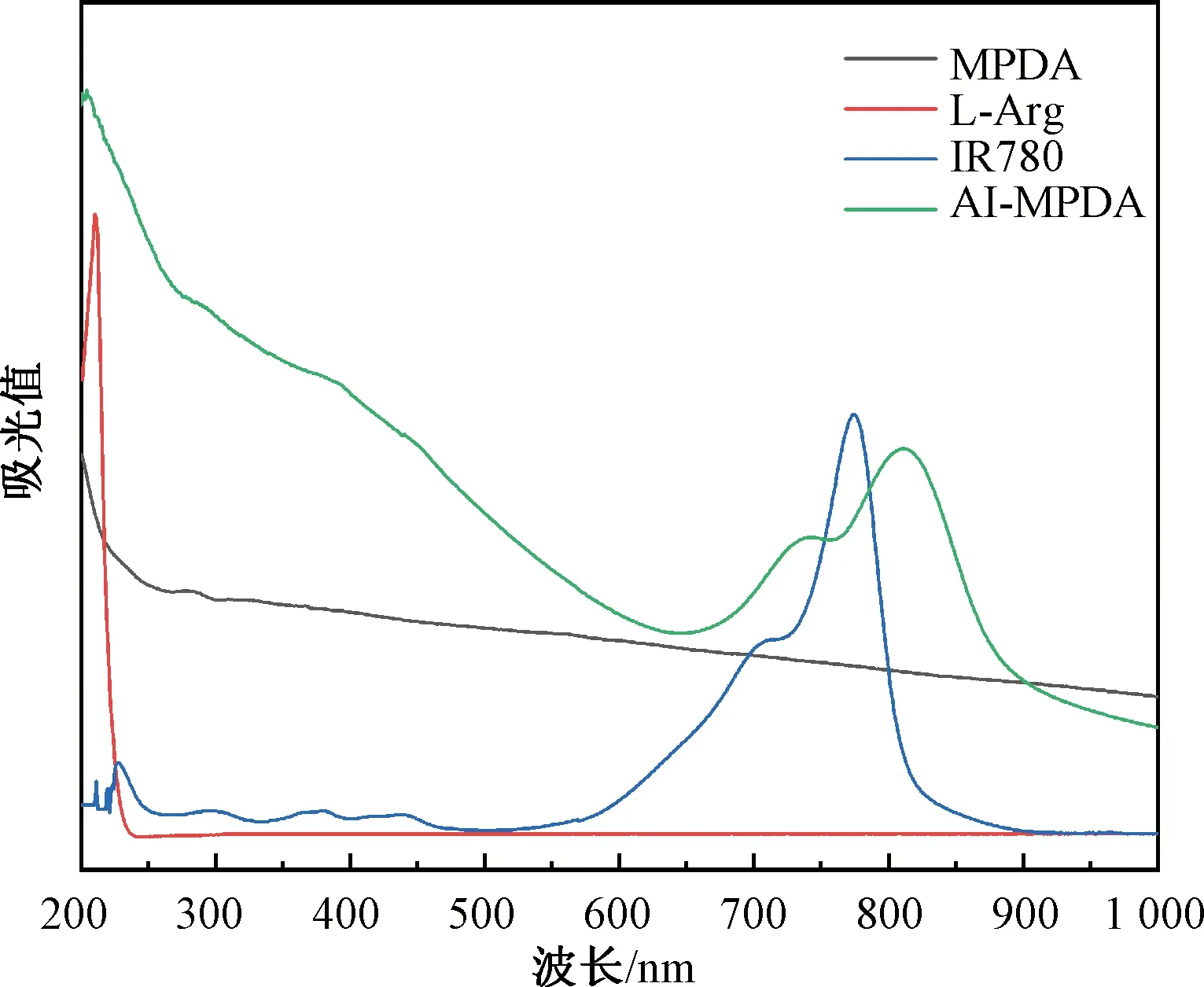
图8 MPDA、L-Arg、IR780和AI-MPDA的紫外-可见光吸收光谱Fig.8 UV-Vis absorption spectra of MPDA, L-Arg, IR780 and AI-MPDA
2.2 AI-MPDA NPs的体外细胞摄取
为了评估143B细胞对纳米颗粒的摄取情况,通过CLSM记录细胞内的IR780荧光强度,结果如图9所示。由图9可知,与游离IR780治疗时的微弱红色荧光相比,经AI-MPDA孵育后,143B细胞的IR780红色荧光显著增强,说明IR780标记的纳米颗粒很多被143B细胞内化。这可能是因为MPDA的儿茶酚基团会增强细胞对纳米颗粒的摄取[24]。此外,AI-MPDA+NIR组的红色荧光最明显,说明近红外激光照射增强了细胞对AI-MPDA的摄取。这可能是由于激光照射下MPDA产生的高温对细胞膜造成了轻微损伤,增强了细胞摄取效应[25]。
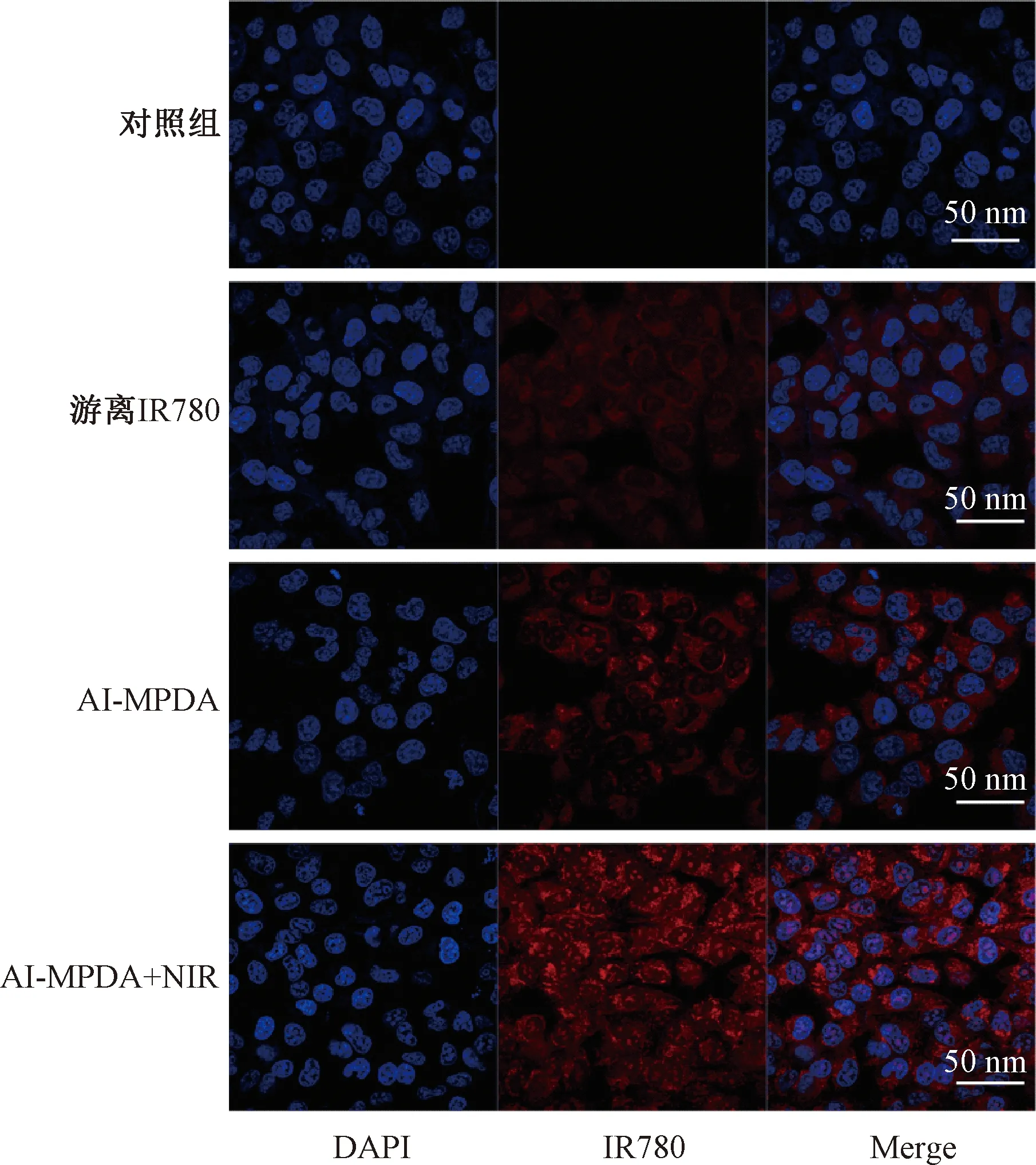
图9 143B细胞的倒置荧光显微图像Fig.9 Inverted fluorescence microscopic image of 143B cell
2.3 ROS的体外生成
以DCFH为探针,通过倒置荧光显微镜检测细胞内的ROS含量,以评估AI-MPDA在细胞内的ROS生成情况,结果如图10所示。由图10可知,与游离IR780共孵育4 h后,在143B细胞中只观察到微弱的荧光,与细胞摄取的结果一致。这是因为细胞对游离IR780的摄取较少。I-MPDA在激光照射下的荧光强度明显强于AI-MPDA,这是由于在L-Arg参与的NO生成反应中消耗了ROS。
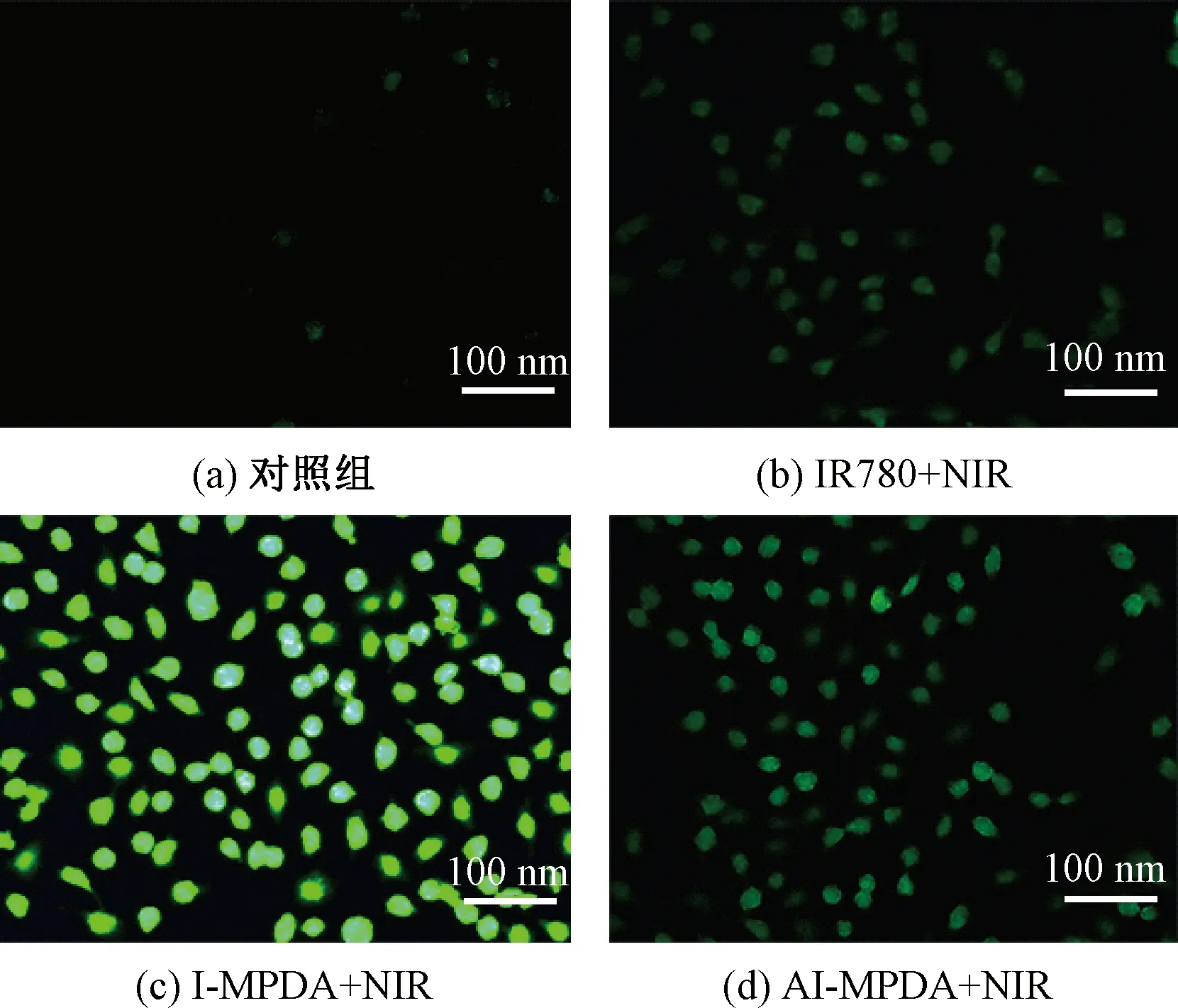
图10 143B细胞的DCFH荧光显微图像Fig.10 DCFH fluorescence microscopic image of 143B cell
2.4 NO气体的体外生成
以DAF-FM DA为荧光探针,通过倒置荧光显微镜检测细胞内的NO含量,评估AI-MPDA在细胞内的NO生成情况,结果如图11所示。由图11可知,经AI-MPDA+NIR治疗后,细胞中的荧光强度最强,表明AI-MPDA在细胞内的NO释放效率最高。值得注意的是,用还原剂Vc清除PDT效应产生的ROS后,细胞中的荧光强度明显减弱。这表明细胞中的NO是通过转化ROS产生的。该结论与AI-MPDA组的ROS结果相一致。
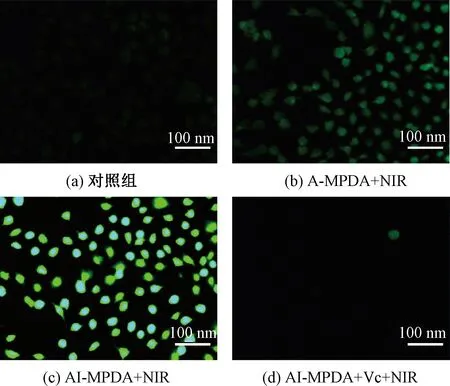
图11 143B的DAF-FM DA荧光显微图像Fig.11 DAF-FM DA fluorescence microscopic image of 143B
3 结 语
采用模板法制备介孔聚多巴胺纳米载体颗粒,并负载L-Arg和IR780,构建了精氨酸-IR780-聚多巴胺纳米颗粒。透射电子显微图像和比表面积分析表明,该纳米复合物具有较规则的形貌和较大的比表面积。体外细胞试验表明,介孔聚多巴胺纳米载体可以被143B肿瘤细胞摄取,并能通过将活性氧转化为NO实现NO气体的肿瘤原位释放,是一种具有潜力的纳米递送系统。

