基于原发癌灶T2WI的影像组学特征预测局部进展期直肠癌新辅助治疗疗效及多种分类器效能比较
胡鸿博,赵升,姜昊,姜慧杰*,蔺雪,张莹
0 前言
有文献报道,13.0%~22.2%接受新辅助放化疗(neoadjuvant chemoradiotherapy, nCRT)的局部进展期直肠癌(locally advanced rectal cancer,LARC)患者可以获得病理完全缓解(pathological complete response, pCR)[1]。对于在根治性手术前已经达到pCR 的患者,因其局部无肿瘤细胞残留,故可以在严格随访下采取“观察等待”的治疗策略,从而避免根治性手术带来的吻合口漏、永久性造口、排尿障碍、性功能障碍等风险[2-3]。因此,直肠癌新辅助治疗后pCR 相关因素的探究及精准预测则成为近年来直肠癌领域研究的热门话题。目前CT 或MRI影像学检查结果是新辅助治疗效果判断的重要依据[2,4-5]。
近年来,影像组学已经发表了大量的研究,其目的是通过从肿瘤图像中提取可挖掘的数据来量化肿瘤的异质性[6-7]。先前的影像组学研究表明,从不同医学图像中提取的图像特征可以预测直肠癌患者的nCRT 反应[1,8-9]。基于对影像特征的研究,大量的机器学习算法被应用于影像特征的选择和分类。作为一种新方法,机器学习在皮肤、头颈部和结直肠癌等不同的放射研究中显示出巨大的潜力[10-11]。目前已经有研究者将机器学习及深度学习应用在LARC的化疗敏感性的预测上[1-2],但是还没有研究比较不同的机器学习方法(包括CNN、NN、SVM、NB)的效能。这对于未来临床上选择精准的模型是一个缺陷。机器学习根据研究变量类型的不同,通常分为分类和回归的研究,在本研究中,我们利用不同的机器学习算法提取直肠MRI放射特征,构建影像组学模型预测LARC治疗疗效,我们旨在比较不同的个体机器学习算法构建的影像组学模型预测效能,以找到最佳的预测模型,为临床上根据影像水平制订LARC 治疗方案提供重要基础。
1 材料与方法
1.1 研究对象
本研究为回顾性研究,遵守《赫尔辛基宣言》,并经哈尔滨医科大学伦理委员会审核通过,免除受试者知情同意,伦理批文号:sydwgzx2020-094。对2021 年9 月至2023 年1 月在我院确诊为直肠癌的患者病例资料进行回顾性分析。纳入标准:(1)经结肠镜活检确诊的直肠癌患者;(2)治疗前经影像学检查诊断为LARC 的患者;(3)手术治疗前接受nCRT 治疗。排除标准:(1)在nCRT之前接受其他抗肿瘤治疗的患者;(2)临床数据不完整;(3)图像不清晰,影响分析结果;(4)患者有其他并发症者;(5)特殊类型的直肠癌、黏液腺癌排除。
1.2 MRI图像采集
所有患者均接受直肠MRI扫描,为患者佩戴隔音耳塞,避免对听力造成不必要的损坏。为了避免金属伪影的干扰,叮嘱患者将所有金属物品移除,包括内衣上的金属物,尽量保证图像不受外界因素干扰。
使用3.0 T GE Discovery MR 750w MRI 仪扫描,相控阵体部线圈采集图像。扫描序列及参数详见表1。

表1 MRI序列及参数Tab.1 Summary of MRI sequences and parameters
1.3 nCRT方案
对所有患者进行了5周的调强的放射治疗,并伴有每天口服卡培他滨(1650 mg/m2)的同步化疗。所有患者均在CT模拟器上进行了模拟。两名专门从事临床肿瘤学和放射治疗的物理学家与一名具有10年工作经验的正高职称放射科医生一起参与了目标区域的划分。使用临床检查、结肠镜检查、骨盆MRI 和CT 检查的所有信息定义总肿瘤体积。总肿瘤体积覆盖了直肠病变和任何可疑的转移性淋巴结。对于低位直肠肿瘤,临床靶区还包括坐骨神经直肠窝,以涵盖阴部和直肠下结。计划靶区被定义为超出临床靶区范围1.0 cm,局限性处于危险中的器官如下:膀胱V50≤50%;小肠V20≤50%;Dmax≤50 Gy;双侧股骨头V50≤5%。化疗方案使用卡培他滨(放疗期间每天两次,两次800 mg/m2)。所有患者接受nCRT 后采取全直肠系膜切除术。
1.4 评价标准
术后标本由高年资病理科医师取材、核片。根据肿瘤退缩分级(tumor regression grading, TRG)进行评分:TRG 0为无退缩发生;TRG 1为肿瘤组织基本未发生形态学改变;TRG 2为中度退缩;TRG 3为明显退缩;TRG 4 为完全退缩。根据TRG 将nCRT 后的LARC患者分为pCR组和non-pCR组[12]。
1.5 图像选取和特征提取
将上述高分辨T2WI 原始的DICOM 格式图像导入后处理平台(Radcloud,大数据智能分析云平台,慧影医疗科技有限公司,北京)。对图像进行标准化预处理,采用Z-score标准化方法先计算出原始图像的像素矩阵的均值和标准差,然后再进行数据的标准化。两名具有5年以上经验的影像科医师采用手动方式在T2WI 图像上共同沿病变边缘逐层勾画全部病灶的感兴趣区(region of interest, ROI),计算机自动生成病灶的三维容积感兴趣区(volume of interest,VOI)。使用上述获取到的ROI 自动提取影像组学特征,包含两类特征。(1)基于特征类:①一阶统计量特征,如峰值、均值、方差等;②形状特征;③纹理特征,包括灰度共生矩阵、灰度游程矩阵、灰度区域大小矩阵和领域灰度差分矩阵,可以量化所选区域的异质性。(2)基于过滤器类:对图像进行指数滤波变换、平方滤波变换、平方根滤波变换、对数滤波变换、局部二进制模式和小波变换等多种滤波器变换后的特征。总计提取了1409个影像组学特征。
1.6 特征选择及模型构建
采用最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)算法进行特征值降维,选择出对鉴别新辅助治疗疗效有价值的特征。将筛选得到的9个影像组学特征及其相应的回归系数加权线性组合,构建影像组学标签。影像组学评分(radiomics score, Radscore)是根据模型计算的评分,反映每位患者影像组学综合结果,Radscore=∑Ni= 1ωi·xi+β,其中N 为特征的数量,ωi是第i 个特征的权重,xi是第i个特征的值,β为偏置项[1]。
1.7 分析流程
将纳入研究的160 例病例按照8∶2 比例随机分为训练集及验证集。使用Python scikit-learn 统计建模。首先对纹理特征参数筛选,行正态检验(Kolmogorov-Smirnov检验)和方差齐性检验(Bartlett检验)。对于连续变量采用t检验,用Fisher 精确检验或卡方检验比较组间分类变量。特征子集的选择、机器学习算法模型的创建以及二次采样检验,通过此过程建立预测模型使其能够对LARC nCRT疗效进行有效的预测。对于每一个机器学习组合,使用交叉验证在训练集中训练模型,计算受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve, AUC)、准确率、特异度和敏感度。
1.8 多变量回归模型构建
将患者病例根据化疗效果分类标准分为non-pCR和pCR两组,分别使用四个单独的分类器:支持向量机(support vector machines, SVM)、朴素贝叶斯(naive Bayes, NB)、神经网络(neural network,NN)、卷积神经网络(convolutional neural networks,CNN)(表2)。所有分类均用SPSS软件包进行,预测性能评估使用AUC评估,验证集图像信息用于模型验证。

表2 患者分组及基线资料统计Tab.2 Patient grouping and baseline data statistics
1.9 统计学分析
使用SPSS 22.0 软件对预测结果进行统计学分析。以病理结果为金标准,绘制ROC曲线,并计算AUC值,从而评估模型预测效能,在训练集中采用阳性预测值、阴性预测值、准确度、F1 值、AUC 值及DeLong 检验评估4种模型的预测性能,所有指标的结果均以均值及其95%CI表示。对于训练集和验证集,利用t检验评估两组成像参数的差异。P<0.05 认为差异具有统计学意义。
2 结果
2.1 纳入病例基线数据
本研究最终选取符合标准的160 例LARC 患者的数据,其中男83 例,女77 例,年龄(62.4±15.5)岁。按照8∶2 的比例分为了训练集(128 例)及验证集(32 例)。训练集中反应良好82 例,反应不良46 例,验证集中反应良好21 例,反应不良11 例。患者组间基线资料差异均无统计学意义(P>0.05)。纳入病例临床特征详见表2。
2.2 组学特征筛选
将影像组学特征中提取得到的1409个组学特征采用LASSO 算法进行特征值降维(图1A、1B),共筛选得到9 个系数不为零的特征纳入后续分析。图1C 为最终优化的特征子集及其对应的权重系数示意图。
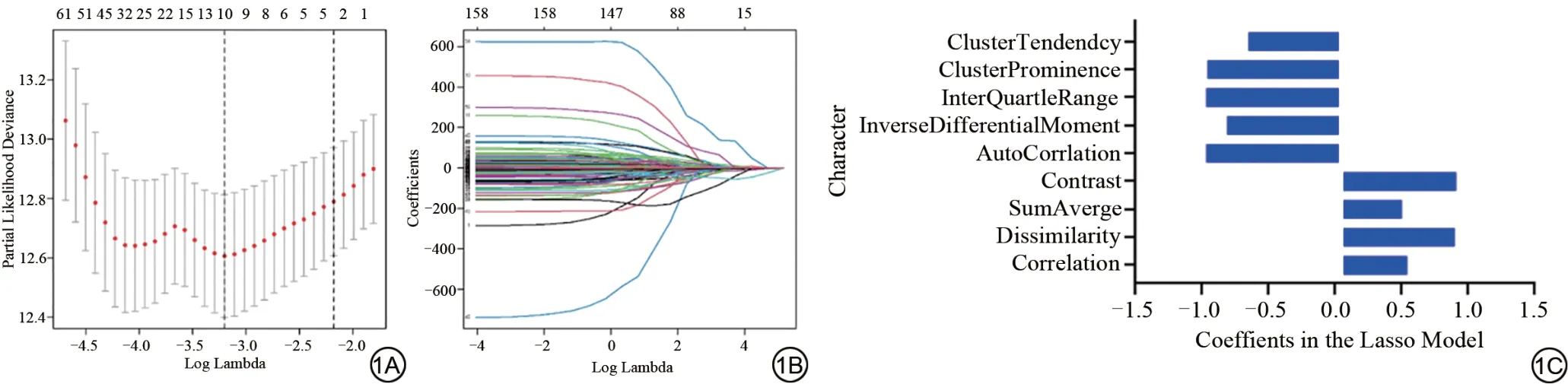
图1 LASSO筛选与新辅助放化疗治疗相关的组学特征。1A:通过五折交叉验证寻找最优的超参数λ值使模型偏差最小;1B:不同纹理特征系数随λ变化的关系图;1C:筛选得到的特征中LASSO 系数值,其中特征值包括相异度(Dissimilarity)、灰度特征平均值(SumAverge)、对比度(Contrast)、反差分矩阵(InverseDifferentialMoment),内矩(InterQuartleRange)、集群突出物(ClusterProminence)、集群趋势(ClusterTendency)。LASSO:最小绝对收缩和选择算子。Fig.1 The histological characteristics related to LASSO screening and neoadjuvant chemoradiotherapy treatment.1A: Searching for the optimal hyperparameter through 5-fold cross validation λ, the value minimizes the model deviation; 1B: The variation of different texture feature coefficients with λ a graph of changes; 1C:The LASSO coefficient values among the selected features, including Dissimilarity, SumAverge, Contrast, InverseDifferentialMoment, InterQuartleRange,ClusterProminence, ClusterTendency.LASSO: least absolute shrinkage and selection operator.
2.3 特征值与nCRT效果相关程度评估
通过LASSO降维后得到的9个组学特征与nCRT反应高度相关。分别为:相关性(Correlation),反映了局部灰度相关性;相异度(Dissimilarity),反映灰度差异性;灰度特征平均值(SumAverge)、对比度(Contrast),反映像素间灰度值差别;反差分矩阵(Inverse Differential Moment, IDM),反映纹理的清晰程度和规则程度;内矩(InterQuartleRange),指两个四分位数之差;集群突出物(ClusterProminence),指图像中纹路与纹案反差;集群趋势(ClusterTendency),指具有相似灰度值的体素分组的度量。基于这些特征利用进入法logisitc模型分别对nCRT 治疗效果进行评估,其诊断性能如图2 所示:AutoCorriation 具有最高的诊断性能,AUC=0.70;其他特征诊断性能分别为InterQuartleRange的AUC=0.66、CluterTendendcy 的AUC=0.63、IDM 的AUC=0.62、SumAverge的AUC=0.62。
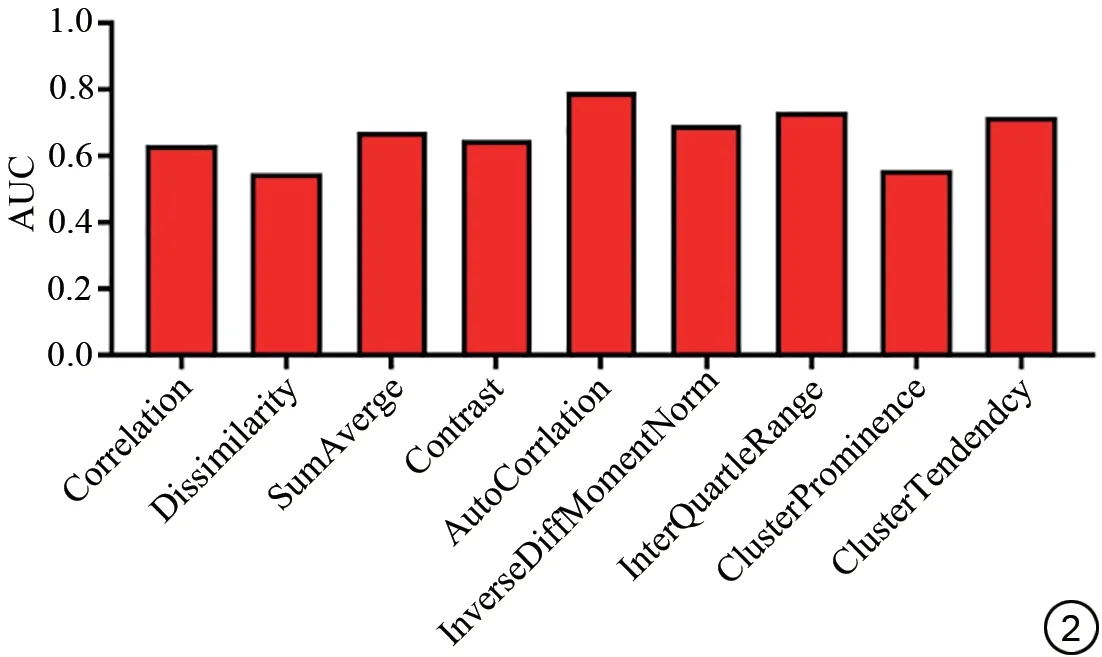
图2 与新辅助放化疗相关的特征诊断效能评估。AUC:曲线下面积。Fig.2 Evaluation of feature diagnosis effectiveness related to neoadjuvant chemoradiotherapy.AUC: area under the curve.
2.4 pCR和non-pCR组特征值结果比较
经过LASSO 算法共筛选出9 个与化疗效果相关的特征,包括一阶统计特征,灰度共生矩阵特征等。对比每个特征在pCR 和non-pCR 组间的差异发现,虽然两组之间的特征存在差异,但差异不具有统计学意义(P>0.05)(图3)。

图3 与新辅助放化疗(nCRT)相关的特征在病理非完全缓解(non-pCR)和病理完全缓解(pCR)组中的差异分析,纵坐标为相关性值。Fig.3 Differences in features related to neoadjuvant chemoradiotherapy (nCRT) in non-pathological complete response(non-pCR) and pathological complete response (pCR) groups.The vertical axis is the relevant statistical value.
2.5 分类器预测表现
CNN、NB、NN、SVM 四种分类器训练集和验证集的ROC 曲线见图4。四种分类器训练集的AUC 分别为0.8735、0.7834、0.9038、0.9150,验证集的AUC 分别为0.8020、0.7790、0.5900、0.7330。其中SVM分类器在训练集的AUC 为0.9150,敏感度为73.6%,特异度为75.3%,95%CI为0.695~0.995(表3),较其他三种模型有更好的诊断效能。不同分类器模型组间DeLong检验结果显示,SVM分类器与其他的分类器有显著性差异(P均<0.05)。
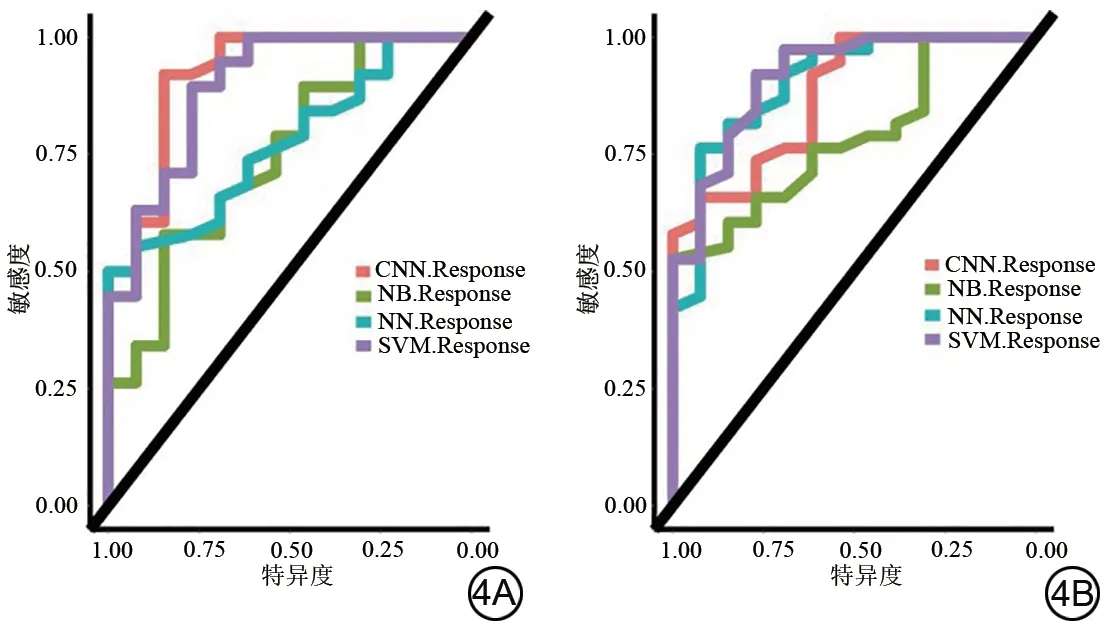
图4 四种不同分类器方法对新辅助放化疗响应诊断效能比较。CNN:卷积神经网络;NB:朴素贝叶斯;NN:神经网络;SVM:支持向量机。Fig.4 Comparison of the diagnostic performance of four different classifier methods for neoadjuvant chemoradiotherapy response.CNN:convolutional neural networks; NB: naive Bayes; NN: neural network;SVM: support vector machines.

表3 训练集及验证集的AUC值Tab.3 The AUC of each classifier in training set and validation set
3 讨论
在本研究中,我们分析了影像组学特征与LARC nCRT疗效之间的相关性,发现2个灰度尺寸区域矩阵特征,4个邻域灰度差分矩阵特征,2个灰度依赖矩阵特征,1个灰度共生矩阵特征与LARC的nCRT疗效具有相关性。根据这些纹理特征的定义,邻域灰度差分矩特征描述的是同质性区域的特征,可以量化图像中的灰度级区域,与肿瘤组织侵犯高度相关,说明在局部尺度上反映了肿瘤的特性。灰度尺寸区域矩阵是可以描述图像亮度的二变量条件概率密度,对肿瘤边界具有很好的区分潜能。灰度依赖矩阵可以对图像进行分隔和识别,对肿瘤识别具有重要意义。灰度共生矩阵不仅反映亮度的分布特征,也反映具有同样亮度或接近亮度的像素之间的位置分布特性,可以对肿瘤内细小的灰阶变化做出敏感的应答。不同于传统机器研究方法,我们使用灰度共生矩阵纹理特征取得最佳的病理反应预测效能。并且使用LASSO对特征进行进一步筛选,选取了9个特征,全部来自灰度共生矩阵纹理特征。这使得最终纳入研究的变量具有更加强的鲁棒性。可辅助临床制订更加精准的治疗策略。
3.1 影像组学预测LARC治疗效果应用
现今,影像组学对直肠癌的研究成为热点,国内外很多学者把目光都聚焦在肿瘤纹理特征的提取、直肠良恶性病变的鉴别、直肠癌术前的评估、直肠癌淋巴结转移的认定[13-17]。SONG等[18]利用148个直肠病例的纹理分析对直肠良恶性病变进行鉴别,得到了很高的敏感性及特异性。另外还有学者利用LASSO模型直肠癌患者术前影像资料进行特征分析,获得的组学特征可以区分早期直肠癌与进展期直肠癌,得到的AUC值十分理想,说明了影像组学可以有助于直肠癌的术前分期[19-21]。除了上述对肿瘤分期的预测,也有研究聚焦在预测nCRT 响应效率上。这对于制订个体化的治疗方案尤其重要。YI等[22]通过SVM分类器建立了预测pCR的MRI影像组学模型,AUC值达到0.91。揭示了影像组学模型在预测pCR中的价值。此外,既往研究中往往只使用一种分类器来进行建模,而对性能表现最佳的分类器没有共识,为了评估不同分类器的预测性能,本研究利用不同的机器学习算法提取直肠MRI放射特征,构建影像组学模型预测LARC治疗疗效,发现SVM、NB、NN、CNN 分类器模型可以对直肠癌nCRT疗效进行评估,其中SVM分类器模型诊断效能最佳。本研究的结果与DEIST 等[23]的研究并不一致,该研究收集了不同肿瘤治疗部位的12个数据集,并比较了不同分类器的预测能力。他们发现,随机森林(random forest, RF)分类器在识别放化疗结果比其他分类器具有更高的性能。这可能是由于建模所用患者人种不同,也可能与所纳入模型的特征不同有关,总之本研究的结果提示在不同的样本中,分类器的效能可能会有所差别。未来可以通过纳入更多中心的样本来进一步评估,也可以通过荟萃分析进行整体的评估。本研究为明确分类器效能提供了重要的数据基础。对比NIE等[24]从T1/T2WI、DWI和DCE-MR图像中提取的放射特征可以增强术前nCRT对LARC病理反应的预测能力,本研究更能具体体现不同的特征在直肠癌治疗效果评估方面的价值。
3.2 不同机器学习构建影像组学模型的比较
周彦汝等[25]研究构建了3 种机器学习模型:RF、SVM、逻辑回归(logistic regression, LR),在预测LARC nCRT 治疗后pCR 方面有可观的准确率,其中采用LR方法建立的机器学习模型较其他机器学习模型诊断效能更高,有潜力应用于临床实践。说明不同模型在预测效能上具有一定差别。梁纳[26]的研究中证实基于治疗前MRI T2WI序列的影像组学研究在治疗前对LARC nCRT敏感性的预测有一定参考价值,对临床医师治疗前筛选适合放化疗的患者有一定帮助。在刘恩瑞[27]的研究中证实影像组学对新辅助治疗的病理反应有较准确的预测作用,其中RF 算法表现最好,预测精度最优。与机器学习的相似的模型还有深度学习,所用的数据量更大,LIU 等[28]的多中心研究表明深度学习在区别LARC 化疗敏感度的AUC值为0.747。其他通过深度学习构建模型的研究AUC值也均在0.7左右[29-30]。这表明机器学习的区别效能不弱于深度学习,具有临床参考价值。本研究首次基于多种MRI 机器学习方法来预测直肠癌nCRT 反应,并证明了这些方法在预测治疗反应方面的有效性。本研究结果显示,所有机器方法AUC均超过70%;还发现在单个方法中,SVM是预测最佳模型。
3.3 本研究的局限性
本研究同样存在局限性,主要反映在以下几个方面:第一,本研究中ROI的分割采用手动勾画,很难避免误差的产生,同时掺杂了主观因素的影响,如果是半自动或者自动分割可能效果更好,自动分割更适合大规模的数据处理;第二,我们的影像组学研究部分对图像的分割处理没有进行一致性检验,其准确性可能受到影响,分割方法的自动化可能是未来的热点方向;第三,本研究病例数较少且分布欠均匀,没有包括未行手术治疗、无病理结果的患者;第四,为了尽量避免偏差,本研究都为同一所医院,使用同样的设备进行采集,但是这样可能会存在缺少多中心病例的数据,不能反映疾病的整体性及普遍性的问题,今后可以加入多中心影像组学特征提取的研究,从而进一步进行外部验证;第五,影像组学部分的研究特征提取,并没有结合临床的实验室检查指标,如CA125、CA199等指标,可以在今后的研究中进行补充。
4 结论
综上所述,基于治疗前MRI 影像组学方法预测LARC患者nCRT后pCR有一定的价值,在不同的机器学习建模方法中,SVM 分类器的效能最佳。为临床治疗决策提供更充足的依据,随着精准医疗和大数据时代的来临,相信我们可以利用影像组学为个性化的临床决策提供方案,可以为临床治疗提供新的思路。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:姜慧杰设计本研究的方案,对稿件重要内容进行了修改,获得了国家自然科学基金面上项目资助;胡鸿博起草和撰写稿件,获取、分析或解释本研究的数据;赵升,姜昊,蔺雪,张莹获取、分析或解释本研究的数据,对稿件重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

