肿瘤治疗相关神经系统并发症的MRI特征
何嘉琦,廖伟华,2*
0 前言
近年来,肿瘤的治疗方法和模式越来越多样化,随着这些治疗手段的兴起,患者的生存期也不断延长,同时,与肿瘤治疗相关的并发症也开始被广泛报道。各种肿瘤治疗方法都不可避免地会对神经系统产生不同程度的毒性作用,极大地降低了肿瘤长期生存患者的生存质量。
肿瘤治疗相关的神经系统并发症的发病时间跨度很大,可发生在肿瘤治疗后短期内,也可在肿瘤治疗数年甚至数十年后发生,且中枢神经系统和周围神经系统均可受累,对神经系统的影响从早期可逆性的功能改变逐步进展为晚期不可逆性的结构改变,所以,早诊断、尽早进行治疗方案的调整是减少神经系统损伤,提高患者生活质量最有效的方法。
MRI 作为一种非侵入性的检查手段,能从结构和功能层面诊断和评估神经系统的病理改变,为诊断肿瘤治疗相关的神经系统并发症提供客观证据,从而指导患者的管理和治疗。
本文对当前肿瘤治疗的常用手段(包括化学治疗、放射治疗以及免疫治疗)可能导致的中枢和周围神经系统并发症及其相应的MRI特征进行综述,并展望未来MRI 检查在肿瘤治疗相关的神经系统并发症的早期诊断中的重要价值,为以后的临床以及科研工作提供参考。
1 化学治疗
化学治疗所产生的神经毒性可影响周围神经系统和中枢神经系统。
1.1 化疗相关性周围神经病变
化疗相关性周围神经病变(chemotherapy-induced peripheral neuropathy, CIPN)是最常见的周围神经系统并发症,大约30%~40%的化疗后患者将出现CIPN[1],不同个体的症状常有差异,主要为自主神经功能异常及感觉异常,一般来说运动神经及颅神经受累较轻,MRI检查能够评估CIPN的病理改变主要包括:(1)背根神经节(dorsal root ganglia, DRG)以及轴突的损伤和凋亡;(2)周围神经症状引发的大脑适应性反应。
大多数感觉相关体征和症状来自DRG或其轴突的损伤[1],表现为DRG体积的肥大,且DRG体积的增大程度与化疗药物的给药剂量呈正相关。已有研究者使用磁共振神经成像 (magnetic resonance neurography,MRN)及电子计算机断层扫描(computed tomography,CT)测量DRG的体积,在使用MRN对DRG进行形态学评价时发现CIPN 患者平均DRG 体积增加25%(L5)~56%(L4),而在使用CT测量DRG体积时显示出与MRN测量结果的中等相关性[2-3],这使得使用影像学方法定量评估DRG 的体积从而评估CIPN 发生的可能性及其严重程度成为可能。
扩散张量成像(diffusion tensor imaging,DTI)因其能够利用水分子的运动来揭示神经微结构和功能以及能够提供有关纤维轨迹信息的特点,已开始用于周围神经系统疾病的评估[4]。已有研究发现经紫杉烷治疗前后患者的胫神经在小腿中部和踝关节两处的各向异性分数(fractional anisotropy,FA)有显著的降低,这一结果与化疗能够对轴突造成损伤的结果一致[5]。
大脑作为神经系统的中心所在,在CIPN 发病时也会出现一些结构和功能的改变[6]。有研究发现治疗后短期内CIPN 患者能检测到双侧额上回、扣带回以及左侧额中回与额内侧回的脑灌注和灰质密度的升高,且升高的程度与症状的严重程度呈正相关[7]。这就给现如今CIPN以量表为主的主观诊断方法提供了可靠的功能MRI客观诊断。
常规MRI 检查方法在周围神经病变的检测中具有一定的局限性,而随着MRI设备分辨率的不断提高及检查方法的不断更新,越来越多的研究通过直接和间接的方法发现了CIPN 的影像学标志物,从而使得诊断CIPN 并对其严重程度进行评估具有可行性。然而由于周围神经DTI等检查技术要求较高,目前仍停留在临床研究阶段,需要进一步技术优化以提供临床应用推广。
1.2 化疗相关的中枢神经病变
化疗所致的常见中枢神经系统并发症主要包括:急性白质脑病、后部可逆性脑病综合征(posterior reversible encephalopathy syndrome,PRES)、脊髓病[8]。不同化疗药物所致的并发症不全相同,且同种化疗药物也可能导致多种并发症的出现。
急性白质脑病的症状从轻度认知功能障碍到重度痴呆、癫痫、共济失调、轻偏瘫甚至死亡,主要与化疗药物的代谢产物部分通过血脑屏障导致髓鞘水肿相关[9]。MRI特征为双侧大脑深部白质纤维束走行区域对称的扩散受限改变,液体衰减反转恢复(fluid attenuated inversion recovery, FLAIR)序列上呈高信号(图1),病变部位表现为高灌注,其中,扩散加权成像(diffusion-weighted imaging, DWI)、FLAIR信号强度及表观扩散系数(apparent diffusion coeffecient, ADC)降低的百分比与白质脑病的预后相关[10-13]。在少数情况下,急性白质脑病可发展为坏死性白质脑病,这种改变是化疗药物导致的神经元凝固性坏死,为不可逆改变,MRI 上表现为出现在T2WI 高信号区域内的强化灶[8]。通常情况下患者的临床和影像学异常表现会在停用化疗药物后出现显著改善,甚至完全消失,且目前暂无研究表明再次引入同种化疗药物急性白质脑病会重复出现[14]。在行免疫治疗后急性白质脑病亦可发生,两者的临床和影像表现基本相同,但免疫治疗相关的急性白质脑病较化疗相关性急性白质脑病在停药后有着更佳的预后。
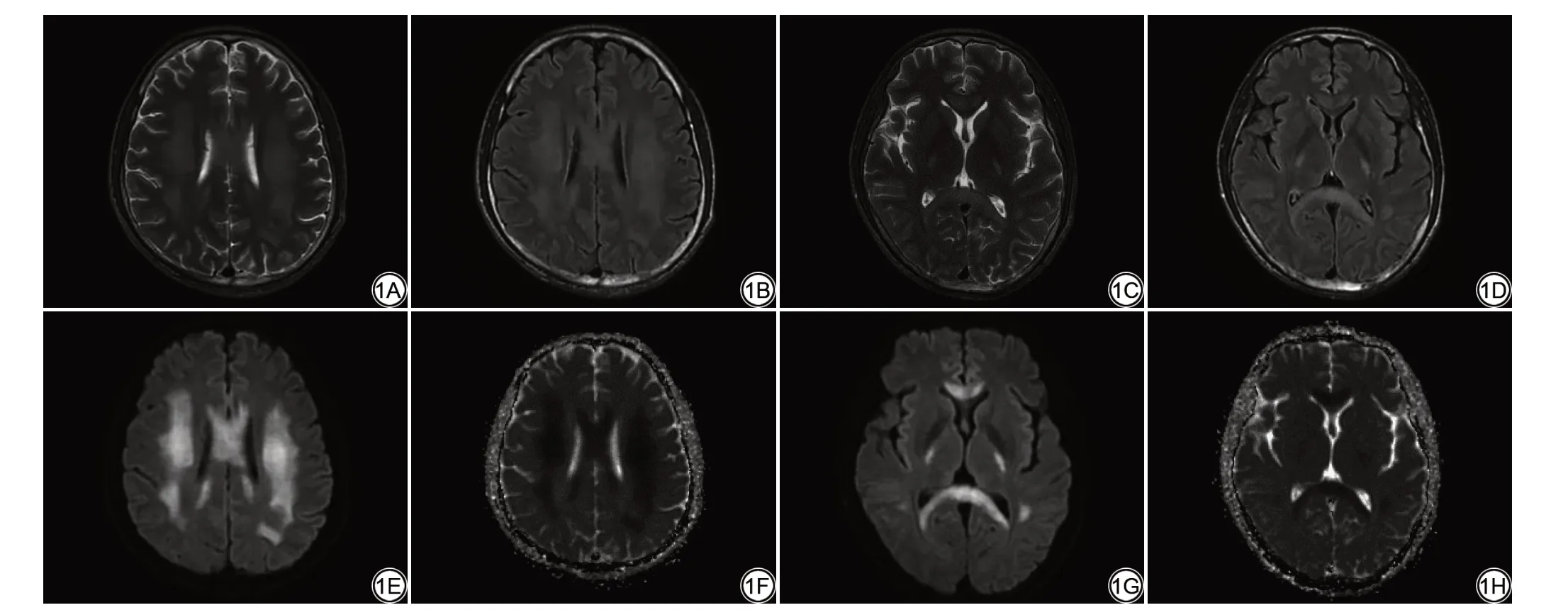
图1 男,38岁,乙状结肠癌患者,第一周期化疗(方案:XERLOX)开始后一周突发全身抽搐,双眼向上凝视,言语不能。颅脑MRI提示双侧对称的沿白质纤维束走行的T2WI及液体衰减反转恢复序列高信号(1A~1D)并扩散受限(1E~1H)(图源:中南大学湘雅医院影像归档和通信系统)。Fig.1 Male, 38 years old, patient of sigmoid colon carcinoma, suddenly presented a general convulsion one week after the onset of treatment (Regimen:XERLOX), with eyes staring upward and speech inability.MRI shows bilateral and symmetric high signal intensities on T2WI and fluid attenuated inversion recovery sequence (1A-1D), and restricted diffusion (1E-1H) along the fibre tracts of the white matter (Source: Image archiving and communication system of Xiangya Hospital of Central South University).
后部可逆性脑病综合征(posterior reversible encephalopathy syndrome, PRES)是一种临床影像学综合征,典型症状包括头痛、呕吐、意识模糊、癫痫发作和视力异常等[15]。其机制主要为化疗药物导致的脑血管自身调节机制紊乱或内皮功能障碍所导致的血管源性脑水肿及化疗药物本身导致的细胞毒性脑水肿,后循环由于缺乏交感神经的支配而更易受累[16]。其MRI 特征为大脑半球后部区域(顶、枕叶等)局灶性的T2WI 及FLAIR 高信号[17](图2),病变主要累及皮层及皮层下脑白质,少数情况下也可累及深部白质[18]。PRES 的发病部位被描述为三种放射学模式:顶-枕模式(病变分布在大脑后部区域)、分水岭分布模式(病变主要涉及大脑前动脉和大脑中动脉支配区域的分水岭区)以及非典型分布模式(包括小脑和脑干在内的其他区域)[19]。目前,PRES 病变区域的灌注情况仍存在争议,一项使用动脉自旋标记(arterial spin labeling, ASL)对PRES 脑灌注改变的研究发现,在FLAIR信号异常即血管源性脑水肿出现之前就已可出现过度灌注的表现,且过度灌注恢复正常先于FLAIR 异常信号消失[20]。扩散受限提示严重血管源性水肿已发展到不可逆的细胞毒性水肿,此情况通常与预后不良相关[21]。通常,在停用化疗药物后,脑部的异常信号能完全恢复正常。

图2 女,10岁,骨肉瘤患者,第二疗程化疗(API方案)的第4天出现头痛、呕吐、烦躁、颜面部和四肢抽搐、意识障碍。颅脑MRI提示左侧顶叶片状T2WI和液体衰减反转恢复序列高信号(2A~2B),无明显强化(2C)。2个月后复查颅脑MRI显示原有病灶消失(2C~2D)(图源:中南大学湘雅医院影像归档和通信系统)。Fig.2 Female, 10 years old, patient of osteosarcoma, presented with headache, vomiting, irritability, facial and limb convulsions, consciousness disorder on the fourth day of the second cycle of chemotherapy (Regimen: API).MRI shows the signal intensities on T2WI and fluid attenuated inversion recovery sequence(2A-2B) without enhancement (2C).A follow-up MRI 2 months later suggests that the original lesion disappeared (2C-2D) (Source: Image archiving and communication system of Xiangya Hospital of Central South University).
脊髓病主要与鞘内注射化疗药物相关,病变发展从脊髓侧索和后索的空泡变性到脊髓的横贯性损伤不等[22],症状主要为与脊髓病变平面一致的感觉和运动的异常,并最终发展为截瘫[23],此类患者通常需要进行脑脊液检查以排除肿瘤细胞对脊髓的侵犯。MRI 检查早期不会出现脊髓内的异常信号,随后矢状位图像上出现长节段脊髓内的T2WI高信号以及脊髓肿胀,轴位示脊髓后索受累为主,增强后部分可有强化[23-26]。鞘内注射化疗药物还与姑息性放疗时导致的脊髓变性剂量阈值的降低相关,其将增大发生脊髓病变的可能性[26]。
化学治疗相关的中枢神经系统并发症通常在停用化疗药物后可逆,因此,当出现相关临床症状时,推荐患者行MRI检查以明确并发症存在与否,并指导临床尽早进行治疗方案的调整。
2 放射治疗
放射治疗已广泛用于头颈部原发及转移肿瘤的治疗,约有33%的患者在放射治疗后会发生神经系统并发症。放射治疗诱导的神经系统并发症主要累及中枢神经系统,周围神经系统受累则较为少见。根据出现的时间,此类并发症可分为急性(放疗后数天或数周内发生)、早迟发型(放疗1~4个月后发生)和晚迟发型(放疗6个月后发生)[27],通常急性和早迟发型主要以神经功能改变为主,在常规MRI检查中通常为阴性表现,晚迟发型则会出现相应的MRI检查阳性表现,主要包括脑白质病、放射性坏死、脑血管并发症和放疗后卒中样偏头痛发作(stroke-like migraine attacks after radiation therapy, SMART)综合征。
2.1 脑白质病
放疗后脑白质的病变和脑白质体积的减小通常与智力和认知功能的降低相关,其产生原因包括血管损害、脱髓鞘和直接神经元损伤[28-29]。MRI 表现为进行性发展的脑白质异常信号,病灶自放射野向其他脑叶或沿侧脑室向对侧脑组织延伸,随后逐渐融合,表现为脑室周围白质的对称性FLAIR 高信号,病变部脑组织可有萎缩,晚期通常会发展为广泛的交通性脑积水和脑萎缩,皮层下的U型纤维、颅后窝、基底神经节和内囊通常不受累。已有研究发现,放疗时使用海马回避能够明显降低认知障碍的发生[27,29-30]。
2.2 放射性坏死
放射性坏死是由于放疗后照射野内脑组织血管内皮的损伤和组织的凝固性坏死从而出现影像上类似肿瘤进展的表现,影像表现为照射野增强扫描后“肥皂泡样”“瑞士奶酪样”强化灶,以及强化灶周围T2WI高信号水肿带[29],传统的结构MRI上几乎无法与肿瘤进展进行鉴别,而当行磁共振灌注成像检查时,坏死区域由于血管分布减少和血管通透性增加,表现为较低的相对脑血容量(relative cerebral blood volume, rCBV)和较高的信号强度恢复百分比(percentage signal intensity recovery, PSR),且PSR 的敏感性比rCBV 更高[31]。在磁共振波谱分析(magnetic resonance spectroscopy, MRS)中,与肿瘤进展相比,放射性坏死灶内N-乙酰天门冬氨酸(N-acetyl aspartate, NAA)峰、肌 酸(creatine,Cr)峰及胆碱(choline, Cho)峰值均降低,并表现出相对较低的Cho/Cr和相对较高的Cho/NAA,脂质峰和乳酸峰在两者均可出现[32](图3)。

图3 女,38岁,胶质母细胞瘤患者,术后放疗。复查颅脑MRI发现术区边缘强化灶(3A,箭),强化区域相对脑血容量减低(3B,箭),磁共振波谱分析提示病变区域(3C)较正常脑组织(3D)诸峰值均有减低,以及较低的NAA/Cr比值和较高的Cho/Cr比值。随后多次复查术区旁强化灶及周围水肿带无明显变化,最终诊断为放射性坏死(图源:中南大学湘雅医院影像归档和通信系统)。NAA:N-乙酰天门冬氨酸;Cr:肌酸;Cho:胆碱。Fig.3 Female, 38 years old, patient of glioblastoma, accepted radiotherapy after surgery.A follow-up MRI shows a newly enhancement at the edge of surgical area(3A, arrow), with a lower relative cerebral blood volume (3B, arrow).Magnetic resonance spectroscopy shows the lesion (3C) has a decrease in height of all peaks,lower NAA/Cr and higher Cho/Cr comparing with the healthy region (3D).After several follow-up examinations indicated a stable lesion, she was final diagnosed as radiation necrosis (Source: Image archiving and communication system of Xiangya Hospital of Central South University).NAA: N-acetyl aspartate; Cr: Creatine;Cho: Choline.
有研究发现,在使用放射治疗联合PD-1 抑制剂治疗黑色素瘤脑转移的患者时,其放射性坏死的发生率是单纯放射治疗的2.4倍,这可能与放射治疗破坏血脑屏障并可作为免疫诱导剂加剧正常脑组织的免疫毒性相关[33-34]。
2.3 脑血管并发症
脑血管病变在头颈部肿瘤放疗后的患者中普遍发生,一项基于7 T MRI对放疗后微出血的研究中发现,100%的头颈部肿瘤患者在放疗后1年或更长时间检测出至少一个微出血灶[35]。放射治疗主要影响脑内的动脉和毛细血管,而对静脉的影响通常较小[32]。主要机制是辐射导致的血管内皮的炎症损伤,进而出现粥样硬化斑块形成、血栓形成等血管壁的改变[36],导致放射野内的血管的闭塞、动脉瘤形成甚至破裂出血,进而出现微出血灶、脑白质病、卒中(缺血性或出血性)、烟雾综合征或脑血管畸形(包括海绵状血管瘤、毛细血管扩张和动脉瘤)等[32]。当病变表现为微小血管的损伤时,磁敏感加权成像(susceptibility weighted imaging, SWI)通常能更敏感地在照射野内检测到低信号的出血改变[37]。磁共振血管成像(magnetic resonance angiography,MRA)和数字减影血管造影(digital subtraction angiography, DSA)是评估放疗后血管情况的金标准,当病变累及较大血管时,还可以对血管壁进行评估。一项对42例单侧腮腺肿瘤放疗后患者双侧颈动脉管壁厚度的超声评估发现,治疗侧的颈动脉管壁厚度增加有显著性,且这种改变与脑血管意外的发生率增加有关[38]。而高分辨力血管壁成像(high resolution vessel wall imaging, HR-VWI)对颅内血管壁改变的敏感度更高,能够更准确地检测到放疗后颅内血管壁的改变。
2.4 SMART综合征
SMART 综合征是一种罕见的迟发性并发症,通常在放射治疗数十年后发生,临床上以偏头痛为前驱症状,随后发展为局灶性神经功能缺损,其MRI 表现通常较为典型,为与局灶性神经功能缺损相关脑区一致的明显短暂性、可逆性脑回状皮质增厚、强化,伴有或不伴有软脑膜的强化,然而皮质增厚及强化程度达到峰值时,相应部位的灌注却无明显增高,这一特点可作为SMART 综合征与肿瘤复发的鉴别点[39]。颞叶,其次是顶叶受累较为常见,且临床症状的持续时间长短与高龄、颞叶受累及扩散受限相关[40]。通常,在受累脑区的皮质完全坏死之前,该并发症导致的神经功能缺损是可逆的[30]。除此之外,SMART 综合征、围发作期假性进展(peri-ictal pseudoprogression, PIPG)及放疗后急性晚发性脑病(acute late-onset encephalopathy after radiation therapy, ALERT)综合征三种疾病实体由于影像学上表现类似,故合称为放射治疗引起的延迟性复发-缓解神经系统综合征,三者主要的区分在于临床表现的部分差异,但不一定每一次的临床症状发作都伴随着影像学的改变[32]。
放射治疗相关的神经系统并发症通常在进入晚迟发反应期才会出现典型的MRI特征,而此时神经系统的损伤已不完全可逆,所以,如何使用更精密的检查仪器以及更先进的检查方法寻找潜在的MRI 检查标志物以在早迟发反应期甚至急性期对放射治疗后神经系统并发症进行诊断以及进行治疗方案的调整成为当前研究的方向。
3 免疫治疗
临床目前常用的免疫治疗方法包括嵌合抗原受体T 细 胞(chimeric antigen receptor T cell,CAR-T)免疫疗法和免疫检查点抑制剂。
3.1 CAR-T疗法
使用CAR-T疗法的患者中有60%以上会出现神经系统的并发症[41],该并发症称为免疫效应细胞相关神经毒性综合征(immune effector cell-associated neurotoxicity syndrome, ICANS)。其产生的主要机制为血脑屏障的破坏从而导致炎性细胞因子和白细胞经脑脊液浸润[42]。临床表现从轻度意识模糊到失语、癫痫发作、脑水肿伴昏迷,甚至死亡[43]。美国移植和细胞治疗学会(American Society for Transplantation and Cellular Therapy, ASTCT)根据患者的神经系统的症状将ICANS 分为4 级(表1)[41]。在颅脑MRI 检查中,ICANS 1~2 级通常表现为阴性,随着级别的升高,ICANS 逐渐表现为大脑深部结构的局灶性血管源性水肿,受累严重的部位可见T2WI 低信号的微出血灶,更高级别的ICANS可表现为整个大脑半球的血管源性水肿,增强扫描时可在FLAIR高信号区内发现与血脑屏障破坏相一致的强化灶,并可见到非特异性的软脑膜的强化,严重者会出现大脑皮层的扩散受限。当患者临床症状消退后,脑MRI异常可完全恢复正常[44-45]。

表1 ASTCT ICANS共识分级Tab.1 ASTCT ICANS consensus grading
3.2 免疫检查点抑制剂
目前已投入临床使用的免疫检查点抑制剂包括:程序性死亡受体-1(programmed death-1, PD-1)抑制剂及其配体(programmed death-L1, PD-L1)抑制剂和细胞毒T 淋巴细胞相关抗原-4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)抑 制剂,其作用机制为抑制免疫检查点分子抑制免疫细胞功能的作用,从而提高机体免疫细胞抗肿瘤的能力,然而检查点抑制的作用很少局限于肿瘤微环境,PD-1/PD-L1和CTLA4在各种组织类型中广泛表达,下调可引发广泛的自身免疫毒性,从而导致免疫相关不良事件(immune-related adverse events,irAEs)的发生。irAEs 可累及全身多个系统,神经系统受累较为少见,称为神经免疫相关不良事件(neurological immune-related advert event, NAEs),发病率约为1%~5%[46],包括中枢神经系统不良反应和周围神经系统不良反应两种类型。
中枢神经系统不良反应主要包括:脑炎、脑膜炎、脊髓炎和垂体炎,其中脑炎表现为免疫检查点抑制剂治疗后出现的颅脑MRI 单侧或双侧T2WI 或FLAIR异常信号,伴有或不伴有强化,病变部位在PET上表现为高代谢,分布以边缘系统、皮层及基底节区常见[47](图4)。颅内异常信号对激素治疗敏感,分布和信号特点通常不具有特异性,诊断需结合脑脊液抗体检测。脑膜炎主要表现为脑膜的强化。垂体炎表现为垂体增大。

图4 男,64岁,非小细胞肺癌患者,行度伐利尤单抗治疗后出现头晕、头痛、步态不稳等症状。颅脑MRI提示脑室周围、皮层下和深部脑白质T2WI及液体衰减反转恢复序列高信号(4A~4B),无强化(4C)。经甲泼尼龙注射及血浆置换后症状好转(图源:中南大学湘雅医院影像归档和通信系统)。Fig.4 Male, 64 years old, patient of non-small cell lung carcinoma, presented with dizziness, headache, and unsteady walking after the treatment of tremelimumab.MRI shows T2WI and fluid attenuated inversion recovery sequence (4A-4B)hyperintensities at the periventricular, subcortical, and deep white matter, with no abnormal enhancement (4C).His symptoms relieved after methylprednisolone injection and plasma exchange (Source: Image archiving and communication system of Xiangya Hospital of Central South University).
周围神经系统不良反应主要包括:格林-巴利综合征(Guillain-Barré syndrome, GBS)和肌无力综合征,现有的MRI 检查方法对该类疾病的诊断效果欠佳。
需要注意的是,NAEs 的诊断是一种排除诊断,在作出诊断前需排除肿瘤转移、副肿瘤综合征等导致脑内异常信号灶的其他可能原因。所以,需要进一步深入研究以确定其特异性的影像标志物。
4 小结和展望
癌症的各种治疗方法不可避免地会产生不同程度的中枢神经系统和外周神经系统的多种并发症,这些并发症在早期通常可通过停药或一定的治疗手段有效逆转,而到达晚期,特别是神经细胞发生不可逆的结构改变后,治疗效果通常不佳,因此,如何在影像学上早期识别此类治疗相关的神经系统并发症并对神经系统功能进行保护以最大程度改善患者预后至关重要。
肿瘤治疗相关神经系统并发症的诊断仍面临着诸多挑战,现有的研究主要集中于回顾性研究及个案报道,与并发症相关的诊断和治疗指南较为缺乏,这就需要未来大规模前瞻性的研究及临床-病理对照研究来进行改善。未来的研究也将使用更精密的检查仪器(如超高场强MRI)、更新颖的检查方法(如磁共振功能成像)联合临床及病理来寻找更敏感的MRI 标志物,以尽可能早地在出现不可逆的神经系统损伤前对其进行诊断并指导临床治疗。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:廖伟华提出本综述选题和方案,并对本综述的重要内容进行了修改,获得了国家自然科学基金的资助;何嘉琦起草和撰写本综述,收集并描述本综述内呈现的典型病例;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

