基于磁共振扩散加权成像的虚拟弹性成像在肝脏局灶性病变中的应用价值
王矜涵,李香,李晨霞,崔婷,景彦博,储春闱,刘帅,刘晨越,张月浪
0 前言
肝脏局灶性病变(focal liver lesion, FLL)在临床中非常常见,如肝细胞癌、转移瘤、血管瘤、肝囊肿等,较早发现恶性病变是临床中及时治疗患者,改善患者预后的关键所在[1]。各种类型的FLL硬度值存在差异[2],肿瘤硬度与癌细胞的增殖、侵袭、转移相关,并影响治疗结果[3]。目前,肝脏活检仍然是被认为是检测FLL 的金标准,但这是一种有创检查,具有疼痛、出血、感染,甚至死亡等风险,使其临床应用受到限制,因此需要不断的探索鉴别FLL的无创性检查方法。硬度为肿瘤四大物理特征之一,从物理学的角度讲,硬度是物体受到机械作用时抵抗塑性形变能力的量化表示方式,是一个与软组织的病理状态密切相关的参数。肝脏硬度与FLL 之间有着紧密联系,与肝脏组织的增殖、分化、代谢密不可分[4]并影响患者预后[5]。临床上常用超声弹性成像、磁共振弹性成像(magnetic resonance elastography, MRE)测量病变的硬度值,但是超声弹性成像受人为因素影响较大,MRE 需要专用的硬件和软件,成本高昂,在临床应用中均受限[6]。
2017年LE BIHAN等[7]首次提出了基于磁共振扩散加权成像(diffusion weighted imaging, DWI)的虚拟MRE(virtual MRE, vMRE)的概念,这是一种新的弹性驱动的体素内不相干运动(intravoxel incoherent motion, IVIM),这种技术无需引用外部机械波,基于DWI,通过校准步骤将表观扩散系数(apparent diffusion coefficient, ADC)转换为纤维化肝组织的剪切模量,对组织纤维化敏感[8]。DWI 对组织的微观结构很敏感,特别是在较高的b 值时,由于水的随机运动受到组织结构不同程度的阻碍,使得vMRE 通过非高斯扩散反映更多的组织微观结构[9]。
JUNG 等[10]通过回顾性分析同时接受MRE 检查以及DWI检查患者的影像资料,发现MRE和vMRE在肝纤维化分期评估中,显示出高度的一致性,指出vMRE具有稳定性和有效性,具有代替MRE 的潜力。但是,作为一种能够反映组织硬度的无创、经济和新型的定量功能磁共振影像学技术[11],vMRE的参量在FLL中的应用价值尚属未知。因此,本研究拟探究vMRE在FLL中的应用价值,从而提供一种新型的定量MRI方法。
1 材料与方法
1.1 研究对象
本研究遵守《赫尔辛基宣言》,并获得西安交通大学第一附属医院伦理委员会批准,豁免患者知情同意,批准文号:2022 伦审科字第(115)号。回顾性分析2021 年11 月至2022 年6 月于西安交通大学第一附属医院行上腹部MRI检查的224例FLL患者的病例资料。所有患者的上腹部MRI 检查序列包括常规抑脂T2WI(fat saturation T2WI, FS-T2WI)和多b值DWI。
1.2 纳排标准
纳入标准:(1)参照《原发性肝癌诊疗指南(2022 版)》[12]以及《EASL 良性肝肿瘤管理临床实践指南》[13],经手术标本病理检查确诊或经临床资料、随访及影像学检查诊断的FLL;(2)目标病灶没有做过治疗。排除标准:(1)MRI 检查中的DWI 序列不全(未包含b 值为200、1500 s/mm2);(2)图像质量不佳,伪影严重,病变显示不清;(3)病灶直径<10 mm 或靠近包膜无法在vMRE上准确识别;(4)肝脏弥漫性病变。
1.3 数据采集及处理
应用GE Discover MR750 3.0 T MRI 仪,专用8通道相控阵表面线圈。上腹部扫描前禁食禁水6~8 h。受检者取仰卧位,足先进,外加呼吸门控。线圈中心置于剑突水平,以确保肝脏位于线圈中心,扫描范围覆盖膈肌至肝脏下缘。扫描序列主要为常规T1WI、T2WI 脂肪抑制序列及多b 值DWI。常规T1WI 平扫及增强扫描采用肝脏快速容积采集成像序列,扫描参数:TR 2.8 ms,TE 1.3 ms,FA 11°,FOV 400 mm×420 mm,层厚5 mm。常规T2WI 平扫采用脂肪抑制的快速自旋回波序列,扫描参数:TR 6315.7 ms,TE 85.3 ms,FA 90°,FOV 400 mm×420 mm,层厚5 mm。DWI采用单次激发自旋回波平面成像序列,b值采用0、200、1500 s/mm2,TE 77.4 ms,FA 90°,FOV 75 mm×100 mm,层厚5 mm。
1.4 vMRE后处理及硬度值的获取
使 用 MATLAB R2021a(Mathworks, Natick,Massachusetts, USA)离线进行vMRE 硬度值的量化。既往研究指出[14],只需2 个b 值序列即可获得vMRE 图像,通常选择校准的具有200和1500 s/mm2两个关键b值的移位ADC(shift ADC, sADC),sADC=In(S200/S1500)/(200-1500),其中,sADC 单位为mm2/s,S200是b 值为200 s/mm2时的图像信号,S1500是b 值为1500 s/mm2时的图像信号。通过公式μDiff=αsADC+β计算硬度值,其中μDiff是基于扩散的剪切模量,反映组织硬度,单位为kPa,sADC 是移位ADC,α和β的值分别为-9.8±0.8和14.0±0.9[15]。
由2 名分别具有8 年工作经验的影像诊断主治医师和3 年工作经验的影像诊断住院医师采用双盲法、通过视觉判断成像结果,意见不一致时,可共同阅片协商达成一致,若意见仍不一致,则邀请第3 位具有26年放射诊断工作经验的影像科主任医师共同判读,获得一致性意见。利用Image J(Java 1.8.0, National Institutes of Health, USA)对每一个FLL 进行感兴趣区(region of interest,ROI)绘制,对于实性病变,将ROI 放置在病变的实性部分,避开病变边缘、伪影及坏死囊变区域;对于囊性病变,将ROI放置在病变边缘的3~5 mm以内,尽可能大地包含整个病变,在每个病变的上中下三个层面分别绘制ROI,面积为100~200 mm2,得到虚拟弹性硬度值,计算平均值并记录。各种病变的vMRE 示意图如图1所示。
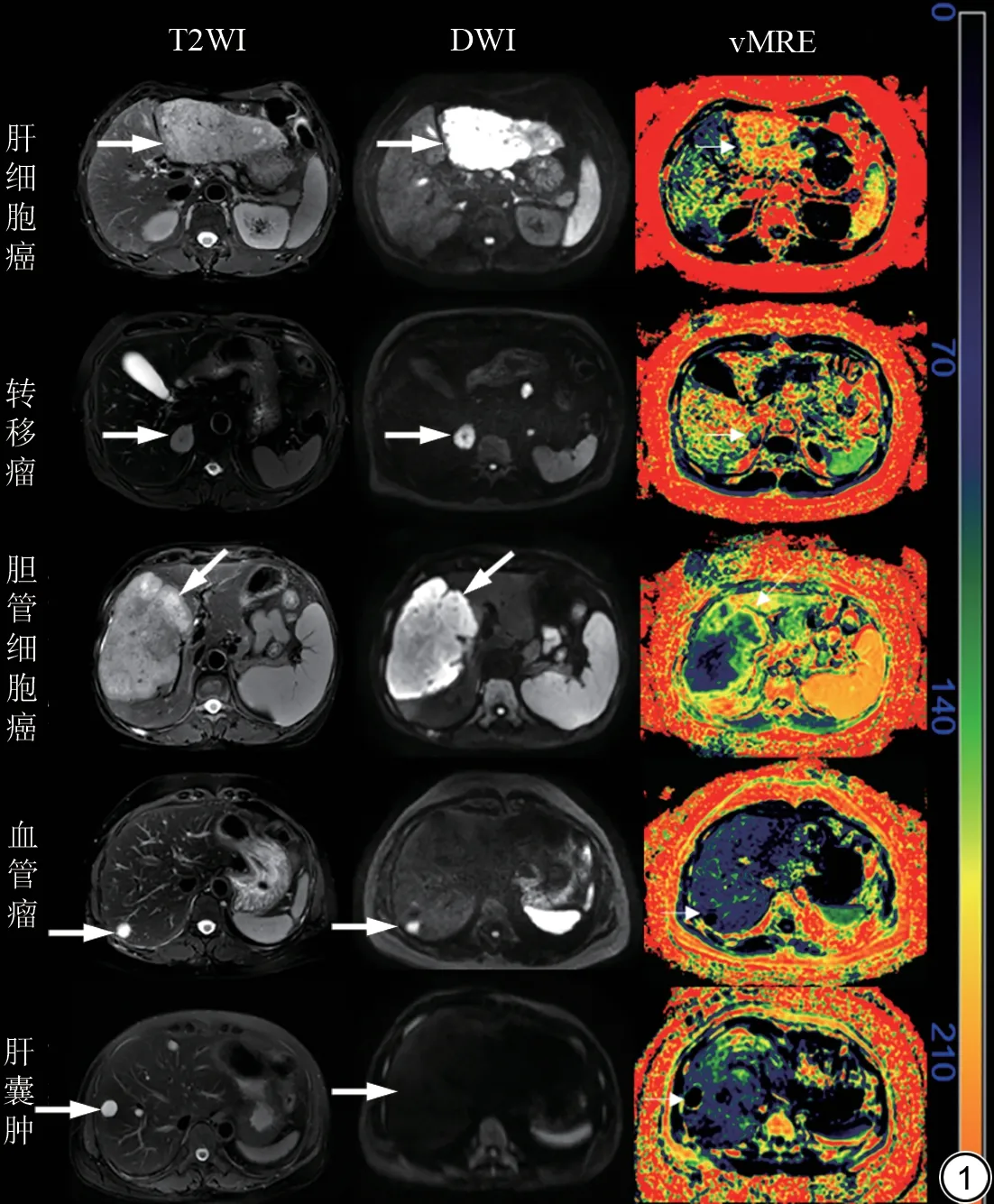
图1 肝脏局灶性病变的虚拟弹性成像(vMRE)图像。肝细胞癌在T2WI 上呈稍高信号,扩散加权成像(DWI)上呈高信号,vMRE 伪彩图肿瘤色度偏红,提示硬度值高(箭);转移瘤在T2WI上呈中等信号,典型表现为“牛眼征”,DWI上呈高信号,vMRE 伪彩图肿瘤实性成分色度稍低于肝细胞癌,坏死部分色度偏深,提示实性成分硬度值偏高(箭);胆管细胞癌在T2WI 上呈高信号,DWI 上呈高信号,vMRE 伪彩图肿瘤实性成分色度稍低于转移瘤,但高于肝细胞癌,坏死部分色度偏深,提示实性成分硬度值高(箭);血管瘤在T2WI 上呈明显高信号,DWI 上呈高信号,伪彩图颜色偏深,提示硬度值较低(箭);肝囊肿在T2WI上呈光滑均匀稍高信号,DWI上呈低信号,伪彩图颜色偏深,提示硬度值低(箭)。Fig.1 Virtual magnetic resonance elastography (vMRE) images of focal liver lesions.Hepatocellular carcinoma shows slightly high signal intensity on T2WI, high signal intensity on diffusion weighted imaging (DWI), and red color on the pseudocolor image of vMRE, indicating a high stiffness value (arrow); Metastatic tumors exhibit moderate signal intensity on T2WI, typically manifested as the "bull eye sign", high signal intensity on DWI, and slightly lower chromaticity of solid components on vMRE pseudocolor images compared to hepatocellular carcinoma, the necrotic part has a darker chromaticity, indicating a higher stiffness value of solid components (arrow); Cholangiocellular carcinoma shows high signal on T2WI and high signal on DWI, the pseudocolor image of vMRE shows a slightly lower chromaticity of the solid components of the tumor than that of metastatic tumors, but higher than that of hepatocellular carcinoma, the necrotic part has a darker chromaticity, indicating a higher stiffness value of the solid components (arrow); Hepatic hemangioma shows significant high signal on T2WI, high signal on DWI, and dark color on pseudo color images, indicating a lower stiffness value (arrow); Hepatic cysts exhibit smooth and uniform slightly high signal intensity on T2WI, low signal intensity on DWI, and dark color on pseudo color images, indicating low stiffness values (arrow).
1.5 统计学分析
采用SPSS 26.0(SPSS Inc, USA)对本研究数据进行分析,本研究的数据为硬度值,属于计量资料,采用均数±标准差(±s)进行统计描述,正态分布的数据采用t检验比较,非正态分布的数据采用Mann-WhitneyU检验进行比较。对两名诊断医生所测得的数据采用组内相关系数(intra-class correlation coefficient, ICC)进行一致性检验,ICC>0.75则认为可信度高。采用MedCalc(v19.7.4,MedCalc 有限公司,Ostend,Belgium,https://www.medcalc.org)软件获得受试者工作特征曲线(receiver operating characteristic, ROC)曲线及其曲线下面积(area under the curve, AUC),分析vMRE所得出的硬度值在FLL 良恶性病变之间的鉴别诊断效能。P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料
根据纳排标准共纳入病例224例,其中男128名,女96名,年龄25~85(58.68±11.76)岁。224例患者中恶性病变128 例,良性病变96 例。128 例恶性患者中,30例通过病理结果确诊,96例良性患者中,4例通过病理学确诊,其余病例通过临床与影像学随访确诊。患者的基本特征详见表1。对两名医师测得的vMRE 硬度值进行一致性检验,ICC=0.915(95%CI:0.888-0.936),可信度高。
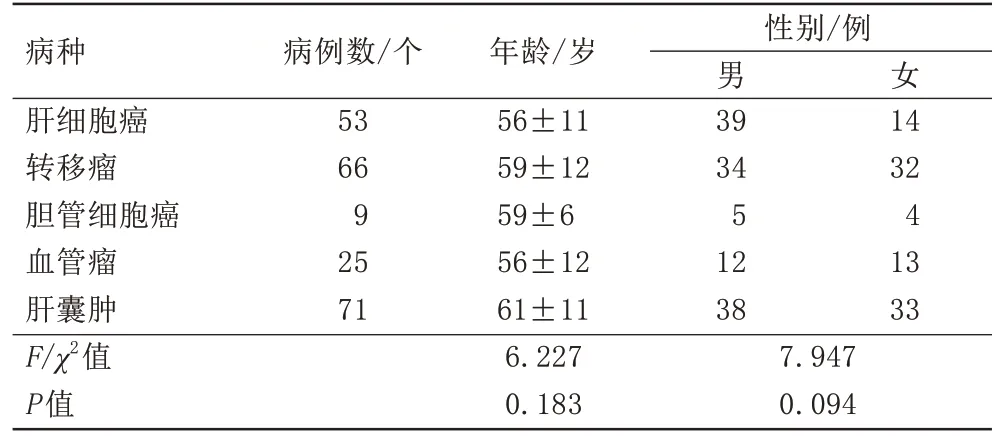
表1 局灶性肝脏病变患者研究队列的基本特征Tab.1 Baseline characteristics of the study cohort of patients with focal liver lesions
2.2 各分组硬度值的测量以及肝脏恶性病变硬度值之间的差异
各类局灶性病变vMRE 测量硬度值对比图如图2 所示。肝细胞癌的硬度均值为(3.09±3.00)kPa,转移瘤的硬度均值为(2.26±3.26)kPa,胆管细胞癌的硬度均值为(5.69±3.22)kPa,血管瘤的硬度均值为(-4.51±3.41)kPa,肝囊肿的硬度均值为(-21.41±3.41)kPa。本研究中,128例恶性病变中包括53例肝细胞癌患者,66例肝转移瘤患者以及9例胆管细胞癌患者,统计分析显示,肝癌组与转移瘤组间差异无统计学意义(K=1.231,P>0.05);转移瘤组与胆管细胞癌组间差异具有统计学意义(K=-2.062,P<0.05);肝癌组与胆管细胞癌组间差异无统计学意义(K=-1.403,P>0.05)。
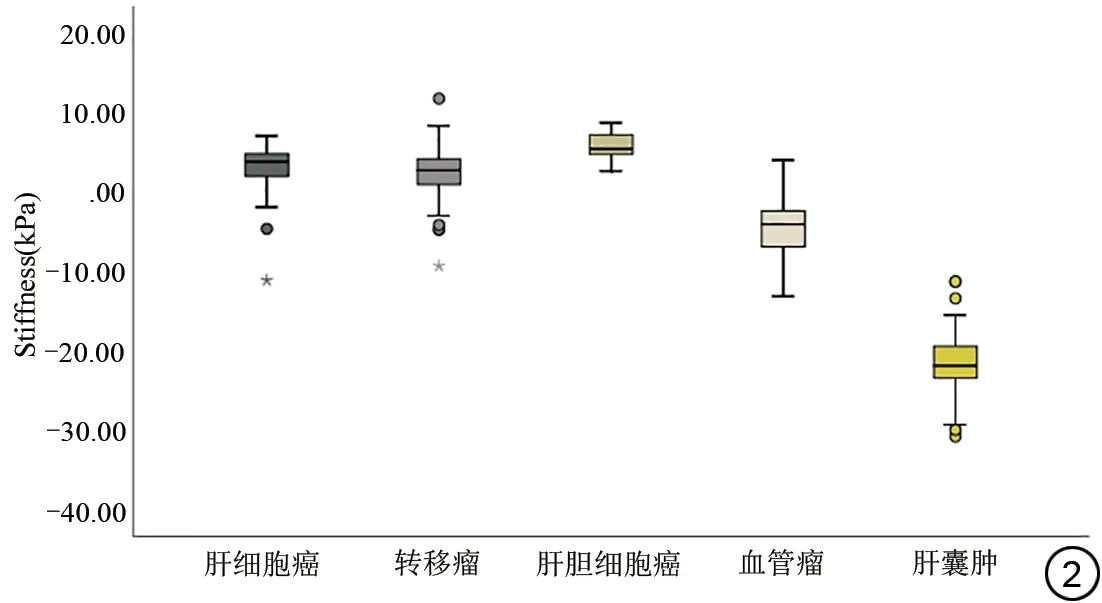
图2 肝脏局灶性病变的虚拟弹性成像硬度值箱图。Fig.2 Virtual magnetic resonance elastography stiffness box diagram of focal liver lesions.
2.3 肝脏局灶性良恶性病变硬度值的差异
本研究中,128 例恶性病变患者的硬度值为(2.85±3.19)kPa,96 例 良 性 患 者 的 硬 度 值 为(-17.01±8.35)kPa(图3A),考虑到肝囊肿可能对病变结果造成一定影响,剔除肝囊肿病变后,25 例血管瘤患者与肝脏恶性病变的硬度值对比图如图3B。在鉴别FLL 良恶性(良性病变包括血管瘤以及肝囊肿)中vMRE 硬度值差异具有统计学意义(Z=-12.309,P<0.01)。ROC 曲线分析显示硬度值在鉴别良恶性FLL的AUC 为0.981,P<0.01(图4A),敏感度为92.2%,特异度为96.7%,剔除肝囊肿病变后,恶性病变与血管瘤两组间差异具有统计学意义(Z=-6.733,P<0.01);硬度值在鉴别恶性病变与血管瘤的AUC 为0.926,P<0.01(图4B),敏感度为92.2%,特异度为88.0%,血管瘤与肝细胞癌(Z=-6.232,P<0.01)、转移瘤(Z=-5.975,P<0.01)、胆管细胞癌(Z=-4.313,P<0.01)三组之间差异均具有统计学意义。
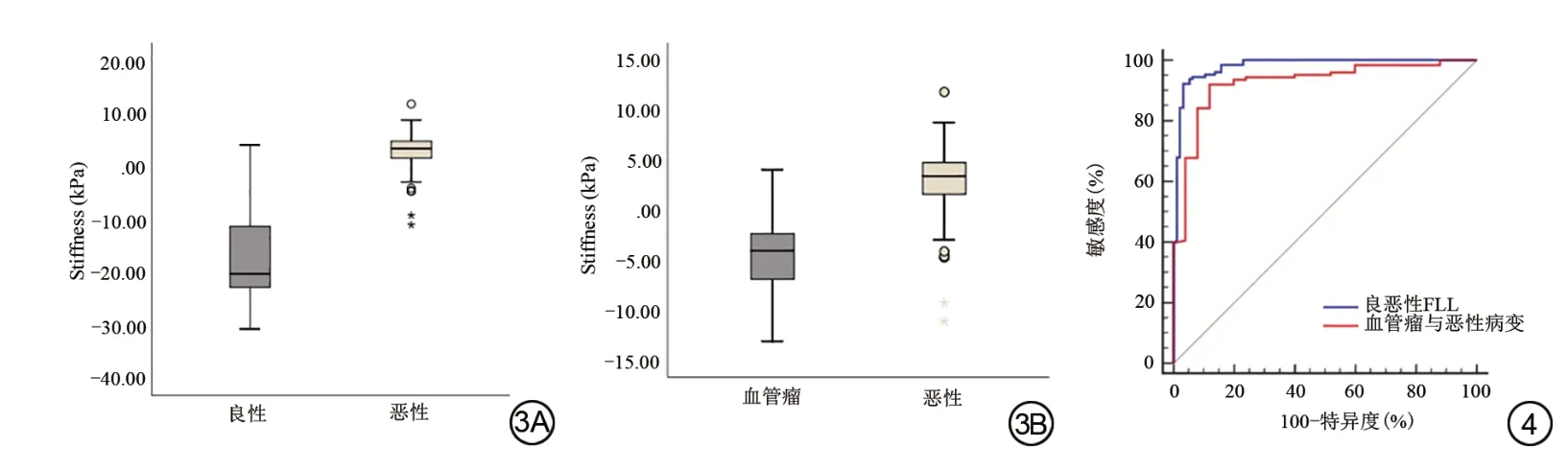
图3 肝脏良恶性病变(3A)及血管瘤与肝脏恶性病变(3B)虚拟弹性成像(vMRE)硬度值箱图。 图4 虚拟弹性成像(vMRE)硬度值鉴别肝脏良恶性病变和鉴别肝血管瘤与恶性病变的受试者工作特征曲线。Fig.3 Virtual magnetic resonance elastography (vMRE) stiffness box diagram of benign and malignant liver lesions (3A) and hemangiomas and malignant liver lesions (3B).Fig.4 Receiver operating characteristic curve of virtual magnetic resonance elastography stiffness values in distinguishing benign and malignant liver lesions and hepatic hemangioma and malignant liver lesions.
3 讨论
本研究将vMRE 应用于FLL,利用vMRE 所测量的病变硬度值来鉴别良恶性FLL。结果表明,恶性病变的硬度值明显高于良性病变,另外,恶性病变中,胆管细胞癌的硬度值最高,肝细胞癌硬度值略高于转移瘤,但是恶性病变之间的鉴别诊断,vMRE 尚不能完全区分。目前vMRE 是一种新兴的技术,这种技术可以直接通过DWI获得组织剪切刚度,无需使用任何机械振动装置,这种新的弹性驱动可以模拟任何范围的虚拟振动频率和振幅,而不受MRE 或MRI 硬件容量的限制[7],为临床鉴别FLL提供了一个新方法新思路。
3.1 vMRE的机制
vMRE与MRE不同,无需专门硬件和序列,基于多b值DWI,通过校准sADC(200-1500 s/mm2),将剪切模量转换为振动,从而提供组织硬度信息。这些特定的b值是根据理论和试验的联合考虑选择的,以提供对高斯和非高斯扩散的优化灵敏度[7]。已有研究表明DWI 可预测肝脏硬度的变化[16],理论上,水分子通过肝脏组织的运动阻抗反映纤维化程度,运动阻抗主要受细胞外间隙成分、压力等因素影响[17]。硬度值和组织的力学特性相关,主要包括细胞密集程度、细胞数量及间质液压力等[18-19]。说明恶性肿瘤的硬度值与ADC 值间存在较强的相关性[20]。一项回顾性研究通过分析慢性肝病患者的数据,表明vMRE 在检测肝纤维化分级方面的潜在用途[10]。
3.2 vMRE在良恶性FLL中的鉴别意义
良恶性FLL的硬度值存在差异[2]。本研究结果显示vMRE 测得的恶性病变的硬度值(2.85±3.19)kPa显著高于良性病变的(-17.01±8.35)kPa,vMRE 鉴别良恶性FLL 的AUC 值为0.981,与以往研究结果相似[21-22],且准确度更高。本研究纳入的恶性病变包括肝细胞癌、胆管细胞癌及转移瘤,良性病变主要包括血管瘤和囊肿。恶性病变多由排列紧密的癌细胞构成,其内含有大量的蛋白成分及新生微血管,均可增加组织的硬度[23-24]。血管瘤由海绵状血管间隙组成,可伴有一定程度的纤维化、钙化和血栓形成[15],而肝囊肿内部主要由可自由扩散的水分子囊性液体成分构成[25],故两者的力学性质均弱于恶性病变。肝转移瘤、胆管细胞癌的坏死囊变较常见,在这些病变中,ROI均选取在肿瘤实性成分画取,尽可能消除了坏死成分对硬度值的影响。本研究肝囊肿病例数约占本研究总病例数的1/3,为避免数据结果偏倚,在去除了肝囊肿病例后恶性病变与血管瘤的硬度值差异也具有统计学意义,恶性病变的硬度值显著高于血管瘤,血管瘤与各恶性病变之间硬度值差异也具有统计学意义,这与以往超声剪切波弹性成像的研究结果一致[26]。
3.3 vMRE在恶性病变之间的鉴别意义
在恶性病变之间的鉴别诊断中,vMRE 也具有一定价值,本研究结果显示胆管细胞癌的硬度值最高,肝细胞癌硬度值略高于转移瘤,这与以往的二维剪切波弹性成像研究结果相似[27]。其原因可能与胆管细胞癌内纤维成分含量较高有关[28],大量的胶原蛋白可增加组织的硬度[29]。vMRE 均不能很好地区分肝癌与转移瘤、肝癌与胆管细胞癌,与以往MRE 研究结果一致[20]。转移瘤组与胆管细胞癌组可以通过vMRE 区分,可能是因为本研究胆管细胞癌的病例数过少,转移瘤内部坏死囊变出血等成分在vMRE的图像质量伪影较大。然而,其他的一些超声剪切波弹性成像研究得出了相反的结果,他们认为肝脏转移瘤的硬度值明显高于肝脏原发性肿瘤,这可能与转移瘤患者原发肿瘤的恶性程度以及原发肿瘤的病理类型有关[30]。另有研究显示胆管细胞癌硬度最低,肝细胞癌硬度最高[31],与我们的研究结果相反,原因可能是本研究的胆管细胞癌样本量较小,准确度会随着两者之间样本量比例变化而变化[32]有关,也可能是因为病变内部出现硬化、血管内血栓形成或者肿瘤内部钙化导致硬度值增加[33]。虽然,vMRE 能够通过在肿瘤内特定实性成分画取ROI并测量其硬度值,但肿块存在异质成分,如肿块出血或脂肪变[34]等形态特征,因此,还需要进一步研究以降低这种潜在偏倚。
3.4 局限性
本研究还存在一些不足之处:首先,胆管细胞癌的病例的样本量不足,良性病变中病种较少,容易引起偏倚;其次,我们的研究中没有考虑病变的形状,未来应进一步研究如何使用vMRE评估形态变化的肝脏肿块及其对肝肿块硬度值的影响[35]。
4 结论
综上所述,基于DWI的vMRE能够有效鉴别FLL的良恶性,作为一种新型的无创反映肿瘤硬度的定量功能MRI 技术,其能够成为FLL 良恶性鉴别的一种有效方法,并且有望成为不典型血管瘤与恶性病变的鉴别的新型指标。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:张月浪设计本研究的方案,对稿件重要内容进行了修改;王矜涵、李香起草、撰写、修改稿件,获取、分析或解释本研究的数据,其中李香获得了陕西省重点研发计划一般项目及西安交通大学第一附属医院临床研究课题面上项目资助;李晨霞、崔婷、景彦博、储春闱、刘帅、刘晨越统计分析、分析或解释数据,对文章的知识性内容进行了批评性审阅;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

