深度学习重建联合Smart去金属伪影算法对颈部CT图像中口腔金属植入物伪影的影响
唐 丽,刘 星,侯 平,王明月,魏一娟,吕培杰,高剑波
(郑州大学第一附属医院放射科,河南 郑州 450052)
口腔内金属植入物可在头颈部CT图像中造成金属伪影,严重影响图像质量[1];既往多通过调整CT参数或以单能量成像等方式减少金属伪影,但效果有限[2]。基于投影的Smart去金属伪影(metal artifact reduction, MAR)算法操作简单、重建时间短,联合自适应迭代重建(adaptive statistical iterative reconstruction V, ASIR-V)可明显减少金属伪影、降低图像噪声,改善图像质量[3-4],但ASIR-V权重过高易致图像呈现“蜡像感”或“塑料样”外观,使其临床应用受限[5-6]。利用深度学习重建(deep learning reconstruction, DLR)可在降低辐射剂量、保证空间分辨率及图像质量的同时降低背景噪声,提高病变检出率[7-10]。本研究观察DLR联合Smart MAR算法对CT图像中口腔金属植入物伪影的影响。
1 资料与方法
1.1 研究对象 回顾性分析2023年3月—6月60例存在口腔金属植入物、并因疑诊头颈部肿瘤、转移癌或感染性病变而于郑州大学第一附属医院接受颈部CT检查患者,男26例、女34例,年龄34~85岁,平均(59.3±10.8)岁。其中19例检出颈部病变且CT显示病变受金属植入物伪影干扰,男10例、女9例,年龄40~85岁、平均(57.2±12.6)岁,其中恶性肿瘤10例、良性肿瘤2例、淋巴结肿大2例、感染性病变3例、钙化灶1例及异物1例。本研究经院伦理委员会批准(2021-KS-HNSR115);检查前患者均签署知情同意书。
1.2 仪器与方法 采用GE APEX 512层CT仪,嘱患者仰卧,行颈部平扫+增强扫描,扫描范围自颅底上方3~4 cm至锁骨上窝;参数:自动管电压(80~120 kV),自动管电流(45~450 mA),螺距0.992,层厚及层间距均为3 mm。完成平扫后经肘静脉以3.0 ml/s流率注射80 ml碘海醇对比剂(350 mgI/ml),于60~65 s后行静脉期扫描。扫描结束后分别以ASIR-V(重建百分比为50%)联合Smart MAR (IR+S组)、DLR-H(重建强度为高水平)联合Smart MAR(DH+S组)、DLR-M(重建强度为中水平)联合Smart MAR(DM+S组)、DLR-H(DH组)及DLR-M(DM组)重建静脉期图像,层厚及层间距均为0.625 mm。
分别由2名具有5年以上工作经验且不知晓患者及图像信息的放射科主治医师以Likert量表对图像整体(包括显示口腔结构、噪声、纹理及金属伪影)及显示病灶质量进行主观评分(表1),意见存在分歧时经讨论达成一致。

表1 图像整体及显示病灶质量主观评分标准
1.4 统计学分析 采用SPSS 21.0统计分析软件。以中位数(上下四分位数)表示不符合正态分布的计量资料,以Friedman检验进行多组间比较,以Wilcoxon秩和检验行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 客观评估 5组图像SD1、SD2及AI差异均有统计学意义(P均<0.05)。SD1及AI在DH+S组、DM+S组、IR+S组、DH组及DM组依次升高(P均<0.05)。SD2在DH+S组、DM+S组及IR+S组依次升高(P均<0.05),而DH+S组与DH组、DM+S组与DM组差异均无统计学意义(P均>0.05)。见表2。
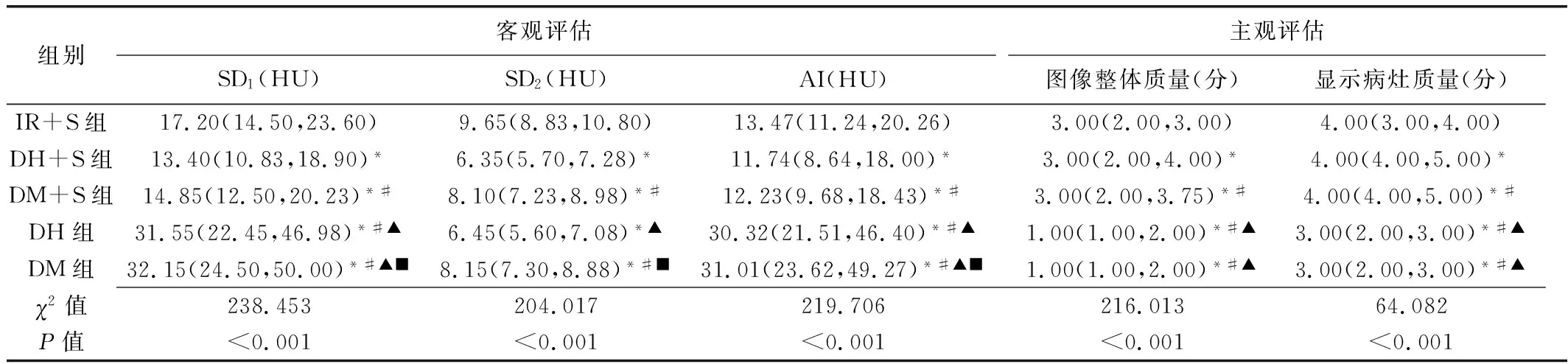
表2 不同重建算法颈部CT图像质量评价结果(n=90)
2.2 主观评估 10例[包括6例存在颈部病变(6/19,31.58%)及4例(4/41,9.76%)无颈部病变]于IR+S组、DH+S组及DM+S组图像中可见DH组及DM组图像中不存在的伪影。19例存在颈部病变且受金属伪影干扰患者中,16例(16/19,84.21%)病变于5组图像中均可识别,3例(3/19,15.79%)病变仅可于IR+S组、DH+S组及DM+S组图像中识别。见图1、2。

图1 患者男,40岁,右侧扁桃体鳞癌,左下第二前磨牙、第一磨牙、第二磨牙及右下第一磨牙义齿 A、B.DLR-H图(A)及DLR-M图(B)示口腔明显金属伪影,右侧扁桃体内见卵圆形强化灶显示较差,边界不清、密度不均; C~E.ASIR-V联合Smart MAR图(C)、DLR-H联合Smart MAR图(D)及DLR-M联合Smart MAR图(E)示右侧扁桃体区无明显伪影,病灶边界尚清,易于识别 (箭示病灶)

图2 患者女,56岁,右上中切牙义齿 A、B.DLR-H图(A)及DLR-M图(B)中舌部未见明显伪影;C~E.ASIR-V联合Smart MAR图(C)、DLR-H联合Smart MAR图(D)及DLR-M联合Smart MAR图(E)中见舌部伪影(箭)
5组图像整体质量及显示病灶质量主观评分差异均有统计学意义(P均<0.001),在DH+S组、DM+S组及IR+S组依次降低(P均<0.05),但均高于DH组及DM组(P均<0.05),而DM组与DH组间差异均无统计学意义(P均>0.05)。见表2。
3 讨论
口腔金属植入物产生的放射状或条纹伪影可对影像学医师识别图像中的口腔结构及颈部病变造成干扰。FELDHAUS等[3]分别以ASIR-V联合Smart MAR算法和单独ASIR-V算法重建头颈部CT图像,发现前者金属伪影明显小于后者,且对恶性肿瘤检出率更高。本研究分别以ASIR-V联合Smart MAR、DLR-H联合Smart MAR、DLR-M联合Smart MAR、DLR-H及DLR-M算法重建颈部CT图像,结果显示联合Smart MAR算法图像的AI均明显低于单独DLR算法,且3例(3/19,15.79%)病变仅于联合Smart MAR图中显示,提示Smart MAR可减少头颈部CT图像中来自口腔金属植入物的伪影而清晰显示口腔结构及病灶,有利于提高图像质量。
对于存在髋关节或脊柱金属植入物患者,以Smart MAR算法重建CT图像可能引入伪影,导致假体周围出现透亮线或形态失真[11];而其他MAR算法,如O-MAR、iMAR及单能量联合MAR等则可致存在口腔金属植入物者头颈部CT图像出现低密度条纹或放射状伪影[12-14]。本研究存在颈部病变的19例中的6例(6/19,31.58%)和无颈部病变的41例中的4例(4/41,9.76%)于IR+S组、DH+S组及DM+S组中出现不见于DH组及DM组中的伪影,可能与Smart MAR算法对密度不均匀较为敏感、进而过度或错误加以校正有关。以上结果提示,对于存在口腔金属植入物的颈部病变患者,以Smart MAR重建头颈部CT图像可能更易出现伪影,需结合其他图像进行综合评估。
利用DLR算法,以高质量滤波反投影图像为训练集,可在不影响图像显示解剖结构质量的基础上有效降低背景噪声,弥补ASIR-V算法的不足。ALTMANN等[15]基于DLR算法以超高分辨CT机行头颈部扫描,以较低辐射剂量水平获得较好图像质量,且显示病变更为清晰。本研究以Smart MAR联合中/高水平DLR算法图像的噪声及AI均低于、而图像整体及显示病灶质量主观评分均高于联合ASIR-V算法,与既往研究结果相符[15];无论是否联合Smart MAR,高强度水平DLR的噪声及AI均低于中强度水平DLR,提示随着DLR重建强度增高,图像噪声减低,整体图像质量及显示病灶质量均有所改善。本研究DH组与DM组主观评分差异无统计学意义,原因可能在于图像金属伪影过大,且该指标评估在主观评分中较为重要。
综上,以DLR联合Smart MAR算法重建口腔存在金属植入物患者头颈部CT图像可获得较为良好的噪声、AI、图像整体及显示病灶质量,但可能存在无法去除的金属伪影,需结合其他图像进行综合评估。但本研究为回顾性分析,样本量小,且未对金属植入物种类、大小进行细分,有待进一步观察。

