多模态磁共振成像与多层螺旋CT对胃癌患者术前临床病理分期、浸润程度评估价值
王华锋, 袁仲强, 赵艳争
邯郸市中心医院1.CT/MRI室;2.肿瘤四科,河北 邯郸 056000
胃癌是临床较为常见的消化道恶性肿瘤,发病率位居全身性恶性肿瘤的第二位[1-2]。目前,临床主要采取手术治疗胃癌,有效延长患者的生存期。在疾病早期,及时、有效地对患者病变进行诊断,对患者预后具有积极意义[3]。在对胃癌患者的诊断中,多层螺旋CT(multislice CT,MSCT)的整体扫描时间较短,由于体位变化造成的运动伪影情况较低,检查后的多平面重建可进一步指导患者手术治疗[4]。而相较于MSCT,多模态磁共振成像(magnetic resonance imaging,MRI)可以通过对病灶部位淋巴结转移的扫描,预测患者的预后。本研究旨在探讨多模态MRI与MSCT对胃癌患者术前肿瘤临床病理(tumor node metastasis,TNM)分期、浸润程度的评估价值。现报道如下。
1 对象与方法
1.1 研究对象 选取自2020年1月至2022年5月于邯郸市中心医院接受治疗的80例胃癌患者为研究对象。纳入标准:符合胃癌诊断标准[5];首次确诊。排除标准:合并肝肾功能障碍;合并其他消化道疾病;合并其他消化道肿瘤。其中,男性48例,女性32例;年龄28~77岁,平均年龄(55.12±2.33)岁;平均体质量指数(23.99±2.12)kg/m2;既往胃部疾病44例;胃癌家族史35例;平均病程(1.60±0.51)年。根据TNM分期,将患者分为Ⅰ~Ⅱ期组(n=31)与Ⅲ~Ⅳ期组(n=49)。根据浸润程度,将患者分为早期组(n=13)与进展期组(n=67)。本研究经医院伦理委员会批准。所有患者均签署知情同意书。
1.2 研究方法
1.2.1 MSCT检查 采取GE 64排MSCT进行检测。检测前禁食6 h,扫描前15 min静脉推注盐酸山莨菪碱15 mg,嘱患者饮用800 ml温开水。扫描患者膈顶部位至盆底区域。常规扫描后,进行优维显注射,注射剂量为80 ml,注射速率为3.5 ml/s。注射完成后,分别对患者的动脉期、门静脉期及平衡期进行扫描,扫描过程中,电压设定为12 kV,电流设定为200 mAs,层厚设定为5.0 mm,螺距设定为1.2,扫描延迟时间设定为6 s。扫描完成后,由高年资住院医师对影像学图像进行诊断,分析肿瘤直径、肿瘤厚度、强化差值、不均匀强化情况。
1.2.2 多模态MRI检查 采用西门子3.0 T超导核磁共振对患者开展检查,嘱患者采取仰卧位,对膈顶部位至髂棘水平进行扫描。采用腹部相控阵表面线圈,先进行平扫T2WI及T1WI同反相位扫描,参数设置:TR/TE分别为1 500 ms/80 ms和82 ms/2.3 ms,视场角为375 mm,厚层为6.0 mm,矩阵为252×174。然后行IVIM-DWI扫描,TR/TE为7 232 ms/52 ms,层厚为4 mm,TI为220 ms,b值为0 s/mm2和800 s/mm2,然后进行蒙片及多期增强扫描,TR/TE为4.49 ms/1.68 ms,视场角为340 mm,矩阵352×260,层厚1.2 mm,层间距0.24 mm,翻转角设置为10°。将检测结果导入MITK-Diffusion软件进行处理。
1.3 观察指标 以病理检查作为“金标准”,评价MSCT检查与多模态MRI检查对胃癌的诊断效能和一致性。比较不同TNM分期、不同浸润程度患者的肿瘤直径、肿瘤厚度、强化差值、不均匀强化情况。比较不同TNM分期、浸润程度患者的表观扩散系数(apparent diffusion coefficient,ADC)、血管外细胞外间隙体积百分数(Ve)、转运常数(Ktrans)、速率常数(Kep)。
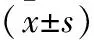
2 结果
2.1 MSCT与多模态MRI对胃癌诊断效能 MSCT与多模态MRI对胃癌诊断一致性Kappa值为0.652,一致性较高。见表1。

表1 MSCT与多模态MRI对胃癌的诊断效能
2.2 不同TNM分期患者MSCT检查指标比较 Ⅰ~Ⅱ期组患者肿瘤直径、肿瘤厚度、强化差值、不均匀强化比例低于Ⅲ~Ⅳ期组患者,差异有统计学意义(P<0.05)。见表2。
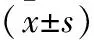
表2 不同TNM分期患者MSCT检查指标比较
2.3 不同浸润程度患者MSCT检查指标比较 进展期组患者肿瘤直径、肿瘤厚度、强化差值、不均匀强化比例高于早期组患者,差异有统计学意义(P<0.05)。见表3。
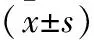
表3 不同浸润程度患者MSCT检查指标比较
2.4 不同TNM分期患者多模态MRI检查指标比较 Ⅲ~Ⅳ期组患者ADC、Ve、Ktrans、Kep高于Ⅰ~Ⅱ期组患者,差异有统计学意义(P<0.05)。见表4。
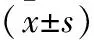
表4 不同TNM分期患者多模态MRI检查指标比较
2.5 不同浸润程度患者多模态MRI检查指标比较 早期组患者ADC、Ve、Ktrans、Kep高于进展期组患者,差异有统计学意义(P<0.05)。见表5。
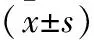
表5 不同浸润程度患者多模态MRI检查指标比较
3 典型病例
患者1,男性,45岁,胃小弯侧壁不规则增厚,最大直径约5.12 cm,增强扫描呈不均匀强化(图1a),DWI图像病灶明显扩散受限(图1b),ADC图信号减低(图1c),ADC=0.89×10-3mm2/s,病理证实Ⅳ期胃癌(图1d)。患者2,男性,65岁,平扫CT图像显示胃小弯侧壁不规则增厚(图1e),最大直径约2.12 cm,DWI图像病灶明显扩散受限(图1f),ADC图信号减低(图1g),ADC=1.69×10-3mm2/s,肝内多发转移瘤,病理证实Ⅱ期胃癌(图1h)。
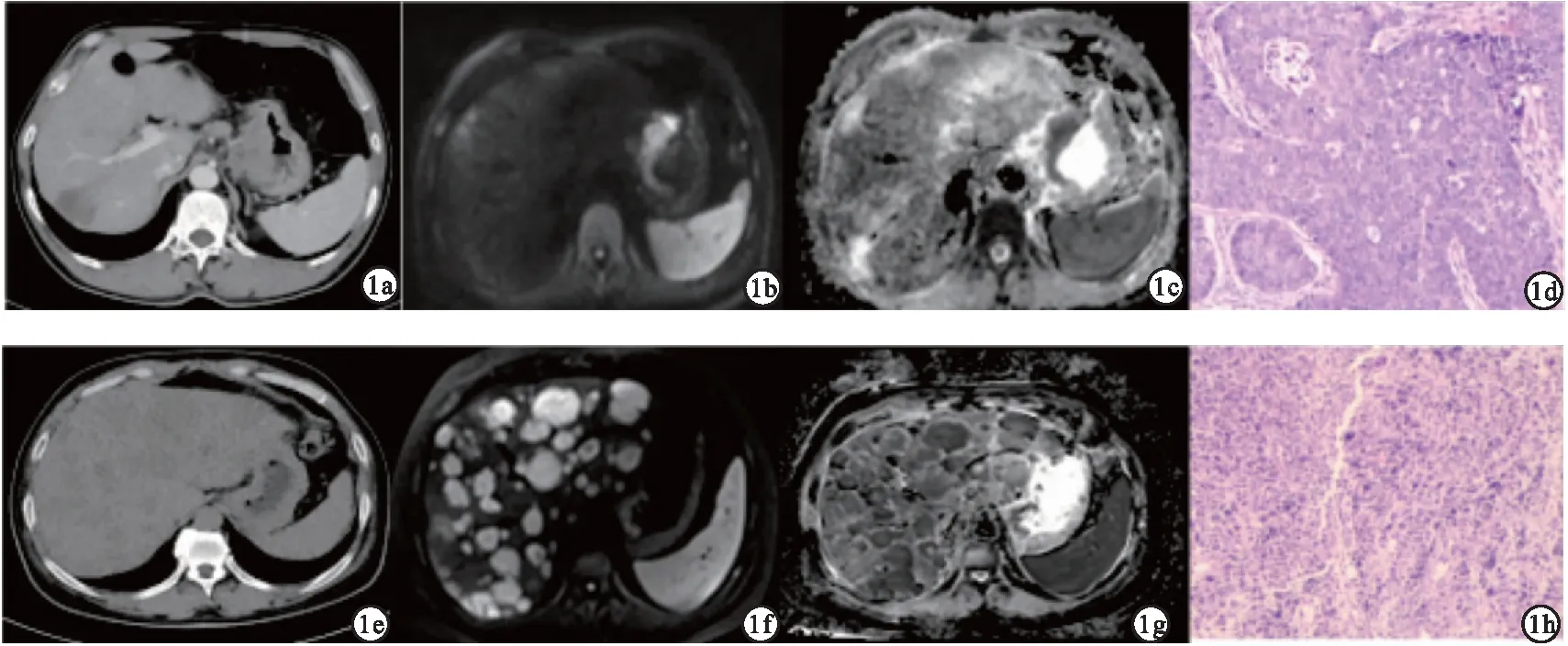
图1 不同分期胃癌患者特征(a~d.Ⅳ期胃癌患者;e~h.Ⅱ期胃癌患者)
4 讨论
胃壁组织主要由黏膜层、黏膜下层、固有肌层及浆膜层组成[6-7]。在肿瘤的进展过程中,胃壁组织呈现显著的增厚趋势,同时,局部病灶部位的异常情况呈现显著的下降趋势。因此,临床对胃癌的诊断主要通过对胃壁的光滑程度及脂肪间隙的清晰程度进行综合分析[8]。本研究MSCT检查结果显示,随着浸润程度、TNM分期的升高,肿瘤直径、肿瘤厚度、强化差值、不均匀强化比例显著升高。分析认为,随着肿瘤直径及厚度的增加,肿瘤比例及对周边正常组织的压迫作用均增强[9]。同时,局部组织受到压迫作用,产生局部炎性反应及氧化应激反应。受到压迫的局部肿瘤组织在增生过程中,血管畸形率升高[10],而新生的血管畸形会造成血管内皮功能紊乱,肿瘤组织向周边浸润,增加淋巴结转移风险。本研究中,随着肿瘤的进展,患者强化差值、不均匀强化也呈现显著的变化,提示随着疾病进展,局部的均匀性受到破坏[11]。郭麦军等[12]对胃癌患者手术前进行MSCT扫描并分析其胃癌分化程度,结果提示,低分化胃癌的肿瘤厚度>2 cm比例、瘤周低密度带厚度>4 cm比例、不均匀强化比例均明显高于中高分化胃癌患者,提示MSCT可有效鉴别胃癌的分化程度,与本研究结果一致。但MSCT对体积较小、解剖位置复杂、肿瘤边缘融合性较高的淋巴结检出率均较低[13]。因此,针对此类患者,建议通过多种影像学检查结果的综合评估,对患者的病情进行分析。
多模态MRI可通过对水分子运动情况的综合分析,对胃壁组织的完整性及脂肪间隙的均匀性进行评估[14]。本研究多模态MRI检查结果显示,随着肿瘤进展,患者ADC、血流情况均呈显著上升趋势。在肿瘤的浸润过程中,肿瘤在淋巴组织中不断浸润,其水分子的分布呈现明显的不均匀性。因此,对水分子的运动情况进行综合分析,对肿瘤进展具有一定的指示作用[15-16]。但本研究存在一定的局限性,多模态MRI诊断主要基于水分子的布朗运动,但在淋巴组织中,由于受到扩散系数、透过效应及温度的影响,其对肿瘤的阈值较小,诊断的特异度具有缺陷。因此,需要综合多模态MRI、MSCT检查,对胃癌患者的病灶浸润性进行分析,发挥各自诊断的优势,降低患者的诊断误差。
综上所述,基于多模态MRI与MSCT的影像学资料能够有效区分胃癌患者术前不同TNM分期和浸润程度。

