伴黄斑水肿的非增殖期糖尿病视网膜病变患者房水、血清炎症介质水平变化
彭文怡,张明媚,易湘龙
1 新疆医科大学第一附属医院眼科,乌鲁木齐 830000;2 省部共建中亚高发病成因与防治国家重点实验室
糖尿病视网膜病变(diabetic retinopathy,DR)是常见的糖尿病微血管并发症,可分为增殖期DR(Proliferative DR,PDR)和非增殖期DR(non-proliferative DR,NPDR)。糖尿病性黄斑水肿(diabetic macular edema,DME)指由于糖尿病引起的黄斑中心凹一个视盘直径范围内的细胞外液积聚所致的视网膜增厚或硬性渗出沉积。黄斑水肿是DR 患者视力丧失的主要原因,在糖尿病患者中的发病率为6.8%~14.0%,且呈逐渐升高趋势[1]。DR 是一种由炎症介质参与的慢性低度免疫炎症性疾病。研究[2]发现,相比于健康体检者,NPDR 患者房水或玻璃体中白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、干扰素-γ(interferon-γ,IFN-γ)和单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)等炎症介质水平均升高。炎症介质是否参与了NPDR 黄斑水肿的发生发展,目前相关研究较少。我们观察了有黄斑水肿的NPDR 患者房水及外周血中炎症介质水平变化,并进一步分析其相关性,现将结果报告如下。
1 资料与方法
1.1 临床资料 选择2021年10月至2022年8月在新疆医科大学第一附属医院眼科就诊的2型糖尿病(type 2 diabetes mellitus,T2DM)患者75 例,均根据糖尿病诊断标准和糖代谢状态分类标准[3]明确诊断为糖尿病。排除标准:患有其他眼部疾病,如PDR、视网膜静脉阻塞、黄斑变性、青光眼和葡萄膜炎等;患有肝功能不全、肾损伤、恶性肿瘤、精神疾病及自身免疫性疾病等;实验前6个月内,接受眼底激光光凝治疗;实验前12 个月内,接受玻璃体内抗VEGF及类固醇类药物治疗;进行过其他任何类型的眼内手术或眼部治疗以及全身抗VEGF 和类固醇类药物治疗。75 例患者根据2002 年由美国眼科协会和国际眼病学会发布的《糖尿病视网膜病变的国际临床分级标准》和糖尿病视网膜病变早期治疗研究(the Early Treatment Diabetic Retinopathy Study,ETDRS)[4]分为无视网膜病变者(NDR 组,确诊为T2DM、无DR)25 例、无黄斑水肿者(NDME 组,确诊为T2DM 和NPDR、无DME)20 例、黄斑水肿者(DME组,确诊为T2DM、NPDR 和DME)30 例,NDR、NDME和DME 组患者使用胰岛素比例分别为44%、80%和80%,DME 和NDME 组使用胰岛素比例明显高于NDR 组(P均<0.05)。各组在年龄、性别、BMI、糖尿病病程、血糖以及NPDR 严重程度分级方面具有可比性(P均>0.05)。所有患者在标本采集之前签署知情同意书。该研究得到新疆医科大学第一附属医院医学科研伦理委员会的批准(审批号:220120-06),严格按照批准的方案执行,并符合《赫尔辛基宣言》的伦理原则。
1.2 各组患者房水、血清炎症介质检测
1.2.1 房水、血清样本采集 ①房水标本制备 在患者进行玻璃体腔药物注射或白内障手术做眼球切口前,以1.0 mL 无菌空针于角膜缘后0.5 mm 平行于虹膜穿刺入前房抽取0.10~0.15 mL 房水,装入已消毒的EP 管中,-80 ℃冰箱密封保存待测。所有手术操作均由同一名医师完成。②血清标本制备采集患者晨起空腹外周静脉血5 mL,玻璃试管中室温静置30 min;常温离心10 min (3 000 rpm/min),吸取上层血清放于离心管内;常温下再次离心5 min (400 rpm/min),吸取上层血清-80 ℃冰箱储存备用。患者测定的血清指标均来自同一份血清标本。
1.2.2 房水、血清炎症介质检测 通过基于流式细胞检测系统的多重蛋白定量检测试剂盒(美国,Biolegend,740808)检测各组患者房水、血清中13种与眼内或全身炎症性疾病有关的炎症介质[2,5]IL-1β、IL-6、IL-8、IL-10、IL-12p70、IL-17A、IL-18、IL-23、IL-33、MCP-1、IFN-γ、IFN-α2 和TNF-α。具体操作步骤均严格按照试剂盒说明书进行。所有指标均重复检测3次,取平均值。
1.3 统计学方法 采用IBM SPSS 25.0 软件进行数据处理。计量资料在分析之前均进行正态性检验,服从正态分布的数据用-x±s表示,各组比较采用单因素方差分析和t检验,相关性分析采用Pearson 线性相关;非正态分布数据用中位数/四分位数间距表示,各组比较采用Kruskal-Wallis 和非参数Mann-Whitney 检验,相关性分析采用Spearman 秩相关;计数资料比较采用χ2检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 各组患者房水炎症介质水平比较 各组患者房水中IL-1β、IL-8、IL-10、IL-12p70、IL-17A、IL-18、IL-23、IL-33、IFN-γ、IFN-α2 和TNF-α 水平大多数低于检测值。NDR 组、NDME 组和DME 组患者房水IL-6 水平分别为114.06[6.43,221.69]、61.17[13.41,203.41]、113.02[38.06,817.96]pg/mL。NDR 组、NDME 组和DME 组患者房水MCP-1 水平分别为1 684.58[1 163.65,4 403.20]、2 003.36[1 287.48,3 520.41]、3 296.59[1 914.98,4 677.00]pg/mL,有逐渐升高趋势。NDR 组、NDME组和DME组患者房水炎症介质水平比较,P均>0.05。
2.2 各组患者血清炎症介质水平比较 结果见表1。
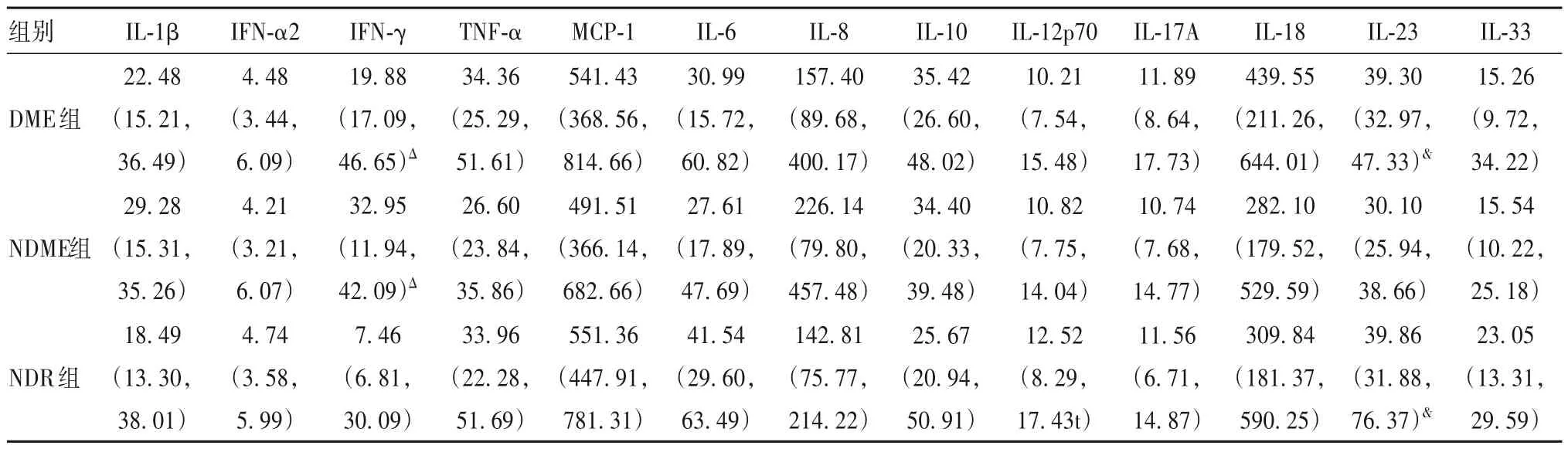
表1 各组患者血清炎症介质水平比较(pg/mL)
2.3 DME 患者房水及血清中MCP-1、IL-6 相关性 DME 患者房水MCP-1 和血清MCP-1、房水IL-6与血清IL-6 水平均无相关性(r分别为0.150、-0.358,P均>0.05)。
3 讨论
黄斑水肿是临床上常见的糖尿病眼部并发症,在病程超过20 年的糖尿病患者中约有28%合并黄斑水肿,如果不尽早进行合理治疗,约50%有黄斑水肿的NPDR 患者在2 年内丧失2 行或以上视力,是糖尿病患者致盲的主要原因[6]。有黄斑水肿的NPDR 患者房水或玻璃体炎症介质水平的升高表明该疾病与慢性低度免疫炎症反应有关[2],而眼内液标本的采集和检测比较复杂。因此,在疾病的早期阶段寻找血清中潜在的致病因子对DME 患者的监测、诊断和治疗至关重要。基于血清标本采集和检测的相对便利性,本研究探讨了有黄斑水肿的NPDR 患者房水和血清炎症介质表达水平及其相关性,结果显示,有黄斑水肿的NPDR 患者房水MCP-1 水平呈升高趋势,血清IFN-γ 和IL-23 水平升高,有黄斑水肿的NPDR 患者房水与血清中MCP-1、IL-6 水平没有相关性,提示局部和全身有不同的炎症介质在早期阶段已经参与DME 的发生发展。有黄斑水肿的NPDR 患者房水或玻璃体炎症介质水平可能发生变化,本研究进一步明确了有黄斑水肿的NPDR 患者房水MCP-1 水平已经高于NDR 组和NDME 组。研究[7]发现,抗VEGF 治疗有效的DME 患者,房水基线MCP-1 水平低于抗VEGF 治疗无效的患者,提示可参考房水炎症介质水平尽早采取治疗措施。
IFN-γ 是Th1 型细胞因子反应的经典组成部分,主要来源于T 细胞和自然杀伤细胞,可激活M1型巨噬细胞、小胶质细胞和B 细胞分泌炎症因子。TSI 等[8]发现,DR 患者玻璃体液中IFN-γ 呈现高表达,而DR 和有黄斑水肿的NPDR 患者血清IFN-γ 表达情况尚未见报道。有学者认为,在DR 不同阶段IFN-γ 表达水平不同,DR 早期血管内皮细胞及血管基底膜受损,IFN-γ 水平升高,通过促进NO 产生而诱导免疫抑制;当DR 处于增殖期时机体的免疫力下降,免疫抑制作用减弱致使IFN-γ 对VEGF 等因子的拮抗作用失衡[9],本研究证实,NPDR 患者患者血清IFN-γ 高表达,高于NDR 组。IL-23 作为IL-12家族的新成员,来源于活化的单核巨噬细胞和树突状细胞,在自身免疫性疾病、肿瘤以及眼部新生血管疾病中具有重要作用[10]。IL-23 负责Th17 细胞的存活和扩增,经过炎症因子初步诱导后,在Th17细胞分化晚期发挥作用。相关研究表明PDR 患者血清IL-17 水平显著升高[11],但尚未报道DME 患者血清IL-23 高表达,且高于没有黄斑水肿的NPDR患者,同时,IL-23 表达水平升高要早于IL-17。因此,血清IFN-γ 和IL-23 可能成为早期阶段糖尿病眼病的监测、诊断和治疗指标,关于它们在DME 发生发展中的具体作用机制,有待于进一步深入研究。IL-8 是一种有效的化学诱导剂,通过激活中性粒细胞和T 细胞促进炎症反应及新生血管形成。相关研究表明,IL-8 与胰岛素抵抗和代谢疾病有关,在T2DM 患者血清中呈现高表达,它的升高通常标志着更加严重的炎症状态以及较差的代谢控制情况[12]。目前,关于DME 和DR 患者血清IL-8 水平的报道较少,本研究结果显示,NPDR 及有黄斑水肿的NPDR 患者患者血清IL-8 水平高于NDR 组。IL-33 可由胰岛间充质细胞产生,在糖尿病发生早期,胰岛细胞被破坏导致IL-33 表达增加,促进Th2型抗炎细胞因子分泌,通过免疫反应应对细胞损伤,随后Th1/Th2 平衡偏移诱导Th1 型促炎细胞因子表达增加,加重了糖尿病严重程度[13]。IL-33 与眼部疾病关系的研究主要集中于Behcet’s 病[5]。本研究结果发现,DME 组和NDME 组患者血清IL-33 水平低于NDR,可能与其在糖尿病早期阶段发挥作用有关,因此持续高水平的IL-33 可能对糖尿病眼病发生具有抑制作用。
患者房水和血清MCP-1、IL-6 水平之间没有相关性,DME 组患者房水MCP-1 和IL-6 浓度升高,而在血清中并未见到类似现象,说明房水MCP-1 和IL-6 水平升高不是通过破坏的血-视网膜屏障从血浆渗漏而来,而是由眼局部产生。另有研究发现,DR 患者眼内液中MCP-1 和IL-6 水平高于血清[14]。以上研究结果均说明MCP-1 和IL-6 是由局部视网膜生成的。因此,NPDR 患者黄斑水肿发生涉及不同的房水和血清炎症介质,它们在局部和全身对DME 的形成发挥不同作用,血清炎症介质水平升高可能会导致白细胞瘀滞和血细胞渗出,将单核细胞募集到视网膜和血管外空间,进而引起眼内炎症介质水平升高,破坏血-视网膜屏障并导致视网膜水肿和黄斑功能障碍[15]。在疾病发展的早期阶段可以通过改善患者全身炎症状态,改善NPDR 患者黄斑水肿。
综上所述,有黄斑水肿的NPDR 患者房水MCP-1 水平呈升高趋势,血清IFN-γ 和IL-23 水平显著升高。有黄斑水肿的NPDR 患者房水及血清中炎症介质水平变化提示局部和全身不同的炎症介质在不同阶段已经参与NPDR 患者黄斑水肿的发生发展。但外周血炎症介质水平容易受到多种因素影响,且本研究尚未探讨炎症介质在NPDR 黄斑水肿发生发展中的具体作用机制,今后尚需扩大样本量进一步深入研究。

